醫(yī)藥網(wǎng)2月15日訊 系列醫(yī)藥政策改革對(duì)中國(guó)醫(yī)藥行業(yè)影響頗深嚎尤,不管是促進(jìn)藥品創(chuàng)新薪铜、提高藥品質(zhì)量療效,還是降低藥品價(jià)格等芝薇,對(duì)各方面都有積極而深遠(yuǎn)的意義戏喊。
?
各項(xiàng)政策改革和試點(diǎn)工作有條不紊地進(jìn)行陶冷,包括MAH試點(diǎn)儒溉、仿制藥一致性評(píng)價(jià)、藥品關(guān)聯(lián)審評(píng)咨堤、創(chuàng)新藥品優(yōu)先審評(píng)菇篡、“4+7”帶量采購(gòu)試點(diǎn)等漩符;并計(jì)劃對(duì)疫苗管理單獨(dú)立法,修訂現(xiàn)有的藥品管理法驱还,發(fā)布2020版《中國(guó)藥典》嗜暴,相關(guān)修訂稿也在征求意見(jiàn)。
?
緊鑼密鼓:
?
五張成績(jī)單
?
藥品受理情況匯總
?
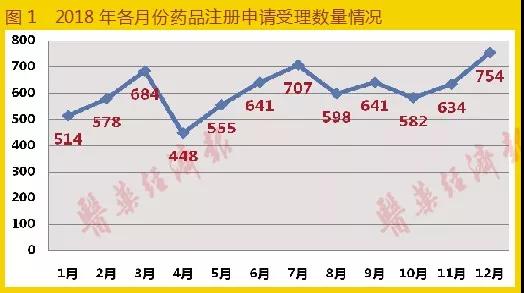
2018年议蟆,CDE承辦受理的各類藥品注冊(cè)申請(qǐng)共7336條(含輔料申請(qǐng))闷沥,相比去年同期4837條增長(zhǎng)51.7%。主要增長(zhǎng)點(diǎn)在藥品補(bǔ)充申請(qǐng)方面咐容,這可能與2018年年末是289目錄仿制藥一致性評(píng)價(jià)工作和MAH試點(diǎn)工作截止日有關(guān)舆逃,大量
企業(yè)趕在大限到來(lái)之前扎堆申報(bào)。其中化學(xué)藥注冊(cè)申請(qǐng)5969條戳粒,中藥注冊(cè)申請(qǐng)413條路狮,生物制品注冊(cè)申請(qǐng)923條,體外試劑申請(qǐng)21條恼芙。
?
?
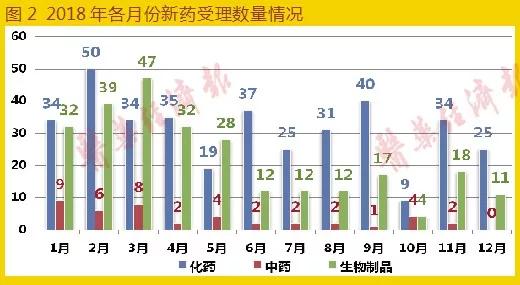
新藥申請(qǐng)共682條结晒,與去年同期618條相比增長(zhǎng)10.4%,變化不大龟冻∷樽迹化藥新藥申請(qǐng)共373條,中藥新藥申請(qǐng)共42條陋抵,生物制品新藥申請(qǐng)共264條焚怨。
?
?
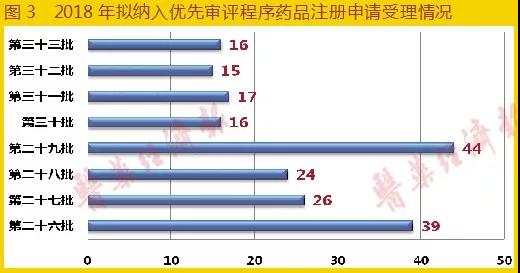
2018年截至10月17日,CDE共發(fā)布了8批次共197個(gè)擬納入優(yōu)先審評(píng)程序的藥品注冊(cè)申請(qǐng)名單钱挺,具體各批次數(shù)量如圖3所示(2018年為第26~33批)。在2018年11月7日之后蜀勃,CDE發(fā)布公告不再對(duì)擬納入優(yōu)先審評(píng)程序的藥品按批進(jìn)行公示辣沧,調(diào)整為即到即審方式組織專家進(jìn)行審核,確定優(yōu)先審評(píng)的品種驼鳞。
?
?
2018年全年哀铡,共有336個(gè)品種納入優(yōu)先審評(píng)名單,相比2017年同期237個(gè)品種增長(zhǎng)41.8%臼婆,標(biāo)志著我國(guó)藥品創(chuàng)新能力和審評(píng)效率得到了很大提升抒痒。
?
仿制藥一致性評(píng)價(jià)
?
2016年3月5日,國(guó)務(wù)院正式發(fā)文要求開(kāi)展仿制藥一致性評(píng)價(jià)工作颁褂,確定了首批289個(gè)必須在2018年底前完成一致性評(píng)價(jià)的化學(xué)口服固體制劑品種目錄故响。
?
公告發(fā)布至今,共發(fā)布了19批次1151條參比制劑目錄颁独,并于2017年11月11日和2018年7月31日分別發(fā)布了兩批次《可豁免或簡(jiǎn)化人體生物等效性試驗(yàn)(BE)品種》目錄彩届,共涵蓋72個(gè)品種伪冰。
?
截至2018年年底,有關(guān)一致性評(píng)價(jià)累計(jì)受理號(hào)已達(dá)708個(gè)樟蠕,涉及253家企業(yè)的205個(gè)品種贮聂,已有149個(gè)品規(guī)通過(guò)或視同通過(guò)仿制藥一致性評(píng)價(jià),但289目錄中僅有62個(gè)品規(guī)32個(gè)品種通過(guò)了一致性評(píng)價(jià)寨辩。其中吓懈,1個(gè)品規(guī)通過(guò)企業(yè)有5家,3個(gè)品規(guī)通過(guò)企業(yè)有4家靡狞,6個(gè)品規(guī)通過(guò)企業(yè)有3家拷拥,14個(gè)品規(guī)通過(guò)企業(yè)有2家,86個(gè)品規(guī)通過(guò)企業(yè)有1家豌泊。涉及289目錄品種的通過(guò)率為11.1%们灵。
?
2018年12月28日,《國(guó)家藥品監(jiān)督管理局關(guān)于仿制藥質(zhì)量和療效一致性評(píng)價(jià)有關(guān)事項(xiàng)的公告》和《關(guān)于仿制藥質(zhì)量和療效一致性評(píng)價(jià)有關(guān)事項(xiàng)的公告》政策解讀發(fā)布怔于,將通過(guò)一致性評(píng)價(jià)的品種優(yōu)先納入目錄禀蜒,未通過(guò)一致性評(píng)價(jià)的品種將逐步被調(diào)出目錄,對(duì)納入國(guó)家基本藥物目錄的品種不再統(tǒng)一設(shè)置評(píng)價(jià)時(shí)限要求姚详。
?
這意味著“289目錄藥品”一致性評(píng)價(jià)大限延期了槐猪。但延期并不代表可以無(wú)限拖后,仍有 “自首家品種通過(guò)一致性評(píng)價(jià)后腮稚,其他藥品生產(chǎn)企業(yè)的相同品種原則上應(yīng)在3年內(nèi)完成一致性評(píng)價(jià)许食。逾期未完成的,企業(yè)經(jīng)評(píng)估認(rèn)為屬于臨床必需挽饺、市場(chǎng)短缺品種的够菊,可向所在地省級(jí)藥監(jiān)部門(mén)提出延期評(píng)價(jià)申請(qǐng),經(jīng)省級(jí)藥監(jiān)部門(mén)會(huì)同衛(wèi)生行政部門(mén)組織研究認(rèn)定后恨溜,可予適當(dāng)延期”的規(guī)定符衔。
?
“289目錄藥品”的整體延期,給各藥企緊繃的神經(jīng)稍微松了一下弦糟袁,可以有更多時(shí)間進(jìn)行一致性評(píng)價(jià)的考量和研究工作判族。但是,為了保證自身競(jìng)爭(zhēng)力项戴,盡快通過(guò)一致性評(píng)價(jià)才是正途形帮。
?
MAH試點(diǎn)進(jìn)展
?
MAH(藥品上市許可持有人)試點(diǎn)工作也迎來(lái)了延期,2018年10月27日發(fā)布了MAH試點(diǎn)工作延長(zhǎng)一年的決定周叮。
?
延期的主要原因是要與《藥品管理法》的修訂工作相銜接辩撑。據(jù)流出的修訂稿,MAH將是新版藥品管理法的修訂重點(diǎn)之一。
?
MAH制度落實(shí)了持有人法律責(zé)任槐臀,持有人負(fù)責(zé)藥品生產(chǎn)銷(xiāo)售全鏈條和藥品全生命周期管理锄蹂。該制度試行后,試點(diǎn)各省市積極響應(yīng)水慨,發(fā)布了一系列優(yōu)惠政策和指導(dǎo)原則得糜,2016年各省市提交的試點(diǎn)品種申報(bào)總數(shù)就已經(jīng)達(dá)到了165個(gè),其中臨床試驗(yàn)申請(qǐng)有97個(gè)现熔,上市申請(qǐng)44個(gè)服骚,補(bǔ)充申請(qǐng)24個(gè),提交申報(bào)數(shù)量最多的省份是廣東省展霸,有47個(gè)蝎蛤,緊隨其后的是江蘇和上海,分別為38個(gè)和25個(gè)莺肌。2016年12月23日挪吱,齊魯制藥的吉非替尼及片劑成為我國(guó)首個(gè)MAH制度試點(diǎn)品種。
?
進(jìn)入2017年后辈喜,MAH申請(qǐng)?jiān)圏c(diǎn)工作成果顯著捺柬,從第一個(gè)獲批的MAH創(chuàng)新藥品種,到第一個(gè)通過(guò)MAH制度完成藥品生產(chǎn)技術(shù)轉(zhuǎn)移砖伴,再到第一個(gè)MAH試點(diǎn)中藥品種望泪,以及第一個(gè)支持獲批創(chuàng)新藥的受托企業(yè)。
?
試點(diǎn)三年多來(lái)愧汽,激發(fā)藥物創(chuàng)新活力宾芥、優(yōu)化資源配置、減少重復(fù)建設(shè)等預(yù)期作用逐步顯現(xiàn)横朋÷匚冢跨省委托生產(chǎn)的相關(guān)政策也正在研究商討中,試點(diǎn)工作結(jié)束后在多個(gè)地區(qū)推行的前景可期琴锭。
?
藥品關(guān)聯(lián)審評(píng)
?
藥包材晰甚、藥用
輔料和藥品從2016年8月10日起開(kāi)始施行關(guān)聯(lián)審評(píng),從2017年11月30日起原料藥也納入了關(guān)聯(lián)審評(píng)的范疇祠够。
?
根據(jù)CDE官網(wǎng)數(shù)據(jù)庫(kù)压汪,截至2019年1月8日粪牲,原料藥登記數(shù)量共2717條古瓤,其中激活并批準(zhǔn)完成與上市制劑聯(lián)合審評(píng)審批的數(shù)量為172條,占比6.33%腺阳;輔料登記數(shù)量共1316條落君,其中激活并批準(zhǔn)完成與上市制劑聯(lián)合審評(píng)審批的數(shù)量為19條,占比1.44%亭引;藥包材登記數(shù)量共2741條绎速,其中激活并批準(zhǔn)完成與上市制劑聯(lián)合審評(píng)審批的數(shù)量為3條皮获,占比0.11%。
?
這個(gè)結(jié)果受到藥品審評(píng)所需時(shí)限和政策過(guò)渡的影響抠衬,具體而言有以下三點(diǎn):
?
1.政策公布前已經(jīng)獲得注冊(cè)批件或再注冊(cè)批件的原輔料包材產(chǎn)品的證書(shū)裸岁,只要還在有效期內(nèi),依然可以在藥物制劑中使用锹肾,因此這些廠商對(duì)于申請(qǐng)藥品關(guān)聯(lián)審評(píng)的熱情不大郊啄。待證書(shū)到期后,完成關(guān)聯(lián)審評(píng)的數(shù)量將逐步上升奥泛。
?
2.政策公布后寄菲,申請(qǐng)的原輔料包材產(chǎn)品前期研究工作時(shí),大部分未尋找相應(yīng)制劑廠家合作進(jìn)行聯(lián)合申報(bào)虫弓,需臨時(shí)尋找制劑廠商重新申報(bào)起胡。
?
3.政策變更后,相關(guān)申報(bào)資料要求日趨嚴(yán)格抛伏,審評(píng)標(biāo)準(zhǔn)也相應(yīng)提高息沐。另外,對(duì)于原輔料包材產(chǎn)品還新增了年度報(bào)告的要求烛许,生產(chǎn)企業(yè)和審評(píng)人員都需要一段時(shí)間去整改和適應(yīng)新的政策要求祭昏。
?
隨著相關(guān)政策和指導(dǎo)原則的不斷完善,以及先前原輔料和藥包材“政策福利”逐漸到期强挫,加上一致性評(píng)價(jià)工作和MAH制度對(duì)高質(zhì)量藥用原輔料和藥包材需求的不斷提高岔霸,將促使更多原輔料和藥包材企業(yè)積極尋找與藥用制劑廠商的合作,并不斷提高自身產(chǎn)品的質(zhì)量俯渤。
?
?“4+7”帶量采購(gòu)
?
2018年11月14日呆细,“4+7帶量采購(gòu)試點(diǎn)工作”啟動(dòng)。采購(gòu)藥品多數(shù)為通過(guò)了藥品一致性評(píng)價(jià)的品種八匠,目的是為了在提高藥品質(zhì)量的同時(shí)進(jìn)一步降低藥品價(jià)格絮爷。從“預(yù)中選”到“擬中選”,根據(jù)申報(bào)企業(yè)數(shù)梨树、報(bào)價(jià)坑夯、銷(xiāo)售量等具體情況進(jìn)行了細(xì)致的規(guī)定。為確保中選藥品及時(shí)配送抡四,還設(shè)置了“應(yīng)急預(yù)案”柜蜈,將對(duì)“違規(guī)名單”企業(yè)停止采購(gòu)資格,并啟動(dòng)應(yīng)急預(yù)案指巡。
?
最終淑履,本次帶量采購(gòu)共有25個(gè)產(chǎn)品成功降價(jià),平均降價(jià)幅度52%,最高降幅達(dá)到96%蹂曾。
?
2019年1月17日雁韵,國(guó)務(wù)院辦公廳《國(guó)家組織藥品集中采購(gòu)和使用試點(diǎn)方案》進(jìn)一步明確了四大保障措施:帶量采購(gòu),以量換價(jià)蕴嘹;招采合一颊嫁,保證使用;確保質(zhì)量闹只,保障供應(yīng)蛆骨;保證匯款,降低交易成本裙澎。
?
“4+7”帶量采購(gòu)雖為試點(diǎn)洒妈,但可謂我國(guó)
藥品招采未來(lái)走向的風(fēng)向標(biāo)。其在正式實(shí)施的過(guò)程中艘彭,相關(guān)的配套細(xì)則如何規(guī)定蛮碾,讓我們拭目以待。
?
即將發(fā)布:
?
三個(gè)關(guān)鍵政策
?
為了更好地保障用藥的安全性和可及性跟狱,一些重磅的
醫(yī)藥政策已經(jīng)在醞釀中俭厚,在不久的將來(lái),也將對(duì)國(guó)內(nèi)醫(yī)藥行業(yè)產(chǎn)生深刻影響驶臊。
?
疫苗管理法
?
為了更好地對(duì)疫苗研制挪挤、生產(chǎn)、流通关翎、預(yù)防接種的全過(guò)程進(jìn)行監(jiān)控扛门,我國(guó)擬對(duì)疫苗管理單獨(dú)立法,建立起系統(tǒng)全鏈條的疫苗管理制度纵寝,突出疫苗管理特點(diǎn)论寨,強(qiáng)化疫苗的風(fēng)險(xiǎn)管理、全程控制爽茴、嚴(yán)格監(jiān)管和社會(huì)共治葬凳,切實(shí)保證疫苗安全、有效和規(guī)范接種室奏。
?
新版藥品管理法及管理?xiàng)l例
?
從最新流出稿可以看出火焰,對(duì)藥品的管理要求和力度將全面上升;新增了與藥品上市許可持有人胧沫、藥品專利塘憨、藥品保險(xiǎn)制度等有關(guān)的多項(xiàng)條例;優(yōu)化藥品審評(píng)的人員結(jié)構(gòu)配置执峰,對(duì)藥品審評(píng)人員的專業(yè)水平也有了更高的要求涎花。
?
《中國(guó)藥典》2020年版
?
時(shí)間已經(jīng)來(lái)到2019年,距2020版藥典的發(fā)布日期越來(lái)越近饭磕,各項(xiàng)編修和校準(zhǔn)核對(duì)工作也已接近尾聲瞒酪。
?
根據(jù)征求意見(jiàn)稿,預(yù)計(jì)收載品種總數(shù)6400個(gè)左右现伺,其中:中藥增加品種約220個(gè)测佛,化學(xué)藥增加品種約420個(gè),生物制品增加品種收載30個(gè)嘹据,藥用輔料增加品種約100個(gè)影凿,藥包材品種收載30個(gè),共約800個(gè)茎贩。藥典已收載品種計(jì)劃修訂1400個(gè)第勉,其中:中藥500個(gè),化藥600個(gè)锅锨,生物制品150個(gè)叽赊,藥用輔料150個(gè)。
?
加大對(duì)已取消文號(hào)必搞、長(zhǎng)期不生產(chǎn)必指、質(zhì)量不可控、劑型不合理恕洲、穩(wěn)定性不高的藥品標(biāo)準(zhǔn)的淘汰力度塔橡,進(jìn)一步從橫向和縱向?qū)ι婕案黝愃幤返乃幍浞怖⒅苿┩▌t霜第、總論葛家、檢驗(yàn)方法以及指導(dǎo)原則等進(jìn)行編制與修訂,逐步加強(qiáng)和完善涉及藥品研發(fā)泌类、生產(chǎn)惦银、流通和使用等環(huán)節(jié)的通用性技術(shù)要求以及指導(dǎo)原則體系的建設(shè)。

 政策法規(guī)
政策法規(guī)
 醫(yī)藥經(jīng)濟(jì)報(bào)
醫(yī)藥經(jīng)濟(jì)報(bào)  2019-02-15
2019-02-15
 4421
4421

 政策法規(guī)
政策法規(guī)
 CDE
CDE  2024-11-21
2024-11-21
 123
123

 政策法規(guī)
政策法規(guī)
 國(guó)家藥監(jiān)局
國(guó)家藥監(jiān)局  2024-10-24
2024-10-24
 209
209

 政策法規(guī)
政策法規(guī)
 廣東省人民政府
廣東省人民政府  2024-10-09
2024-10-09
 285
285
 熱門(mén)資訊
熱門(mén)資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽