
 政策法規(guī)
政策法規(guī)
 Insight醫(yī)藥情報(bào)局
Insight醫(yī)藥情報(bào)局  2019-05-23
2019-05-23
 6159
6159
剛剛男窿,國(guó)家藥監(jiān)局通知唐瀑,「重組帶狀皰疹疫苗」和「地舒單抗注射液」獲批進(jìn)口揩墓!?2 個(gè)均為第一批臨床急需境外新藥。

圖片來(lái)源:Insight醫(yī)藥情報(bào)局
2 批名單房幌,共 78 個(gè)臨床急需新藥
截至目前材哺,CDE 共發(fā)布 2 批臨床急需境外新藥名單,共包括 78 個(gè)新藥毁察,全部都是國(guó)內(nèi)缺乏的救命新藥赘湾,主要針對(duì)罕見(jiàn)病、國(guó)內(nèi)尚無(wú)有效治療手段的藥品罚考、與現(xiàn)有治療手段相比具有明顯臨床優(yōu)勢(shì)的新藥煞嫩。
在 2018 年 11 月 1 日,CDE 公布第一批名單的同時(shí)宣布笼踩,已經(jīng)有 8 個(gè)在我國(guó)獲批上市逗爹,那么半年以后,又有哪些臨床急需境外新藥品種在我國(guó)獲批上市了嚎于?又有哪些企業(yè)的品種開(kāi)始申報(bào)了掘而?
政策依據(jù)
2018 年,藥監(jiān)局發(fā)布臨床急需境外新藥審評(píng)審批相關(guān)公告于购,此后袍睡,臨床急需境外新藥在中國(guó)的上市正式進(jìn)入“跑步”階段。
政策給臨床急需境外新藥在國(guó)內(nèi)的獲批開(kāi)辟了加速通道,申請(qǐng)人在證明不存在人種差異的基礎(chǔ)上嫌吠,可以直接提出上市申請(qǐng)止潘;這一政策,至少將國(guó)外新藥在中國(guó)上市的時(shí)長(zhǎng)縮短 1-2 年。
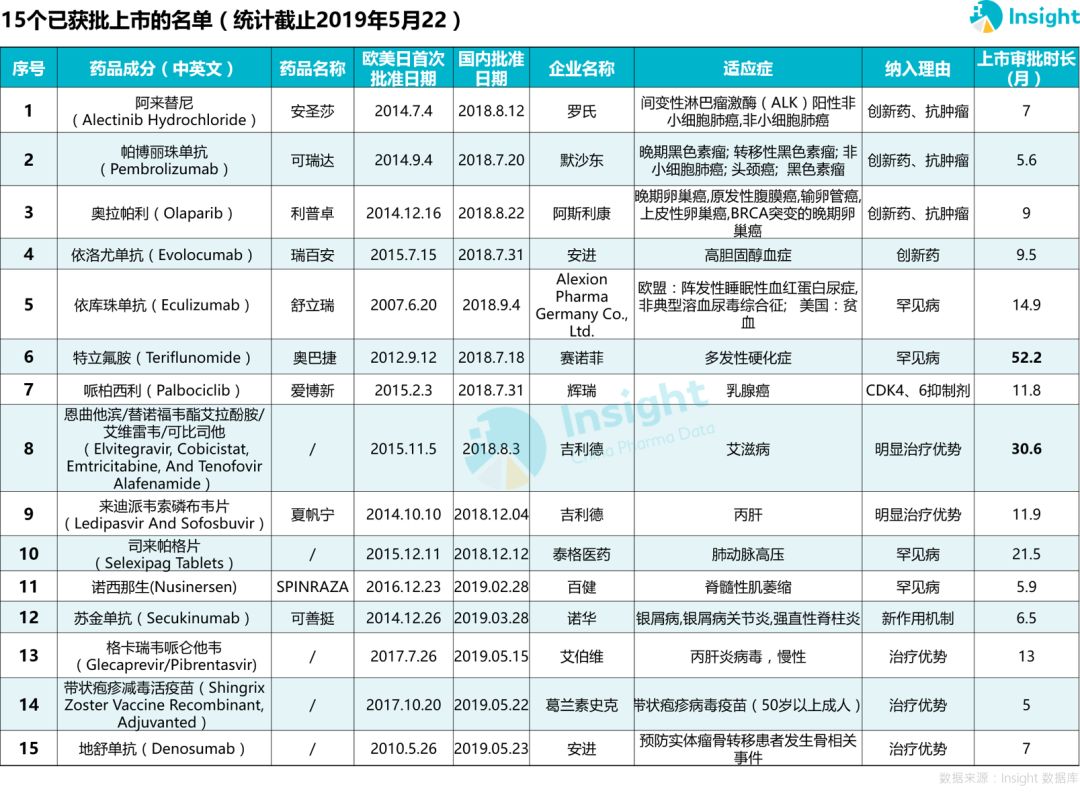
15 個(gè)品種獲批上市凭戴,平均時(shí)長(zhǎng) 9.9 個(gè)月
根據(jù)每個(gè)品種在中國(guó)的審評(píng)時(shí)長(zhǎng)統(tǒng)計(jì)發(fā)現(xiàn)涧狮,除了賽諾菲「特立氟胺」和吉利德「恩曲他濱/替諾福韋酯艾拉酚胺/艾維雷韋/可比司他」分別于 2014 年和 2016 年申報(bào)上市外,其余品種均為 2017 年及以后開(kāi)始報(bào)產(chǎn)逆酣,從申報(bào)上市到獲批上市平均時(shí)長(zhǎng)為 9.9 個(gè)月刹越。
15 個(gè)獲批上市的品種中,有4 個(gè)罕見(jiàn)病用藥殖锹。
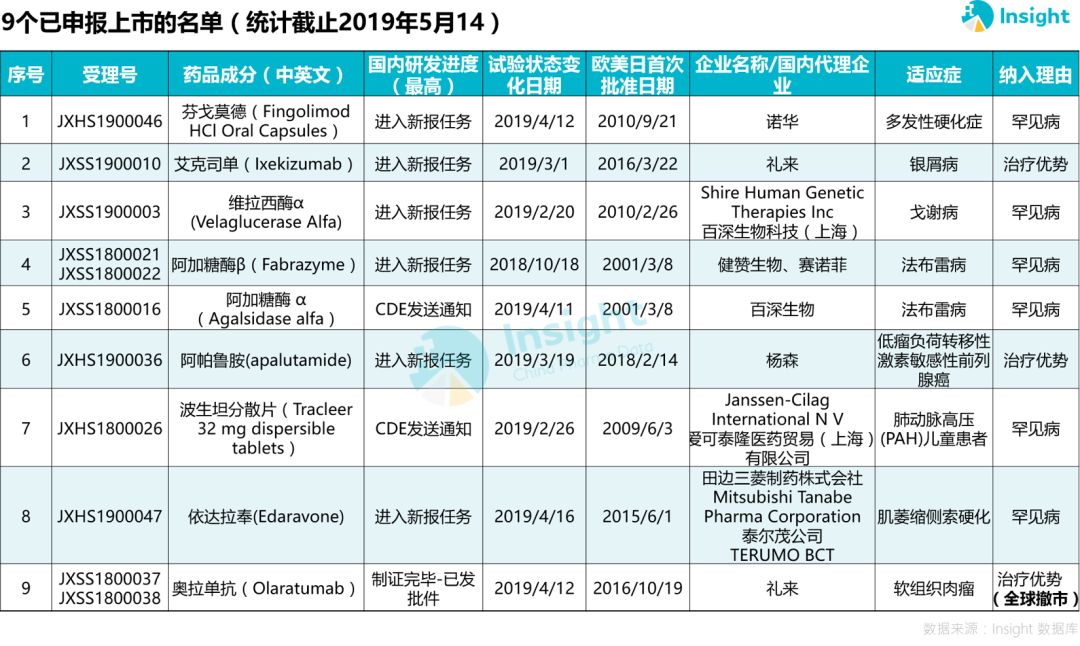
27 個(gè)藥品開(kāi)始申報(bào)靡循,9 個(gè)已報(bào)上市
據(jù) Insight 數(shù)據(jù)庫(kù)統(tǒng)計(jì),76 個(gè)品種除去已獲批上市的 15 個(gè)彪选,已經(jīng)有 27 個(gè)品種啟動(dòng)國(guó)內(nèi)申報(bào)厚饱,啟動(dòng)率達(dá)到 53.8%。
分析報(bào)上市的 9 個(gè)品種發(fā)現(xiàn)剂现,有?6 個(gè)為罕見(jiàn)病用藥捕如,預(yù)計(jì)會(huì)在 2020 年相繼獲批上市。
這在很大程度上得益于國(guó)家對(duì)罕見(jiàn)病茁臀、重大疾病等的藥品政策紅利揩池,努力縮小國(guó)內(nèi)與全球用藥可及性的差距。
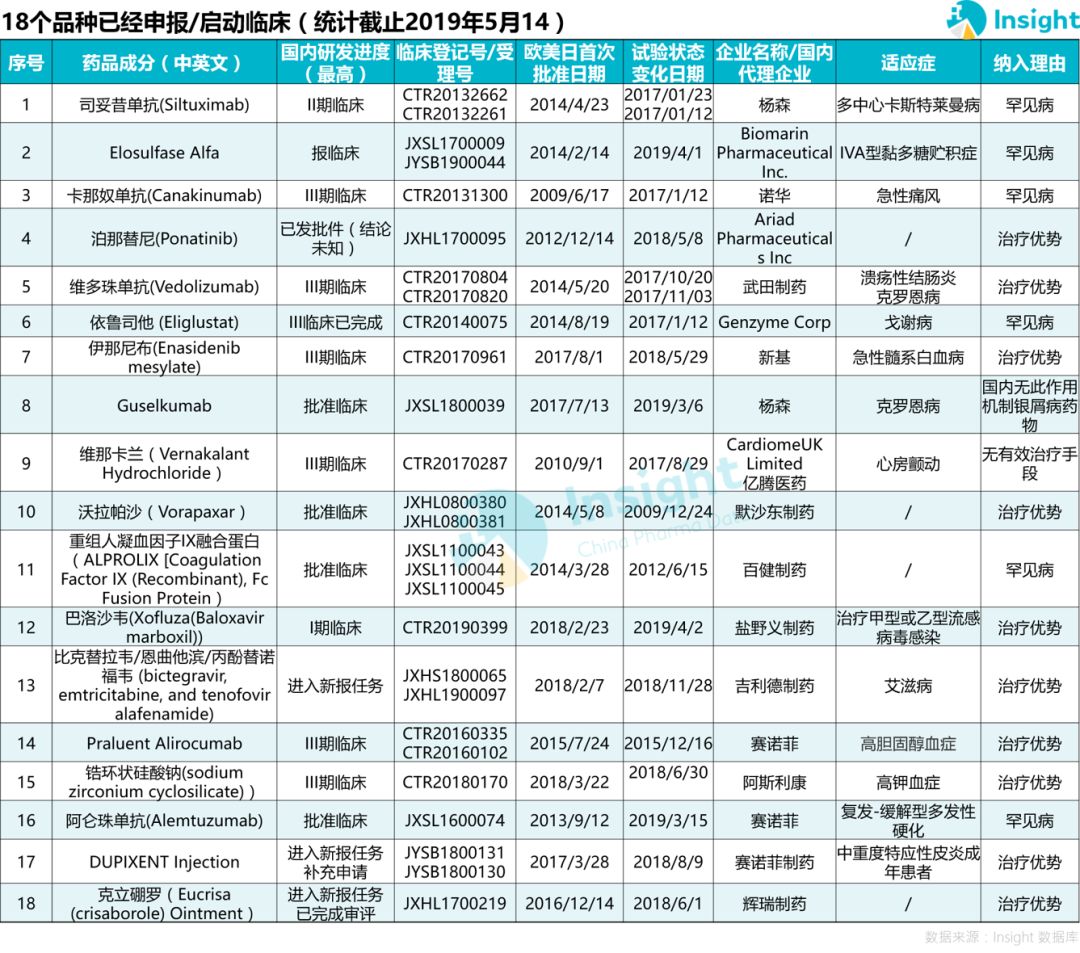
此外堆因,還有 18 個(gè)品種已經(jīng)申報(bào)/啟動(dòng)國(guó)內(nèi)臨床泪桥。
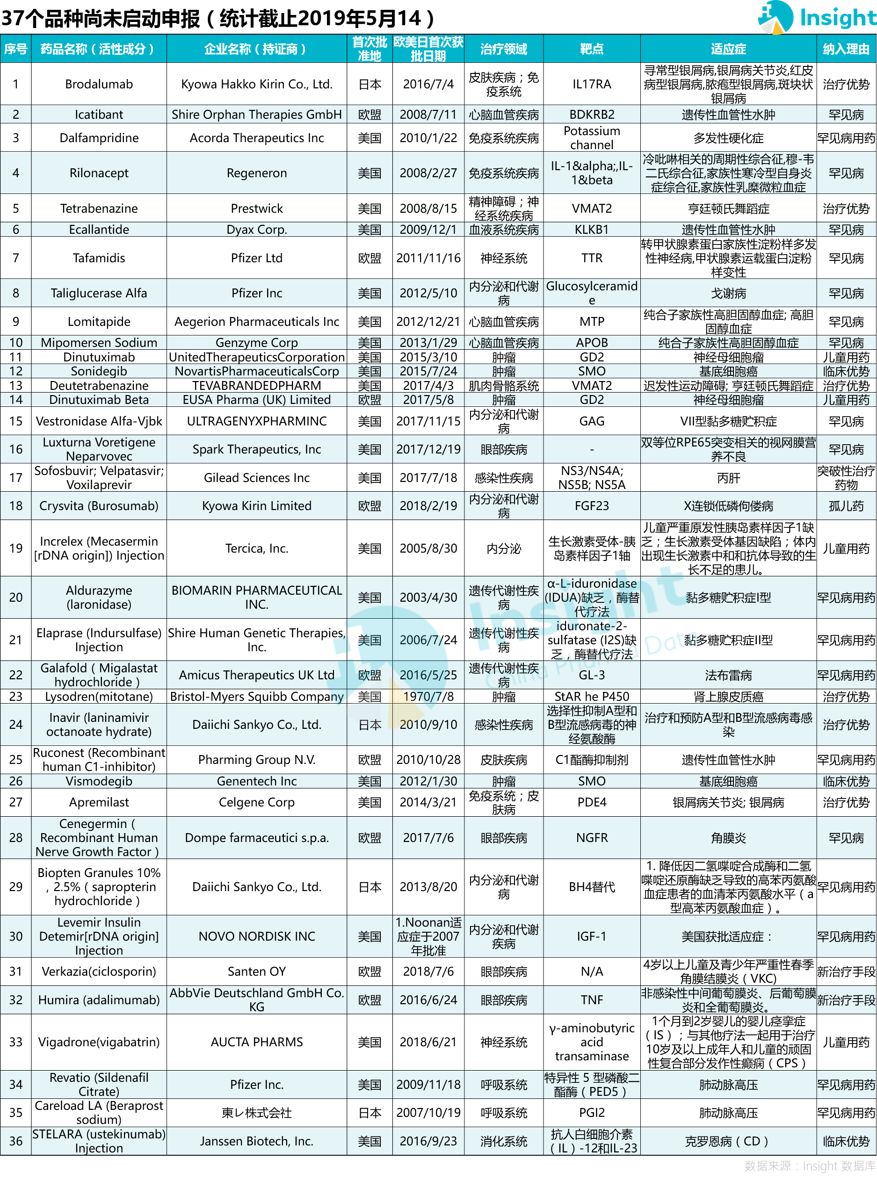
36 個(gè)品種暫未開(kāi)展國(guó)內(nèi)申報(bào)
還有一批藥品,至今未查詢到在國(guó)內(nèi)的申報(bào)情況久窟,一共有 36 個(gè)品種秩冈,其中罕見(jiàn)病藥物有 20 個(gè)。
目前全球已知罕見(jiàn)病有 7000 多種斥扛。罕見(jiàn)病發(fā)病率低入问,患者少,市場(chǎng)需求少稀颁,藥物研發(fā)周期和成本較高芬失,因此長(zhǎng)期以來(lái)研究進(jìn)展緩慢,國(guó)產(chǎn)罕見(jiàn)病藥物更是少之又少匾灶;這種情況下棱烂,引進(jìn)境外已獲批的新藥,成了最快阶女、最直接的解決用藥可及性的手段颊糜。
結(jié)語(yǔ)
總體看來(lái),78個(gè)臨床急需境外新藥名單中的品種申報(bào)啟動(dòng)率比較高秃踩,為53.8%芭析,預(yù)計(jì)這些新藥會(huì)在 2020 年陸續(xù)獲批上市悄贴;屆時(shí)悟唆,相關(guān)疾病無(wú)藥可用或用藥不合理的局面會(huì)得以改善傀掘。
國(guó)家對(duì)于臨床急需境外新藥的包容性給予廣大患者帶來(lái)希望,同時(shí)也給了外資企業(yè)拓展中國(guó)市場(chǎng)增加了一劑催化劑拗辜;然而圃星,這對(duì)于國(guó)內(nèi)的制藥企業(yè)來(lái)說(shuō),尤其是立足于新藥研發(fā)的企業(yè)烤眉,則是巨大挑戰(zhàn)丘苗,因?yàn)檫@加劇了國(guó)內(nèi)創(chuàng)新藥研發(fā)的激烈程度。
所以烦盛,在未來(lái)創(chuàng)新藥的大環(huán)境下梦迂,只有那些堅(jiān)持高質(zhì)量、高標(biāo)準(zhǔn)的企業(yè)才能在激烈的競(jìng)爭(zhēng)中站穩(wěn)腳跟紧邑。

 政策法規(guī)
政策法規(guī)
 CDE
CDE  2024-11-21
2024-11-21
 118
118

 政策法規(guī)
政策法規(guī)
 國(guó)家藥監(jiān)局
國(guó)家藥監(jiān)局  2024-10-24
2024-10-24
 209
209

 政策法規(guī)
政策法規(guī)
 廣東省人民政府
廣東省人民政府  2024-10-09
2024-10-09
 285
285
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽