
 協(xié)會(huì)活動(dòng)
協(xié)會(huì)活動(dòng)
 2020-02-25
2020-02-25
 5402
5402
2019年底,新型冠狀病毒感染肺炎肆虐全國(guó)英古,疫情發(fā)生后中央高度重視夜勋,習(xí)近平總書(shū)記在中央全面深化改革委員會(huì)第十二次會(huì)議上明確指出歌懒,“要從體制機(jī)制上創(chuàng)新和完善重大疫情防控舉措种车,健全國(guó)家公共衛(wèi)生應(yīng)急管理體系驴党,提高應(yīng)對(duì)突發(fā)重大公共衛(wèi)生事件的能力水平”驱糜。
中國(guó)醫(yī)藥創(chuàng)新促進(jìn)會(huì)(以下簡(jiǎn)稱(chēng)“我會(huì)”)作為致力于推動(dòng)醫(yī)療衛(wèi)生體制機(jī)制創(chuàng)新發(fā)展歼取,保障人民群眾健康的專(zhuān)業(yè)性團(tuán)體,積極響應(yīng)國(guó)家號(hào)召谐绽,按照習(xí)總書(shū)記指示精神死发,緊急組織力量認(rèn)真研究美國(guó)日本等發(fā)達(dá)國(guó)家應(yīng)對(duì)突發(fā)重大公共衛(wèi)生事件藥品緊急授權(quán)使用制度(EUA),在充分借鑒國(guó)際成熟經(jīng)驗(yàn)的基礎(chǔ)上并結(jié)合我國(guó)國(guó)情绑僵,形成了《關(guān)于建立我國(guó)突發(fā)衛(wèi)生公共事件藥品緊急授權(quán)使用制度的建議》(以下簡(jiǎn)稱(chēng)“建議”)并報(bào)送中共中央全面深化改革委員會(huì)辦公室和國(guó)務(wù)院醫(yī)藥衛(wèi)生與科技等有關(guān)行政管理部門(mén)谴眶。
建議主要包括三大大內(nèi)容:
一、建議修改相關(guān)法律并制定行政法規(guī)池致,為建立藥品緊急授權(quán)提供法律依據(jù)
建議通過(guò)立法或修法授權(quán)為建立我國(guó)藥品緊急授權(quán)使用制度及相關(guān)管理體系奠定法律基礎(chǔ)宰蘸。由國(guó)家藥品管理行政部門(mén)制定藥品緊急授權(quán)使用制度及實(shí)施方案,報(bào)請(qǐng)國(guó)務(wù)院批準(zhǔn)并頒布相關(guān)行政法規(guī)作為《突發(fā)事件應(yīng)對(duì)法》和《藥品管理法》的配套法規(guī)剥犯,以規(guī)范應(yīng)急藥品的特別審批與使用管理捂臣,明確發(fā)生重大突發(fā)公共衛(wèi)生事件或嚴(yán)重威脅生命健康疾病時(shí),授權(quán)國(guó)家藥品監(jiān)管部門(mén)緊急臨時(shí)批準(zhǔn)特定醫(yī)療產(chǎn)品(化學(xué)藥品邓星、中成藥堡掏、生物制品和診斷醫(yī)療器械),用于突發(fā)事件及重大傳染性疾病的預(yù)防刨疼、診斷和治療泉唁。
二、建立藥品緊急授權(quán)使用制度特別審批程序
建議基于“快速審批揩慕、快速使用亭畜、快速調(diào)整”原則扮休,建立我國(guó)藥品緊急授權(quán)使用(CEUA)制度。建議內(nèi)容包括CEUA的啟動(dòng)拴鸵,適用品種范圍玷坠、申報(bào)要求與審評(píng)審批要點(diǎn),CEUA 藥品使用風(fēng)險(xiǎn)控制和監(jiān)管宝踪,建立CEUA 與正常上市許可轉(zhuǎn)化與激勵(lì)機(jī)制侨糟,建立CEUA 授權(quán)責(zé)任豁免機(jī)制以及CEUA 授權(quán)終止后的監(jiān)管等六大部分內(nèi)容碍扔。
(一)藥品緊急授權(quán)使用(CEUA)啟動(dòng)
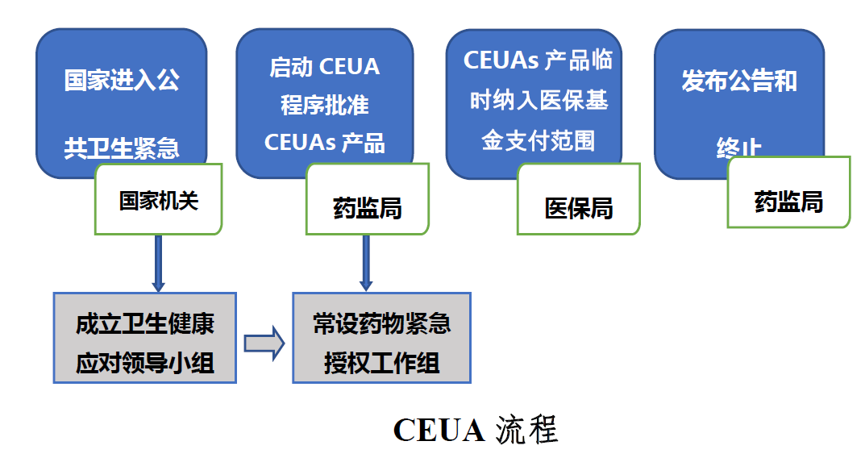
當(dāng)國(guó)務(wù)院或國(guó)務(wù)院授權(quán)有關(guān)部門(mén)宣布進(jìn)入突發(fā)公共衛(wèi)生事件防控緊急狀態(tài)時(shí)瘩燥,國(guó)家藥品監(jiān)督管理局(NMPA)即啟動(dòng)藥品緊急授權(quán)使用制度。
組建由藥品與衛(wèi)生行政管理部門(mén)與相關(guān)機(jī)構(gòu)組成的CEUA專(zhuān)業(yè)領(lǐng)導(dǎo)工作組不同,負(fù)責(zé)確定發(fā)布適用CEUA醫(yī)藥產(chǎn)品的范圍露揽,研究制定CEUA適用產(chǎn)品風(fēng)險(xiǎn)效益評(píng)價(jià)策略,以及研究制定加快應(yīng)對(duì)突發(fā)公共衛(wèi)生事件的潛在醫(yī)藥產(chǎn)品審評(píng)審批政策與相關(guān)EUCA產(chǎn)品使用監(jiān)管評(píng)估策略酵吴。
按照申報(bào)或潛在CEUA 產(chǎn)品分類(lèi)屏部,成立CEUA 專(zhuān)項(xiàng)審評(píng)工作組,以加快CEUA產(chǎn)品審批律腊。
?
(二)CEUA申報(bào)要求與審評(píng)審批
建議對(duì)CEUA適用產(chǎn)品范圍藐捉、申報(bào)主體以及適用未滿(mǎn)足臨床需求的情形等進(jìn)行了研究,并提出除了沒(méi)有有效治療產(chǎn)品外辑蛔,未滿(mǎn)足臨床需求還應(yīng)包括已批準(zhǔn)上市藥品生產(chǎn)能力不足氛玛、已批準(zhǔn)上市藥品有特殊禁忌人群和產(chǎn)品劑型不適宜特殊人群服用以及不適宜急救治療等。
建議還針對(duì)新申請(qǐng)藥物昔主、增加新適應(yīng)癥以及授權(quán)仿制與依法開(kāi)展強(qiáng)制許可仿制等不同產(chǎn)品類(lèi)別的申報(bào)要求蹂勺,提交研究數(shù)據(jù)、報(bào)告證據(jù)級(jí)別字钓,審評(píng)原則與評(píng)價(jià)方法等進(jìn)行研究并提出原則性建議:
提交IND或NDA申請(qǐng)的在研藥物可以申報(bào)CEUA携帘;國(guó)外已上市產(chǎn)品或者未上市藥物可以使用國(guó)際多中心臨床試驗(yàn)數(shù)據(jù)或者符合法定要求的境外臨床試驗(yàn)數(shù)據(jù)提交申請(qǐng);列入國(guó)家或者省級(jí)應(yīng)急準(zhǔn)備科研計(jì)劃項(xiàng)目或國(guó)家應(yīng)急準(zhǔn)備緊急科技項(xiàng)目的藥物可以直接提交申請(qǐng)姊象。
未上市藥品除需要提交擬用適應(yīng)癥和用法旨椒,產(chǎn)品作用機(jī)理等基本資料外還應(yīng)提交質(zhì)量研究報(bào)告、非臨床研究報(bào)告以及臨床研究報(bào)告堵漱;已批準(zhǔn)上市藥品增加新適應(yīng)癥的综慎,如新用途對(duì)患者群體引入新的風(fēng)險(xiǎn),則要求提供體外試驗(yàn)怔锌、動(dòng)物毒性試驗(yàn)或者人體臨床使用經(jīng)驗(yàn)和數(shù)據(jù)寥粹,否則可以上市批準(zhǔn)數(shù)據(jù)支持申報(bào);授權(quán)或強(qiáng)制仿制藥品按照藥品注冊(cè)法規(guī)要求提交基本資料與生物等效性試驗(yàn)或者體外研究資料埃元。
產(chǎn)品審查期間涝涤,應(yīng)及時(shí)提交可能改變對(duì)產(chǎn)品安全性或有效性評(píng)價(jià)的所有試驗(yàn)數(shù)據(jù)(例如長(zhǎng)期穩(wěn)定性研究數(shù)據(jù)媚狰,在緊急狀態(tài)期間與CEUA同時(shí)進(jìn)行的相關(guān)對(duì)照臨床試驗(yàn)數(shù)據(jù))。
CEUA專(zhuān)項(xiàng)審評(píng)員可與CEUA產(chǎn)品申報(bào)者或者潛在的CEUA藥品(特別是處于研發(fā)后期的藥物)持有人就申報(bào)要求或關(guān)鍵技術(shù)問(wèn)題進(jìn)行溝通和交流阔拳,以提升申報(bào)資料的完整性并加快審批崭孤。
CEUA專(zhuān)項(xiàng)審評(píng)工作組對(duì)提交數(shù)據(jù)的數(shù)量與質(zhì)量進(jìn)行評(píng)估,對(duì)符合要求的證據(jù)進(jìn)行全面風(fēng)險(xiǎn)效益評(píng)價(jià)糊肠,符合要求的NMPA可以批準(zhǔn)緊急使用辨宠。CEUA產(chǎn)品有效期應(yīng)不長(zhǎng)于緊急狀態(tài)的期限。緊急狀態(tài)終止捌养,CEUA授權(quán)效力即終止湾蝙,所有CEUA產(chǎn)品將不再用于除依法開(kāi)展的臨床試驗(yàn)以外的治療。
為提高緊急狀況下CEUA產(chǎn)品信息傳遞效率螃妨,NMPA或相關(guān)部門(mén)可在官網(wǎng)發(fā)布CEUA產(chǎn)品所有相關(guān)信息供公眾閱讀惰绘,包括批準(zhǔn)的CEUA產(chǎn)品名稱(chēng)、授權(quán)通知耐叽、產(chǎn)品說(shuō)明書(shū)(醫(yī)務(wù)人員版蟀蛆、患者版)、產(chǎn)品制造商信息录抖,并及時(shí)更新產(chǎn)品信息男沛。
建立不良反應(yīng)監(jiān)測(cè)與動(dòng)態(tài)評(píng)價(jià)機(jī)制,保障CEUA產(chǎn)品的安全使用两候。
三滞泣、建立應(yīng)急藥品監(jiān)管政府協(xié)同機(jī)制
由國(guó)家衛(wèi)健委組織藥監(jiān)局、科技部彰晌、發(fā)改委领姨、工信部、醫(yī)保局张弛、社會(huì)保障部等相關(guān)部門(mén)成立衛(wèi)生健康緊急應(yīng)對(duì)領(lǐng)導(dǎo)小組荒典。為應(yīng)對(duì)未來(lái)重大突發(fā)公共衛(wèi)生事件發(fā)生,研究制定公共衛(wèi)生健康威脅防控應(yīng)對(duì)戰(zhàn)略與措施吞鸭;制定國(guó)家應(yīng)對(duì)突發(fā)公共衛(wèi)生健康威脅的治療藥物研發(fā)與流行病基礎(chǔ)研究規(guī)劃寺董;以及鼓勵(lì)國(guó)產(chǎn)應(yīng)急藥物如抗病毒藥物研發(fā)應(yīng)用的創(chuàng)新激勵(lì)機(jī)制。
建立藥監(jiān)和醫(yī)保管理部門(mén)的實(shí)時(shí)聯(lián)動(dòng)機(jī)制刻剥,藥品監(jiān)管部門(mén)依照CEUA 程序批準(zhǔn)產(chǎn)品上市及擴(kuò)大適應(yīng)癥的已上市藥品遮咖,醫(yī)保管理部門(mén)自動(dòng)將其納入醫(yī)保臨時(shí)報(bào)銷(xiāo)目錄。建立由國(guó)家相關(guān)部門(mén)統(tǒng)一調(diào)配的CEUA 產(chǎn)品使用流通機(jī)制造虏,以保障CEUA產(chǎn)品使用配送系統(tǒng)有效運(yùn)行御吞。

 協(xié)會(huì)活動(dòng)
協(xié)會(huì)活動(dòng)
 中國(guó)食品藥品監(jiān)管雜志
中國(guó)食品藥品監(jiān)管雜志  2024-08-18
2024-08-18
 196
196

 協(xié)會(huì)活動(dòng)
協(xié)會(huì)活動(dòng)
 中國(guó)醫(yī)藥創(chuàng)新促進(jìn)會(huì)
中國(guó)醫(yī)藥創(chuàng)新促進(jìn)會(huì)  2024-07-29
2024-07-29
 1547
1547

 協(xié)會(huì)活動(dòng)
協(xié)會(huì)活動(dòng)
 中國(guó)醫(yī)藥創(chuàng)新促進(jìn)會(huì)
中國(guó)醫(yī)藥創(chuàng)新促進(jìn)會(huì)  2024-07-09
2024-07-09
 1521
1521
 熱門(mén)資訊
熱門(mén)資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽