
 協(xié)會活動
協(xié)會活動
 2020-02-25
2020-02-25
 5658
5658
2019年底眯搭,新型冠狀病毒感染肺炎肆虐全國,疫情發(fā)生后中央高度重視努禽,習近平總書記在中央全面深化改革委員會第十二次會議上明確指出冠胯,“要從體制機制上創(chuàng)新和完善重大疫情防控舉措喂交,健全國家公共衛(wèi)生應(yīng)急管理體系甜熔,提高應(yīng)對突發(fā)重大公共衛(wèi)生事件的能力水平”驻奇。
中國醫(yī)藥創(chuàng)新促進會(以下簡稱“我會”)作為致力于推動醫(yī)療衛(wèi)生體制機制創(chuàng)新發(fā)展编撵,保障人民群眾健康的專業(yè)性團體纪闽,積極響應(yīng)國家號召邻冷,按照習總書記指示精神,緊急組織力量認真研究美國日本等發(fā)達國家應(yīng)對突發(fā)重大公共衛(wèi)生事件藥品緊急授權(quán)使用制度(EUA)委勤,在充分借鑒國際成熟經(jīng)驗的基礎(chǔ)上并結(jié)合我國國情妆跌,形成了《關(guān)于建立我國突發(fā)衛(wèi)生公共事件藥品緊急授權(quán)使用制度的建議》(以下簡稱“建議”)并報送中共中央全面深化改革委員會辦公室和國務(wù)院醫(yī)藥衛(wèi)生與科技等有關(guān)行政管理部門。
建議主要包括三大大內(nèi)容:
一宴甩、建議修改相關(guān)法律并制定行政法規(guī)证账,為建立藥品緊急授權(quán)提供法律依據(jù)
建議通過立法或修法授權(quán)為建立我國藥品緊急授權(quán)使用制度及相關(guān)管理體系奠定法律基礎(chǔ)。由國家藥品管理行政部門制定藥品緊急授權(quán)使用制度及實施方案沾尔,報請國務(wù)院批準并頒布相關(guān)行政法規(guī)作為《突發(fā)事件應(yīng)對法》和《藥品管理法》的配套法規(guī)除踱,以規(guī)范應(yīng)急藥品的特別審批與使用管理,明確發(fā)生重大突發(fā)公共衛(wèi)生事件或嚴重威脅生命健康疾病時吩抓,授權(quán)國家藥品監(jiān)管部門緊急臨時批準特定醫(yī)療產(chǎn)品(化學藥品涉茧、中成藥、生物制品和診斷醫(yī)療器械)疹娶,用于突發(fā)事件及重大傳染性疾病的預(yù)防伴栓、診斷和治療。
二雨饺、建立藥品緊急授權(quán)使用制度特別審批程序
建議基于“快速審批钳垮、快速使用、快速調(diào)整”原則额港,建立我國藥品緊急授權(quán)使用(CEUA)制度饺窿。建議內(nèi)容包括CEUA的啟動,適用品種范圍锹安、申報要求與審評審批要點,CEUA 藥品使用風險控制和監(jiān)管倚舀,建立CEUA 與正常上市許可轉(zhuǎn)化與激勵機制叹哭,建立CEUA 授權(quán)責任豁免機制以及CEUA 授權(quán)終止后的監(jiān)管等六大部分內(nèi)容。
(一)藥品緊急授權(quán)使用(CEUA)啟動
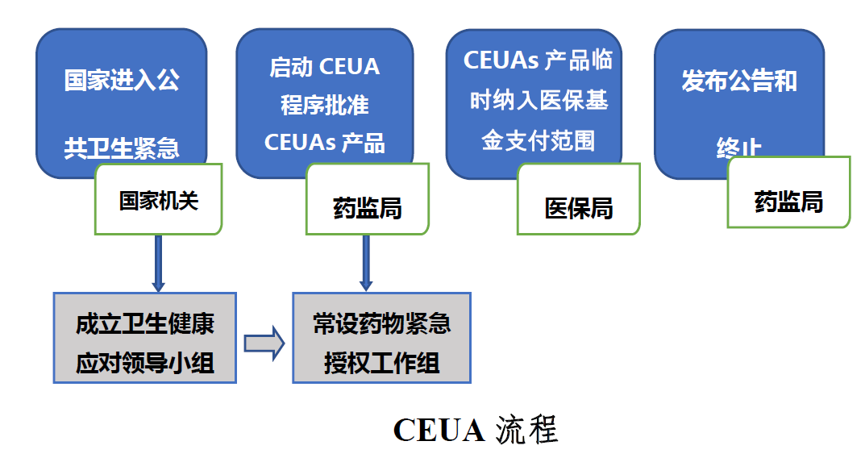
當國務(wù)院或國務(wù)院授權(quán)有關(guān)部門宣布進入突發(fā)公共衛(wèi)生事件防控緊急狀態(tài)時,國家藥品監(jiān)督管理局(NMPA)即啟動藥品緊急授權(quán)使用制度恒欣。
組建由藥品與衛(wèi)生行政管理部門與相關(guān)機構(gòu)組成的CEUA專業(yè)領(lǐng)導工作組移良,負責確定發(fā)布適用CEUA醫(yī)藥產(chǎn)品的范圍,研究制定CEUA適用產(chǎn)品風險效益評價策略髓界,以及研究制定加快應(yīng)對突發(fā)公共衛(wèi)生事件的潛在醫(yī)藥產(chǎn)品審評審批政策與相關(guān)EUCA產(chǎn)品使用監(jiān)管評估策略辰稽。
按照申報或潛在CEUA 產(chǎn)品分類,成立CEUA 專項審評工作組咪犹,以加快CEUA產(chǎn)品審批爷瓜。
?
(二)CEUA申報要求與審評審批
建議對CEUA適用產(chǎn)品范圍、申報主體以及適用未滿足臨床需求的情形等進行了研究遭屑,并提出除了沒有有效治療產(chǎn)品外享偎,未滿足臨床需求還應(yīng)包括已批準上市藥品生產(chǎn)能力不足、已批準上市藥品有特殊禁忌人群和產(chǎn)品劑型不適宜特殊人群服用以及不適宜急救治療等贴袖。
建議還針對新申請藥物漏匹、增加新適應(yīng)癥以及授權(quán)仿制與依法開展強制許可仿制等不同產(chǎn)品類別的申報要求,提交研究數(shù)據(jù)质窒、報告證據(jù)級別硫朦,審評原則與評價方法等進行研究并提出原則性建議:
提交IND或NDA申請的在研藥物可以申報CEUA;國外已上市產(chǎn)品或者未上市藥物可以使用國際多中心臨床試驗數(shù)據(jù)或者符合法定要求的境外臨床試驗數(shù)據(jù)提交申請背镇;列入國家或者省級應(yīng)急準備科研計劃項目或國家應(yīng)急準備緊急科技項目的藥物可以直接提交申請咬展。
未上市藥品除需要提交擬用適應(yīng)癥和用法,產(chǎn)品作用機理等基本資料外還應(yīng)提交質(zhì)量研究報告芽世、非臨床研究報告以及臨床研究報告挚赊;已批準上市藥品增加新適應(yīng)癥的,如新用途對患者群體引入新的風險济瓢,則要求提供體外試驗荠割、動物毒性試驗或者人體臨床使用經(jīng)驗和數(shù)據(jù),否則可以上市批準數(shù)據(jù)支持申報旺矾;授權(quán)或強制仿制藥品按照藥品注冊法規(guī)要求提交基本資料與生物等效性試驗或者體外研究資料蔑鹦。
產(chǎn)品審查期間,應(yīng)及時提交可能改變對產(chǎn)品安全性或有效性評價的所有試驗數(shù)據(jù)(例如長期穩(wěn)定性研究數(shù)據(jù)箕宙,在緊急狀態(tài)期間與CEUA同時進行的相關(guān)對照臨床試驗數(shù)據(jù))嚎朽。
CEUA專項審評員可與CEUA產(chǎn)品申報者或者潛在的CEUA藥品(特別是處于研發(fā)后期的藥物)持有人就申報要求或關(guān)鍵技術(shù)問題進行溝通和交流,以提升申報資料的完整性并加快審批柬帕。
CEUA專項審評工作組對提交數(shù)據(jù)的數(shù)量與質(zhì)量進行評估哟忍,對符合要求的證據(jù)進行全面風險效益評價,符合要求的NMPA可以批準緊急使用秃囚。CEUA產(chǎn)品有效期應(yīng)不長于緊急狀態(tài)的期限融确。緊急狀態(tài)終止,CEUA授權(quán)效力即終止,所有CEUA產(chǎn)品將不再用于除依法開展的臨床試驗以外的治療醒横。
為提高緊急狀況下CEUA產(chǎn)品信息傳遞效率蝗悼,NMPA或相關(guān)部門可在官網(wǎng)發(fā)布CEUA產(chǎn)品所有相關(guān)信息供公眾閱讀,包括批準的CEUA產(chǎn)品名稱禁舌、授權(quán)通知出募、產(chǎn)品說明書(醫(yī)務(wù)人員版、患者版)权煎、產(chǎn)品制造商信息蒂扇,并及時更新產(chǎn)品信息。
建立不良反應(yīng)監(jiān)測與動態(tài)評價機制茴怀,保障CEUA產(chǎn)品的安全使用词宴。
三、建立應(yīng)急藥品監(jiān)管政府協(xié)同機制
由國家衛(wèi)健委組織藥監(jiān)局找筝、科技部蹈垢、發(fā)改委、工信部袖裕、醫(yī)保局曹抬、社會保障部等相關(guān)部門成立衛(wèi)生健康緊急應(yīng)對領(lǐng)導小組。為應(yīng)對未來重大突發(fā)公共衛(wèi)生事件發(fā)生急鳄,研究制定公共衛(wèi)生健康威脅防控應(yīng)對戰(zhàn)略與措施谤民;制定國家應(yīng)對突發(fā)公共衛(wèi)生健康威脅的治療藥物研發(fā)與流行病基礎(chǔ)研究規(guī)劃;以及鼓勵國產(chǎn)應(yīng)急藥物如抗病毒藥物研發(fā)應(yīng)用的創(chuàng)新激勵機制疾宏。
建立藥監(jiān)和醫(yī)保管理部門的實時聯(lián)動機制张足,藥品監(jiān)管部門依照CEUA 程序批準產(chǎn)品上市及擴大適應(yīng)癥的已上市藥品,醫(yī)保管理部門自動將其納入醫(yī)保臨時報銷目錄坎藐。建立由國家相關(guān)部門統(tǒng)一調(diào)配的CEUA 產(chǎn)品使用流通機制为牍,以保障CEUA產(chǎn)品使用配送系統(tǒng)有效運行。

 協(xié)會活動
協(xié)會活動
 中國醫(yī)藥創(chuàng)新促進會
中國醫(yī)藥創(chuàng)新促進會  2024-10-23
2024-10-23
 355
355

 協(xié)會活動
協(xié)會活動
 中國醫(yī)藥創(chuàng)新促進會
中國醫(yī)藥創(chuàng)新促進會  2024-10-28
2024-10-28
 222
222

 協(xié)會活動
協(xié)會活動
 中國醫(yī)藥創(chuàng)新促進會
中國醫(yī)藥創(chuàng)新促進會  2024-10-21
2024-10-21
 170
170