
 投資大會
投資大會
 中國醫(yī)藥創(chuàng)新與投資大會
中國醫(yī)藥創(chuàng)新與投資大會  2017-11-02
2017-11-02
 1782
1782
在各界的翹首期待中缆乐,第二屆中國醫(yī)藥創(chuàng)新投資大會(以下簡稱“大會”)于10月29日在蘇州盛大開幕,9個重磅新藥的最新臨床研究數(shù)據(jù)在會上做了全球首次發(fā)布崭孤。這是繼去年大會首創(chuàng)由國內(nèi)非臨床研究機構(gòu)組織、以投資機構(gòu)為主要受眾蔬充、在綜合性大會上進行新藥全球臨床數(shù)據(jù)首發(fā)嘗試,獲得了醫(yī)藥創(chuàng)新與投資界高度關(guān)注與一致好評之后窟她,第二次在大會上做新藥臨床研究數(shù)據(jù)首發(fā)全闷。
此次發(fā)布最新臨床研究數(shù)據(jù)的在研新藥數(shù)量超過首屆,有3個品種獲得國家重大專項支持潘鲫,有過半品種是在國內(nèi)與歐美同步開展注冊申報翁逞,多個品種獲國內(nèi)外藥品監(jiān)管機構(gòu)加速審評或?qū)徟怀浞诛@示出在國家扶持創(chuàng)新政策力度不斷加大的向好環(huán)境下次舌,國內(nèi)創(chuàng)新藥研發(fā)水平快速提升熄攘,同時也體現(xiàn)出國內(nèi)創(chuàng)新機構(gòu)對大會臨床數(shù)據(jù)首發(fā)平臺的高度重視與肯定;為國內(nèi)外金融與投資機構(gòu)及時深入了解國內(nèi)創(chuàng)新研發(fā)動向彼念,促進投資與創(chuàng)新研發(fā)機構(gòu)的深度交流與合作挪圾,搭建了藥物創(chuàng)新最新成果面向投資高層快速展示的具有重大意義的通道,成為第二屆大會最受矚目的專場之一逐沙。

臨床數(shù)據(jù)全球首發(fā)專場主持人:華領(lǐng)醫(yī)藥共同創(chuàng)始人哲思、總經(jīng)理陳力(左);基石藥業(yè)首席執(zhí)行官江寧軍(右)
 ?
?
9個臨床數(shù)據(jù)首發(fā)項目匯報人做數(shù)據(jù)發(fā)布報告(按出場順序排列)
第一行:浙江導(dǎo)明醫(yī)藥科技有限公司創(chuàng)始人&總經(jīng)理何偉(左)蔓酣,四川九章生物科技有限公司臨床試驗PI柴羞、北京世紀(jì)壇醫(yī)院腦膠質(zhì)瘤科主任李文斌(中),上海賀普藥業(yè)股份有限公司CEO劉宏利
第二行:北涸氐椋康成(北京)醫(yī)藥科技有限公司創(chuàng)建人稳嘁、董事長及首席執(zhí)行官薛群(左),正大天晴藥業(yè)集團股份有限公司臨床試驗PI齐犀、河南省腫瘤醫(yī)院呼吸內(nèi)科副主任醫(yī)師王慧娟(中)托习,北京奧源和力生物技術(shù)有限公司PI、北京大學(xué)腫瘤醫(yī)院副主任醫(yī)師崔傳亮(右)
第三行:Teclison公司醫(yī)學(xué)執(zhí)行官施海坤(左)滥捣,深圳昂瑞生物醫(yī)藥科技有限公司聯(lián)合創(chuàng)始人虏淋、首席執(zhí)行官史躍年(中),山東亨利醫(yī)藥科技有限責(zé)任公司總裁賴文(右)
?
一沦昆、I期臨床數(shù)據(jù)全球首發(fā)
1尸查、DTRMWXHS-12(化藥1類),匯報人:浙江導(dǎo)明醫(yī)藥科技有限公司創(chuàng)始人&總經(jīng)理何偉
由強生和Pharmacyclics合作開發(fā)的伊布替尼Ibrutinib愿凶,是2013年FDA批準(zhǔn)的全球第一個上市的Bruton酪氨酸激酶抑制劑(BTK)竖伯,作為治療B細(xì)胞淋巴瘤和慢淋白血病(CLL)的突破性療法条辟,其上市之后銷售額突飛猛進黔夭。CFDA在2017年9月批準(zhǔn)其在中國上市用于治療慢淋白血病。然而羽嫡,伊布替尼藥物動力學(xué)(PK)暴露在患者之間的差異很大本姥。
DTRMWXHS-12是導(dǎo)明醫(yī)藥研發(fā)的新型BTK抑制劑肩袍,相比伊布替尼具有更好的PK,可以為具有有效劑量依賴性副作用特征的患者提供一致療效婚惫。導(dǎo)明醫(yī)藥已開展的小分子組合合成致死性臨床前研究發(fā)現(xiàn)氛赐,細(xì)胞多個關(guān)鍵信號通路中BTK和mTOR的抑制與免疫調(diào)節(jié)(IMID)組合可以改善選擇性細(xì)胞殺傷并避免獲得性耐藥。
DTRMWXHS-12在中國開展了針對標(biāo)準(zhǔn)療法治療無效的難治/復(fù)發(fā)性B細(xì)胞淋巴瘤的Ia期臨床試驗(NCT02891590)先舷,以50艰管、100、200和400毫克4個劑量組蒋川,進行了劑量遞增試驗牲芋,共入組13例,完成試驗10例倡挚;結(jié)果顯示DTRMWXHS-12所有劑量組患者血藥濃度均高于伊布替尼情庐,患者間差異也明顯小于伊布替尼,沒有觀測到最大耐受劑量(MTD)蒸拦,也沒有發(fā)生劑量限制性毒性(DLT)辙资,顯示DTRMWXHS-12單藥治療具有良好的耐受性。根據(jù)臨床前開展的合成致死研究和中美I期臨床研究數(shù)據(jù)蜘把,下一步將針對DTRMWXHS-12單藥和低劑量組合藥物癌雷,開展治療B細(xì)胞淋巴瘤和慢淋白血病等惡性腫瘤的進一步臨床研究。
2衅滞、注射用綠原酸(化藥1類)魄仙,匯報人:四川九章生物科技有限公司臨床試驗PI、北京世紀(jì)壇醫(yī)院腦膠質(zhì)瘤科主任李文斌??
四川九章在全球首次將綠原酸單體應(yīng)用于腫瘤治療抓惫。綠原酸治療晚期惡性腦膠質(zhì)瘤的I期臨床試驗配评,獲“十三五”重大新藥創(chuàng)制科技重大專項支持。
綠原酸注射劑I期臨床試驗共入組26例術(shù)后復(fù)發(fā)氛赞、經(jīng)常規(guī)放化療治療失敗的晚期惡性腦膠質(zhì)瘤(WHO III和IV類)患者,大部分是IV類患者塘丝;從2mg—7mg進行了劑量爬坡赔癌,在3mg/kg和4mg/kg兩個劑量組開展了藥代動力學(xué)研究。有23例患者完成了試驗澜沟,平均用藥時間為24天灾票,其中完全緩解1例,疾病穩(wěn)定11例茫虽,疾病進展11例刊苍。臨床研究數(shù)據(jù)統(tǒng)計分析結(jié)果顯示,1個月的疾病控制率(DCR)為52.17%濒析,3個月的疾病控制率(DCR)為31.25%正什,不良反應(yīng)輕微啥纸,主要有注射部位肌肉硬結(jié)。
鑒于目前全球針對復(fù)發(fā)性腦膠質(zhì)瘤尚沒有很好的可延長總生存期的治療方法婴氮,綠原酸I期臨床試驗在療效方面的初步探索取得了非乘拱簦可喜的成果,同時臨床試驗結(jié)果顯示綠原酸能夠解除患者的耐藥性主经。
3荣暮、賀普拉肽(化藥1類),匯報人:上海賀普藥業(yè)股份有限公司CEO劉宏利
中國是乙肝大國仇钞,目前一線治療藥物不能打破乙肝(HBV)病毒再感染循環(huán)嗡窑。賀普拉肽為全球首個針對鈉-膽酸共轉(zhuǎn)運蛋白(NTCP)靶點的全新藥物,通過與HBV受體表面NTCP特異性結(jié)合毯甘,阻斷HBV對肝細(xì)胞的感染夭蹦。賀普拉肽體內(nèi)阻斷HBV感染評價顯示,高撇熬、中劑量組治療9天后HBV DNA(拷貝/ml)水平均降至檢測限以下庐丁,高、中烧已、低劑量組治療21天血清ALT(IU/ml)水平均降至檢測限以下榨凭。藥代研究顯示賀普拉肽具有顯著的肝靶向性。
注射用賀普拉肽隨機烘牌、雙盲郑迅、空白對照劑量遞增I期臨床試驗,針對單純抗HBV Pre-S1抗體陽性患者撮点,按4:1雙盲令聂、隨機進入試驗和對照組。Ia入組患者45例固棚,Ib入組患者35例统翩。臨床試驗結(jié)果顯示,藥物安全性優(yōu)異此洲,獲得了臨床推薦劑量并驗證了膽汁酸升高(TBA)呈劑量依賴關(guān)系厂汗。
賀普拉肽II/III期臨床研究已獲國家“重大新藥創(chuàng)制”科技重大專項項目支持。
4呜师、CAN008注射液(治療用生物制品1類)娶桦,匯報人:北海康成(北京)醫(yī)藥科技有限公司創(chuàng)建人汁汗、董事長及首席執(zhí)行官薛群
CAN008是以CD95配體為靶點的創(chuàng)新生物靶向藥衷畦,具有恢復(fù)免疫功能同時有效抑制膠質(zhì)母細(xì)胞瘤浸潤性生長的雙重功能。
CAN008在歐洲已完成用于復(fù)發(fā)膠質(zhì)母細(xì)胞瘤的多中心、隨機祈争、對照和開放性II期臨床試驗斤程,顯示其可顯著提高中位總生存期2.5倍(16.1個月vs 6.5個月,p=0.003)铛嘱,并具有良好的安全性和耐受性暖释。CAN008已獲得EMA授予的“PRIME”優(yōu)先治療藥物資格(基本等同于美國FDA的“突破性療法”認(rèn)定)。
此外波烘,對腫瘤石蠟切片探索性免疫組化技術(shù)(IHC)分析證明CD95L高表達(dá)的患者亞組對CAN008治療的應(yīng)答最佳在摔。CpG2是CD95L啟動子區(qū)的甲基化位點之一,通過對DNA甲基化全基因組評估及MassArray分析亥矿,CpG2低甲基化水平患者使用CAN008的治療效果好于高甲基化水平的患者唤吐。基于以上的臨床試驗及生物標(biāo)記物的研究锨飞,北航胗祝康成首先啟動在中國GBM患者腫瘤組織中驗證CD95L表達(dá)水平的研究。使用免疫組化染色法對70例中國GBM患者的腫瘤切片進行染色和分析徘敦,結(jié)果顯示中國GBM患者CD95L表達(dá)陽性率(1+翅殃,2+,3+)大于65%虾钾,顯示了中國GBM患者CD95L的表達(dá)水平與歐洲臨床研究數(shù)據(jù)(61%-67%)高度的一致臊娩。
北海康成已經(jīng)在臺灣地區(qū)開展了CAN008注射液與替莫唑胺(TMZ)聯(lián)用透嫩、在放射治療期間以及放療結(jié)束后新診斷膠質(zhì)母細(xì)胞瘤患者的I期臨床試驗框全,主要評估CAN008的安全性、耐受性干签、藥物代謝動力學(xué)和初步療效津辩,已完成患者入組10例,CAN008 200mg和400mg劑量組均未觀察到DLT(劑量限制毒性)容劳,未檢測到ADA喘沿;未觀測到嚴(yán)重不良事件。推薦CAN008 II期給藥劑量為400mg每周一次竭贩。
基于以上的生物標(biāo)記物研究和I期臨床的安全性數(shù)據(jù)摹恨,北海康成將開發(fā)CpG2 qPCR和CD95L IHC生物標(biāo)記物檢測試劑盒娶视。
北海康成與國家藥審中心(CDE)在召開CAN008臨床試驗申請前會議時達(dá)成一致睁宰,CDE同意使用生物標(biāo)記物CpG2篩選患者肪获,同意使用可適性試驗方法實現(xiàn)CAN008臨床II、III期無縫鏈接以及有條件批準(zhǔn)上市柒傻。
5孝赫、重組人GM-CSF單純皰疹病毒注射液(治療用生物制品3類)央颈,匯報人:北京奧源和力生物技術(shù)有限公司PI、北京大學(xué)腫瘤醫(yī)院副主任醫(yī)師崔傳亮
在亞洲岗制,肢端黑色素瘤是最常見的亞型械耙,與其他地區(qū)亞型肢端黑色素瘤相比,它顯示出較差的無進展生存期(3.9-4.1月)狀況和較長時間的診斷延遲(27個月)刷男,比高加索地區(qū)無進展生存期少2個月袖蝙,診斷延遲晚15個月,因此有必要針對亞洲患者研究特定的降低診斷延遲和提高中國黑素瘤患者治療臨床效益的治療策略剪碱。
OrienX010的設(shè)計思路與作用機理與美國安進公司已被FDA批準(zhǔn)的溶瘤病毒T-VEC類似羊耸,同時針對亞洲患者做了進一步優(yōu)化。OrienX010針對全身性藥物治療失敗穆递、可注射葵伟、不可切除的IIIB至IV (M1a)期黑色素瘤患者開展了開放性Ib期臨床試驗,主要評價OrienX010的安全性词惭、耐受性夕谬,次要終點是觀察患者初步治療效果包括無進展生存期(PFS)、客觀緩解率(ORR)
以及確定II/III期臨床試驗的劑量和給藥方式扣墩。OrienX010的Ib-08試驗入組12例患者哲银,瘤內(nèi)注射不大于5 mL Q2W,試驗結(jié)果顯示OrienX010耐受性良好沮榜,未觀察到與治療相關(guān)的嚴(yán)重不良事件盘榨;治療起效時間:6-12周,療效維持時間: 24-54周蟆融。OrienX010的Ib-09試驗入組14例患者草巡,瘤內(nèi)注射不大于10 mL Q2W,同樣顯示了OrienX010的良好耐受性型酥,未觀察到與治療相關(guān)的致死性不良事件山憨;治療起效時間:4-6周,療效維持時間: 24-54周弥喉。Ib-08 12周的中位無進展生存期的95%可信區(qū)間(CI)為9.32-14.68郁竟,Ib-09 24周95%可信區(qū)間(CI)為10.50-29.53。
重組人GM-CSF單純皰疹病毒注射液(OrienX010)獲得國家“重大新藥創(chuàng)制”科技重大專項支持由境。目前OrienX010已進入關(guān)鍵性II期臨床試驗棚亩,并進入國家優(yōu)先審評藥品目錄,最快有望于2019年批準(zhǔn)上市虏杰。
6腹瞒、罕見病藥LT001(1類化藥),匯報人:Teclison公司醫(yī)學(xué)執(zhí)行官施海坤
1類化藥LT001是一種生物還原劑,在正常的氧氣環(huán)境中屬于原藥狀態(tài)孝尺,一旦被還原酶激活為自由基陵租,將成為比原藥更有效20- 150倍的藥物,從而導(dǎo)致細(xì)胞死亡洼宪。Teclison提出將LT001與肝動脈栓塞術(shù)聯(lián)合治療中期肝癌的方案育床。這種組合的原理是基于LT001可在低氧環(huán)境中被激活,而肝動脈栓塞術(shù)在腫瘤中創(chuàng)造了一個持續(xù)的低氧環(huán)境绒霹,使LT001激活從而可以完全殺死肝癌細(xì)胞松浆。目前有90%的肝癌患者采用肝動脈栓塞合并化療治療作為中期肝癌的標(biāo)準(zhǔn)治療方法,但只能夠持續(xù)約8-10個月左右西龟,索拉非尼及瑞戈非尼平均只能夠延長約2-3個月左右的壽命馒脏。
HBx轉(zhuǎn)基因小鼠模型顯示,與單純實施肝動脈栓塞術(shù)(TAE)無腫瘤壞死相比镣学,LT001與肝動脈栓塞術(shù)(TAE)聯(lián)合治療50 min誘導(dǎo)90 %-99%肝癌腫瘤壞死歌淹;如果用標(biāo)準(zhǔn)化療劑doxorubicin代替LT001,則壞死小于10%黎炉。LT001腫瘤細(xì)胞殺傷作用是沒有選擇性的枝秤。
????LT001是全球首創(chuàng)(first in class)藥物,2015年被FDA認(rèn)定為孤兒藥慷嗜。Teclison有限公司已在臺灣和美國進行了LT001聯(lián)合TAE的I期臨床研究淀弹。美國I期臨床研究方法為股動脈插管進入肝動脈(肝臟腫瘤滋養(yǎng)動脈),經(jīng)靜脈或肝動脈注射LT001庆械,再行肝動脈碘油及明膠海綿的栓塞術(shù)薇溃;治療后6周,磁共振(MRI) 檢測腫瘤應(yīng)答缭乘。試驗入組17例患者沐序,分為外周靜脈注射2個劑量組和肝動脈注射3個劑量組。臨床研究顯示對中期肝癌的完全緩解率超過71%堕绩,全部肝動脈注射替拉扎明病人完全緩解率達(dá)81%策幼,最佳推薦劑量組病人完全緩解率達(dá)100%,持續(xù)緩解時間超過7個月奴紧;目前肝動脈拴塞合并化療中期原發(fā)性肝細(xì)胞癌標(biāo)準(zhǔn)治療方法的腫瘤完全緩解率CR一般為10-30%特姐。
在2017年5月與FDA的第一期會議上,F(xiàn)DA同意將一個成功的隨機II期臨床研究結(jié)果作為LT001加速審批的申報資料冬蝶。
二裁鸦、IIb臨床數(shù)據(jù)全球首發(fā)
7、Oregovomab(治療性抗體疫苗)瘟气,匯報人:深圳昂瑞生物醫(yī)藥科技有限公司聯(lián)合創(chuàng)始人杉藐、首席執(zhí)行官史躍年
Oregovomab是高親和力的單克隆鼠源抗體(Xenotypic IgG1),它能夠與腫瘤相關(guān)抗原CA125(也被稱之為MUC 16)相結(jié)合枯橱,啟動針對這個糖蛋白的系列免疫反應(yīng)。通過抗體和抗原結(jié)合攒置,形成新的抗原-抗體復(fù)合物與化療精準(zhǔn)聯(lián)合用藥。
Oregovomab單抗作為原發(fā)卵巢癌的一線用藥在美國開展了IIb期臨床試驗披蚕,入組了95例新診斷晚期卵巢癌血液CA125 (MUC16) levels > 50 U/mL的患者尖坦,治療組為Oregovomab 2mg/患者+一線化療,對照組僅采用一線化療讹渴。研究結(jié)果顯示装屈,Oregovomab與一線化療聯(lián)合用藥治療卵巢癌,治療組(46例)比對照組(49例)疾病復(fù)發(fā)或死亡率提高了約80%擒欢;無進展生存期達(dá)到中位數(shù)26個月的受試者路学,治療組占比為63.8%,對照組為34.7%盒件。安全性分析顯示兩組之間的不良事件蹬碧、相關(guān)不良事件及嚴(yán)重不良事件的發(fā)生率沒有明顯差異。
8炒刁、KBP-5074恩沽,匯報人:山東亨利醫(yī)藥科技有限責(zé)任公司總裁賴文
在中國慢性腎病患者約有1.2億,其中約1800萬患者同時患有未被控制的高血壓∠枋迹現(xiàn)有非甾體鹽皮質(zhì)激素受體拮抗劑(MRA)罗心,有獨立治療慢性心臟衰竭和糖尿病性腎病具有良好的療效和安全性,但因在治療劑量下易引發(fā)高血鉀城瞎,在中晚期慢性腎病患者中禁用渤闷。
KBP-5074是非甾體鹽皮質(zhì)激素受體拮抗劑(MRAs),在美國臨床I期試驗入組了45例患者(CKD)脖镀,研究結(jié)果證明其有良好的耐受性以及安全性飒箭,對患者血鉀水平影響很小。臨床IIa期研究針對高血鉀高發(fā)人群——輕到中度伴發(fā)蛋白尿CKD患者认然,主要試驗?zāi)康氖窃u價安全性(包括對血鉀的影響)及UACR(尿蛋白/肌酐比)补憾,分為2.5 mg QD / 56 days和0.5 mg QD / 56 days兩個治療劑量組,共入組14位患者反俱,10個為中度忱厨。治療8周后,所有患者的UACR下降了50%-60%炸一,0.5mg QD組未出現(xiàn)高血鉀鲤瞪,2.5 mg QD組出現(xiàn)高血鉀(2/7);0.5mg QD組患者未在透析液中檢測到KBP-5074校槐,表明KBP-5074(0.5mg QD)可以用于透析患者的治療揉拯。
三泳厌、III臨床數(shù)據(jù)首發(fā)
9、鹽酸安羅替尼膠囊(1類化藥)液斩,匯報人:正大天晴藥業(yè)集團股份有限公司臨床試驗PI起驱、河南省腫瘤醫(yī)院呼吸內(nèi)科副主任醫(yī)師王慧娟
目前非小細(xì)胞肺癌(NSCLC)的一線與二線治療以化療與靶向治療為主,治療標(biāo)準(zhǔn)越來越規(guī)范化谤赛,使得越來越多的患者能夠進行三線及以上治療鹊获,但肺癌三線治療研究較少,循證醫(yī)學(xué)證據(jù)不足追城。
鹽酸安羅替尼(商品名:干材耄可維)是口服的新型小分子多靶點酪氨酸激酶抑制劑,能夠有效抑制VEGFR座柱、PDGFR迷帜、FGFR、c-Kit等信號通路的酪氨酸激酶色洞,具有抗腫瘤血管生成和抑制腫瘤生長的作用戏锹,由正大天晴藥業(yè)集團自主研發(fā)。
安羅替尼三線治療NSCLC III期隨機锋玲、雙盲景用,安慰劑對照試驗在35個中心進行,納入確診為晚期(IIIB/IV期)非小細(xì)胞肺癌惭蹂、EGFR或ALK陽性伞插、至少接受過兩種系統(tǒng)性化療方案治療的三線及以上或無法耐受治療患者439例;主要終點為總生存期(OS)盾碗,次要終點為無進展生存期(PFS)媚污、客觀緩解率(ORR)、疾病控制率(DCR)廷雅。臨床試驗結(jié)果顯示皿掂,相比安慰劑,安羅替尼延長OS達(dá)3.33個月(p<0.05)唆逻,延長PFS達(dá)3.97個月(p<0.05)般供;FAS評價見下表1-3。證實了鹽酸安羅替尼在NSCLC的三線治療中能夠同時帶來OS和PFS的雙重獲益唇墅;通過擴大的樣本量進一步驗證了鹽酸安羅替尼的安全性栅告,不良反應(yīng)和預(yù)期一致。
表1治療后腫瘤最佳療效評價(FAS)

表2第二周期末療效評價(FAS)

表3治療后病灶出現(xiàn)空洞的情況
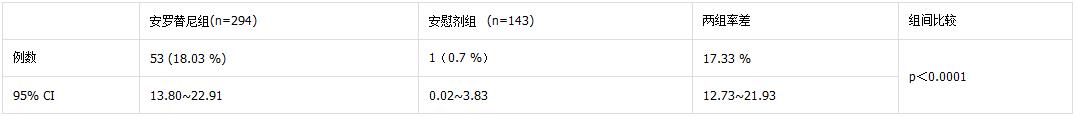
安羅替尼已向CFDA提交NSCLC三線單藥治療的上市申報特奇,有望于2017年底批準(zhǔn)上市域抚,成為第一個NSCLC三線治療的標(biāo)準(zhǔn)用藥。目前安羅替尼針對其他多種癌癥的臨床試驗正在開展當(dāng)中剧么,包括軟組織肉瘤涵蔓、胃癌沧蛉、結(jié)直腸癌、甲狀腺髓樣癌滋遗、分化型甲狀腺癌以及食管鱗癌等蟀思。

 投資大會
投資大會
 中國醫(yī)藥創(chuàng)新與投資大會
中國醫(yī)藥創(chuàng)新與投資大會  2024-08-15
2024-08-15
 1345
1345

 投資大會
投資大會
 中國醫(yī)藥創(chuàng)新與投資大會
中國醫(yī)藥創(chuàng)新與投資大會  2024-11-21
2024-11-21
 43
43

 投資大會
投資大會
 中國醫(yī)藥創(chuàng)新促進會
中國醫(yī)藥創(chuàng)新促進會  2024-11-19
2024-11-19
 76
76