
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2023-04-24
2023-04-24
 2140
2140
4月18日玛痊,Madrigal Pharmaceuticals宣布FDA授予resmetirom治療伴有肝纖維化的非酒精性脂肪性肝炎 (NASH) 患者的突破性療法認(rèn)定侈兄。

NASH是非酒精性脂肪性肝睬酪啊(NAFLD)的一種嚴(yán)重形式琅沟,其特征在于脂肪在肝臟中過度堆積,對肝細胞產(chǎn)生應(yīng)激和損傷狈报,引起炎癥和纖維化挣仅,進而發(fā)展為肝硬化、肝功能衰竭烹驰、癌癥甚至死亡姓拂。對整個醫(yī)藥行業(yè)來說,NASH一直是個難題魄蔗,其需求遠未得到滿足寒肋,目前尚無治愈或特異性的治療方法。據(jù)估計肆洽,到2026年易麻,NASH市場將達到183億美元。Resmetirom是一款甲狀腺激素受體(THR)-β口服選擇性激動劑社咒。THR-β在人體肝臟中高表達秽祷,能夠調(diào)節(jié)脂代謝,降低LDL-C莱衍、甘油三酯和致動脈粥樣硬化性脂蛋白冬魏。此外,THR-β還可以通過促進脂肪酸的分解和刺激線粒體的生物發(fā)生來減少脂肪毒性并改善肝功能乍狐,進而減少肝臟脂肪赠摇。因此,THR-β激動劑具備調(diào)控多種肝臟代謝通路來治療NASH的潛力浅蚪。目前藕帜,Madrigal針對resmetirom正在開展4項III期臨床試驗,分別為MAESTRO-NASH惜傲、MAESTRO-NAFLD-1洽故、MAESTRO-NAFLD-OLE以及 MAESTRO-NASH-OUTCOMES研究。
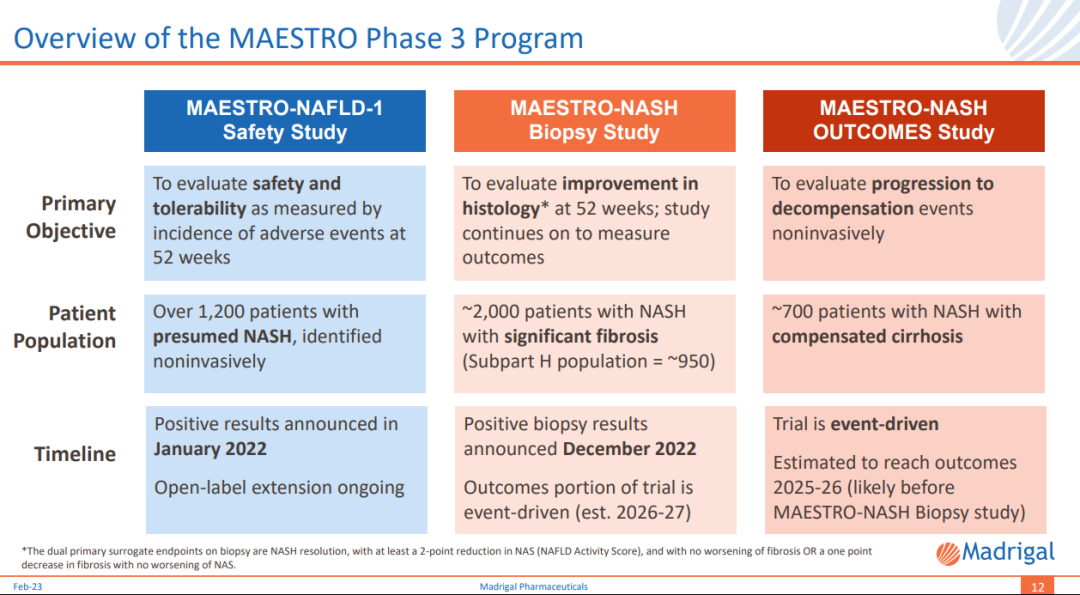
MAESTRO-NASH研究是一項多中心盗誊、隨機时甚、雙盲、安慰劑對照的III期臨床試驗哈踱,啟動于2019年3月荒适,旨在評估resmetirom用于肝活檢確診為NASH患者的療效與安全性梨熙。該研究H部分招募1000多例NASH患者,至少一半為F3(晚期纖維化)刀诬,其余為F2或F1B(中度纖維化)锯忱,少數(shù)為早期F1患者,這些患者按1:1:1分為三組健吃,分別接受Resmetirom 80mg闰妓、100mg或安慰劑治療。
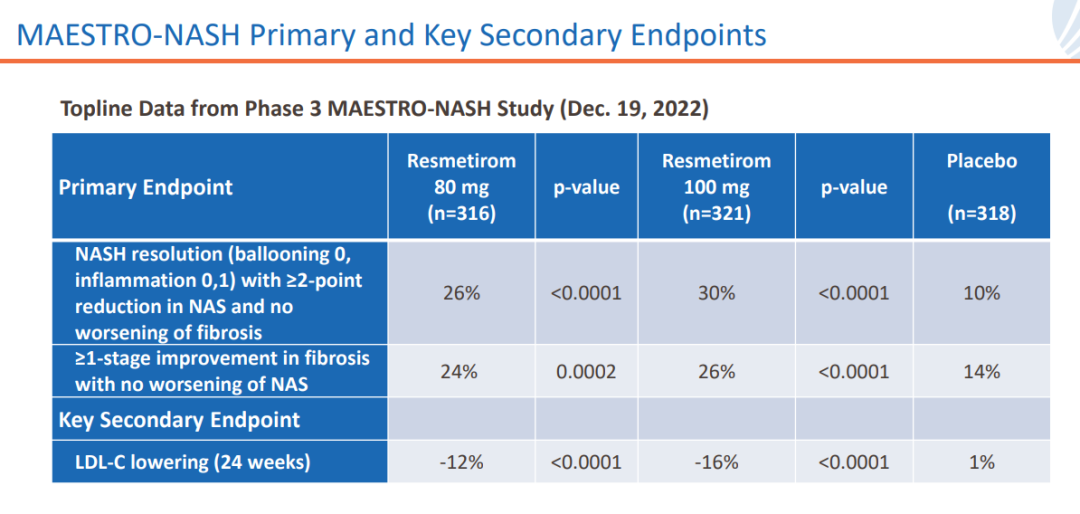
雙重主要替代終點是治療52周肝穿的組織學(xué)結(jié)果陕绢,患者NASH消退(NAS評分下降超過2分)且纖維化沒有惡化过腰,或NASH沒有惡化且纖維化改善≥1級,實現(xiàn)二者中任意一個均可視為達到主要終點闯揪;關(guān)鍵次要終點為治療24周時LDL-C降低水平庵动。
研究結(jié)果顯示,在NASH緩解且纖維化不惡化的主要終點上呜谓,高劑量組、低劑量組和安慰劑組的發(fā)生率分別為30%法洼、26%洼荡、10%;在纖維化改善≥1級且NASH不惡化的主要終點上眠琴,三個組的發(fā)生率為26%下质、24%、14%诞仓;在次要終點LDL-C降幅上缤苫,三個組分別為-16%、-12%墅拭、1%活玲。
參加MAESTRO-NASH研究的患者(約1750例)52周治療期后繼續(xù)接受長達54個月的治療,以檢測活檢進展為肝硬化(52周和54個月)谍婉、肝硬化失代償期以及全因死亡率舒憾。
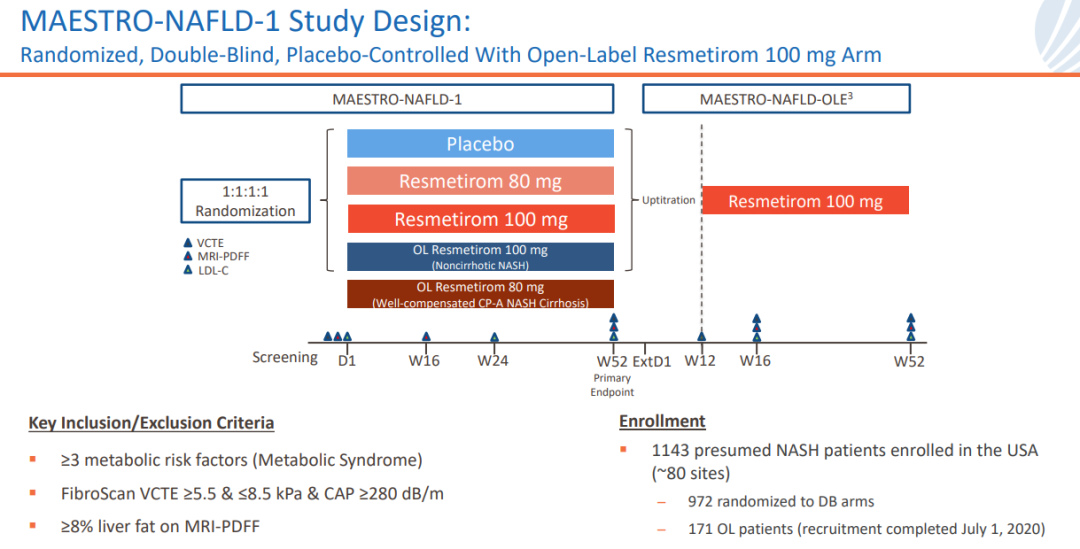
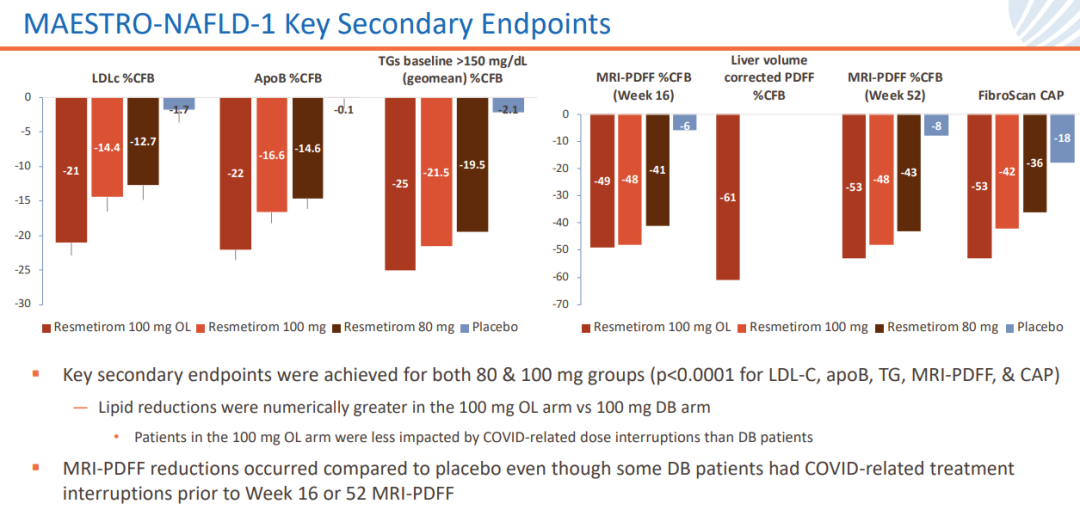
針對NAFLD患者的多中心、隨機穗熬、安慰劑對照的III期MAESTRO-NAFLD-1研究已于2019年12月啟動镀迂,患者按1:1:1:1分為四組,分別接受resmetirom 80mg或100mg唤蔗、安慰劑(雙盲)探遵、resmetirom 100mg(開放標(biāo)簽),為期52周妓柜。該研究主要終點為安全性箱季,關(guān)鍵次要終點包括LDL-C、載脂蛋白B(apoB)、甘油三酯(TG)乃描、肝臟脂肪含量(MRI-PDFF)等指標(biāo)的降低水平跨基。
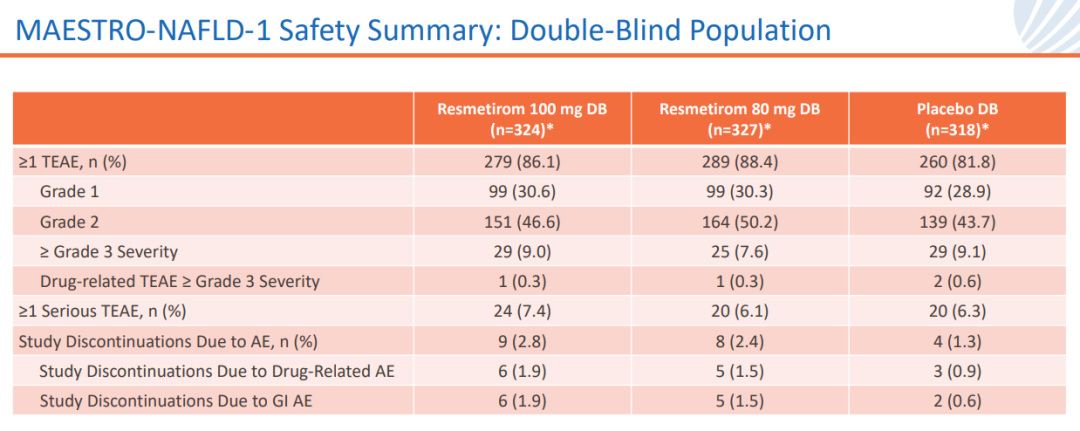
結(jié)果顯示,雙盲人群中resmetirom安全性良好斯凑。
80mg以及100mg劑量組均達到關(guān)鍵次要終點肾俯,LDL-C、apoB蛀颓、TG乡纸、MRI-PDFF以及CAP值均顯著降低(p<0.0001)。
Madrigal表示艘尊,基于為期52周的MAESTRO-NASH研究坪秒、MAESTRO-NAFLD-1研究等積極數(shù)據(jù),預(yù)計于2023年第二季度向FDA遞交上市申請罚考,以尋求加速批準(zhǔn)煞嫩。

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 256
256

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 235
235

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時間
醫(yī)藥時間  2024-11-18
2024-11-18
 57
57