
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2023-05-08
2023-05-08
 2040
2040
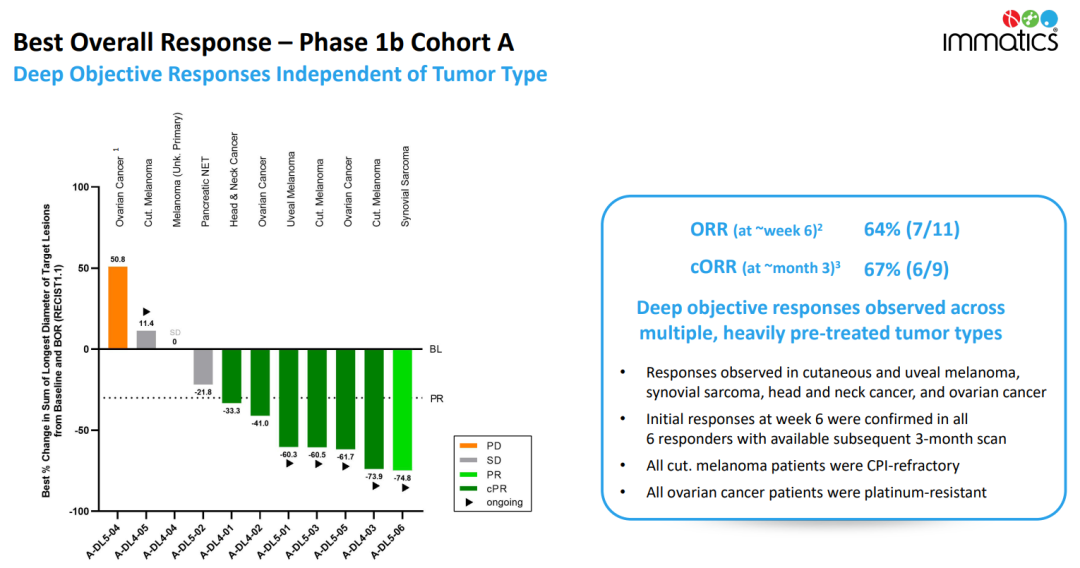
5月2日墓造,Immatics宣布了正在進行的Ib期劑量擴展隊列A中11例接受ACTengine?IMA203 TCR-T單藥治療復發(fā)和/或難治性實體癌患者的中期臨床數(shù)據(jù)更新净耍。根據(jù)RECIST 1.1評估庐橙,第6周觀察到的初始客觀緩解率(ORR)為64%(7/11)换募,均為部分緩解府蔗。第3個月確證的ORR為67%(6/9)京多。受此消息影響效迹,Immatics股價大漲30%。

IMA203 TCR-T細胞療法靶向來自PRAME的HLA-A*02呈遞肽苫担,PRAME是一種廣泛表達的實體瘤靶點脓甘。截至2023年4月4日,11例患者輸注了IMA203 TCR-T細胞旬城,治療后至少可進行一項腫瘤反應(yīng)評估钙径。這些患者接受了平均約4次的系統(tǒng)治療,并且已經(jīng)用盡了所有可用的標準治療方法卒赖。所有皮膚黑色素瘤受試者均為檢查點抑制劑難治性患者踊嘲,所有卵巢癌受試者均對鉑耐藥。
在包括皮膚黑色素瘤睡清、卵巢癌疏菩、葡萄膜黑色素瘤、頭頸癌刨仑、滑膜肉瘤在內(nèi)的接受末線治療的實體癌患者中觀察到客觀緩解郑诺。根據(jù)RECIST 1.1評估,第6周觀察到的初始客觀緩解率(ORR)為64%(7/11)杉武,均為部分緩解辙诞。第3個月確證的ORR為67%(6/9)。中位隨訪8.5個月時轻抱,未達到中位緩解持續(xù)時間(最短1.3+個月飞涂,最長8.8+個月)。在所有可評估的腫瘤組織中均發(fā)現(xiàn)IMA203 T細胞祈搜,腫瘤浸潤水平與客觀緩解情況相關(guān)较店。
所有11例患者均出現(xiàn)預期的細胞減少癥(1-4級),并伴有淋巴細胞耗損容燕。10例(91%)患者存在低至中度(1-2級)細胞因子釋放綜合征(CRS)梁呈,其中5例(45%)為1級婚度,5例(45%)為2級。在這11例患者中官卡,沒有觀察到3級或更高級別CRS和免疫效應(yīng)細胞相關(guān)神經(jīng)毒性綜合征(ICANS)蝗茁。在Ia期和Ib期隊列A(共38例輸注IMA203的患者)中未觀察到CRS的劑量依賴性增加。自最初的Ia期劑量遞增以來剥乍,在隊列A中未觀察到額外的劑量限制性毒性(DLT)指晾。

Immatics認為,今天公布的結(jié)果進一步驗證了PRAME作為基于TCR治療的最有希望的實體腫瘤靶點之一哀揽。該公司的首要目標是盡快在1-2種實體瘤末線治療中提供PRAME靶向TCR-T細胞療法,重點關(guān)注PRAME高表達且已證實臨床概念驗證的適應(yīng)癥酗裕,如皮膚黑色素瘤(可能與葡萄膜黑色素瘤合并)和/或卵巢癌睬肮。Immatics計劃在2024年上半年開始第一個II期注冊性試驗。

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 255
255

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 234
234

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時間
醫(yī)藥時間  2024-11-18
2024-11-18
 57
57