
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥觀瀾
醫(yī)藥觀瀾  2023-06-12
2023-06-12
 2404
2404
6月8日消息尚技,Vertex Pharmaceuticals和CRISPR Therapeutics宣布震叮,美國FDA接受exagamglogene autotemcel(exa-cel)治療嚴(yán)重鐮刀型細(xì)胞貧血蔡挚场(SCD)和輸血依賴性β地中海貧血(TDT)的生物制品許可申請(BLA)贩虾,同時(shí)授予該產(chǎn)品治療SCD的優(yōu)先審評資格牢簸。新聞稿表示凿宾,這也是FDA受理的首個(gè)CRISPR基因編輯療法上市申請坠非,針對SCD和TDT的PDUFA日期分別為2023年12月8日和2024年3月30日。
Vertex公司首席執(zhí)行官兼總裁Reshma Kewalramani醫(yī)學(xué)博士表示耻矮,非常高興FDA接受該申請并授予其治療鐮刀型細(xì)胞貧血病的優(yōu)先審評資格秦躯。Exa-cel有望成為首個(gè)獲批的CRISPR基因編輯療法忆谓,他們將繼續(xù)努力,為正在等待的患者帶來具有變革性潛力的治療方法宦赠。
Exa-cel是一款自體細(xì)胞療法陪毡,它利用CRISPR/Cas9基因編輯系統(tǒng)米母,在體外對來自患者的造血干細(xì)胞進(jìn)行編輯勾扭,使血紅細(xì)胞生產(chǎn)高水平的胎兒血紅蛋白(HbF)。HbF是攜帶氧氣的血紅蛋白的一種形式铁瞒,在出生時(shí)自然存在妙色,隨著嬰兒的長大,血液中的血紅蛋白轉(zhuǎn)換為成人形式的血紅蛋白慧耍。通過exa-cel治療身辨,可以提高HbF水平,有可能緩解輸血依賴性β地中海貧血患者的輸血需求了赖,并減少鐮刀型細(xì)胞貧血病患者的疼痛和使人衰弱的血管閉塞性危象滩扩。此前,exa-cel曾獲FDA授予治療鐮刀型細(xì)胞貧血病和輸血依賴性β地中海貧血的再生醫(yī)學(xué)先進(jìn)療法認(rèn)定笆滓、快速通道資格槽顶、孤兒藥資格和罕見兒科疾病認(rèn)定,并已在歐洲和英國遞交上市申請初肥。
2015年昭淋,Vertex公司和CRISPR Therapeutics達(dá)成戰(zhàn)略研究合作,專注于利用CRISPR/Cas9發(fā)現(xiàn)和開發(fā)針對人類疾病潛在遺傳原因的潛在新治療方法午螺。Exa-cel代表了聯(lián)合研究計(jì)劃中的首個(gè)潛在治療方法墓枝。根據(jù)修訂后的合作協(xié)議,Vertex公司正領(lǐng)導(dǎo)exa-cel的全球開發(fā)跷它、制造和商業(yè)化容且。
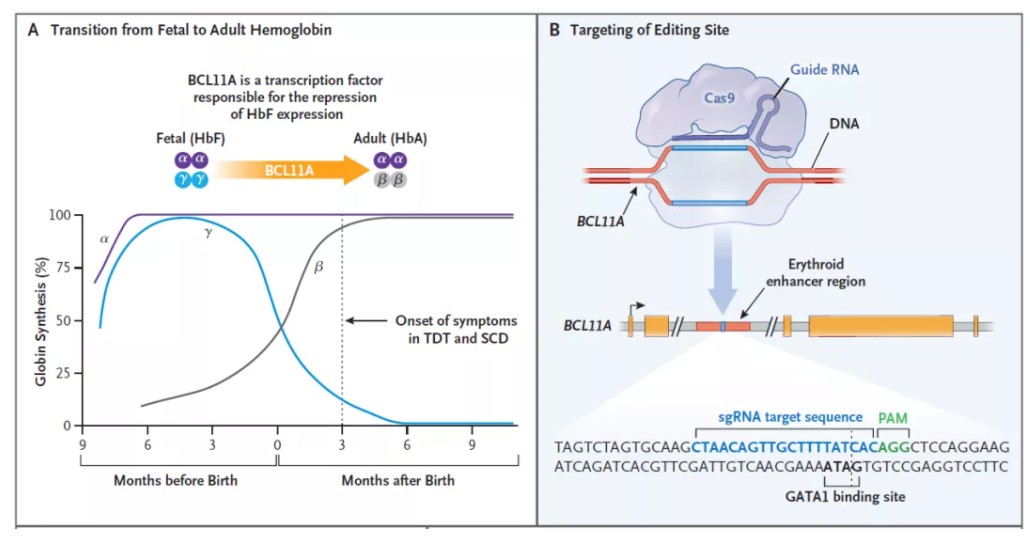
▲Exa-cel的作用機(jī)制:A,BCL11A是下調(diào)胎兒血紅蛋白表達(dá)的轉(zhuǎn)錄因子唾诺;B亮隙,exa-cel通過對BCL11A進(jìn)行基因編輯,上調(diào)胎兒血紅蛋白的表達(dá)(圖片來源:參考資料[3])
目前擎勘,exa-cel正在進(jìn)行多項(xiàng)臨床試驗(yàn)咱揍,包括1/2/3期開放標(biāo)簽試驗(yàn)CLIMB-111和CLIMB-121、長期隨訪試驗(yàn)CLIMB-131棚饵、3期開放標(biāo)簽試驗(yàn)CLIMB-141和CLIMB-151煤裙、3b期試驗(yàn)CLIMB-161等。研究人員會從入組試驗(yàn)的患者的外周血中采集造血干/祖細(xì)胞噪漾,然后利用CRISPR/Cas9技術(shù)對這些細(xì)胞進(jìn)行編輯硼砰,最后將這些細(xì)胞作為自體造血干細(xì)胞移植(HSCT)的一部分回輸?shù)交颊唧w內(nèi)且蓬。
此前公布的臨床試驗(yàn)結(jié)果顯示,exa-cel具有一次治療题翰,提供功能性“治愈”的潛力恶阴。在接受治療的44名輸血依賴性β地中海貧血患者中,42名在隨訪時(shí)間為1.2~37.2個(gè)月時(shí)豹障,不再需要接受輸血冯事,剩余兩名患者接受的輸血水平分別降低75%和89%。所有31名接受治療的嚴(yán)重鐮刀型細(xì)胞貧血病患者在隨訪時(shí)間為2.0~32.3個(gè)月時(shí)称侣,均未出現(xiàn)血管閉塞性危象嘹挨。
公開資料顯示,支持exa-cel本次監(jiān)管提交的關(guān)鍵性試驗(yàn)更新數(shù)據(jù)將于2023年6月11日在歐洲血液學(xué)協(xié)會年會上公布赁挚。
CRISPR Therapeutics首席執(zhí)行官Samarth Kulkarni博士表示逮弛,他們很高興看到鐮刀型細(xì)胞貧血病領(lǐng)域創(chuàng)新療法未被滿足的需求和緊迫性得到了FDA的優(yōu)先審評認(rèn)可。這對于CRISPR領(lǐng)域來說是一個(gè)激動(dòng)人心的里程碑照腐,他們期待繼續(xù)與合作伙伴Vertex公司進(jìn)行緊密合作鞋会,將這一產(chǎn)品帶給有需要的患者。
參考資料:
[1]FDA Accepts Biologics License Applications for exagamglogene autotemcel (exa-cel) for Severe Sickle Cell Disease and Transfusion-Dependent Beta Thalassemia . Retrieved Jun 8贿册,2023填杀,from https://crisprtx.com/about-us/press-releases-and-presentations/fda-accepts-biologics-license-applications-for-exagamglogene-autotemcel-exa-cel-for-severe-sickle-cell-disease-and-transfusion-dependent-beta-thalassemia
[2] Vertex and CRISPR Therapeutics Present New Data on More Patients With Longer Follow-Up Treated With exagamglogene autotemcel (exa-cel) at the 2022 European Hematology Association (EHA) Congress. Retrieved June 11, 2022, from https://www.businesswire.com/news/home/20220611005003/en
[3] Frangoul et al., (2020). CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia. NEJM, DOI: 10.1056/NEJMoa2031054.

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 244
244

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 223
223

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時(shí)間
醫(yī)藥時(shí)間  2024-11-18
2024-11-18
 56
56
 熱門資訊
熱門資訊