
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2023-06-26
2023-06-26
 2621
2621
6月22日田绑,Sarepta Therapeutics宣布其基因療法SRP-9001(delandistrogene moxeparvovec诅岩,Elevidys)獲FDA加速批準(zhǔn)上市纽绍,適用于4-5歲攜帶抗肌萎縮蛋白基因突變的非臥床兒科杜氏肌營(yíng)養(yǎng)不良癥(DMD)患者寥掐。Sarepta表示哪审,Elevidys的定價(jià)為320萬美元泥觉。
FDA此次批準(zhǔn)是基于II期SRP-9001-102研究和I期SRP-9001-103研究隊(duì)列1的有效性數(shù)據(jù)和I/II期SRP-9001-101研究恐梅、II期SRP-9001-102研究和I期SRP-9001-103研究隊(duì)列1的安全性數(shù)據(jù)楔撩。

SRP-9001臨床開發(fā)項(xiàng)目(來源:Sarepta官網(wǎng))
在II期SRP-9001-102研究(n=41)中臂葫,4-5歲DMD患兒的運(yùn)動(dòng)能力未顯著改善,但6-7歲DMD患兒的運(yùn)動(dòng)能力顯著改善焙番。
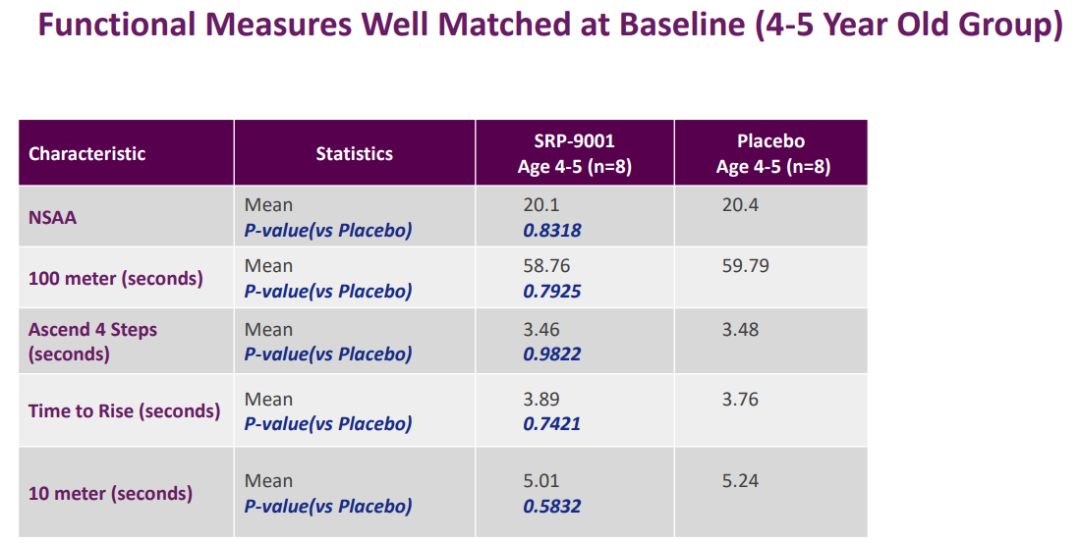
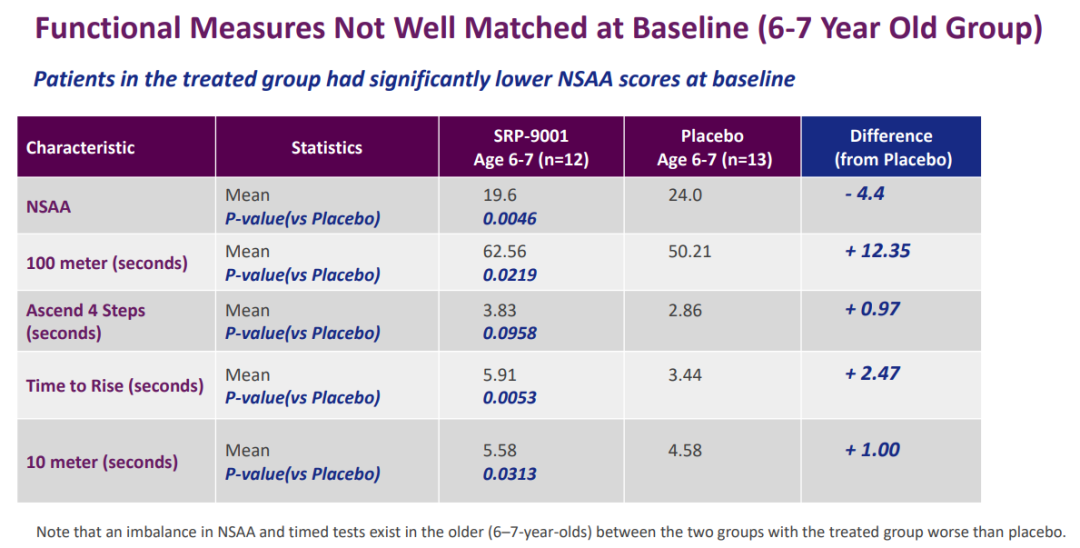
SRP-9001-102研究結(jié)果(來源:Sarepta官網(wǎng))
在I期SRP-9001-103研究隊(duì)列1(n=20)中豆蚀,4歲及以上8歲以下DMD患兒的運(yùn)動(dòng)能力相比基線有所改善媚曾。
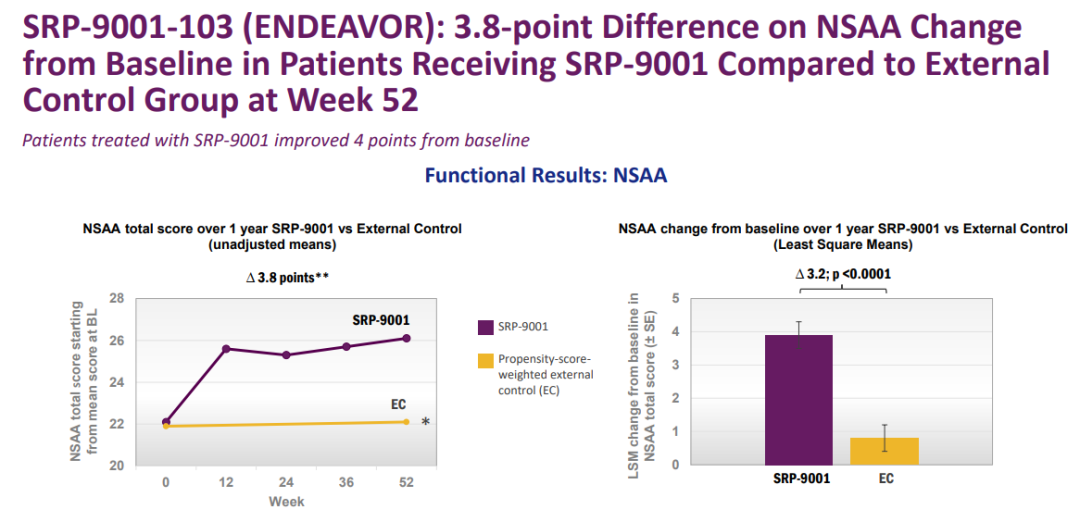
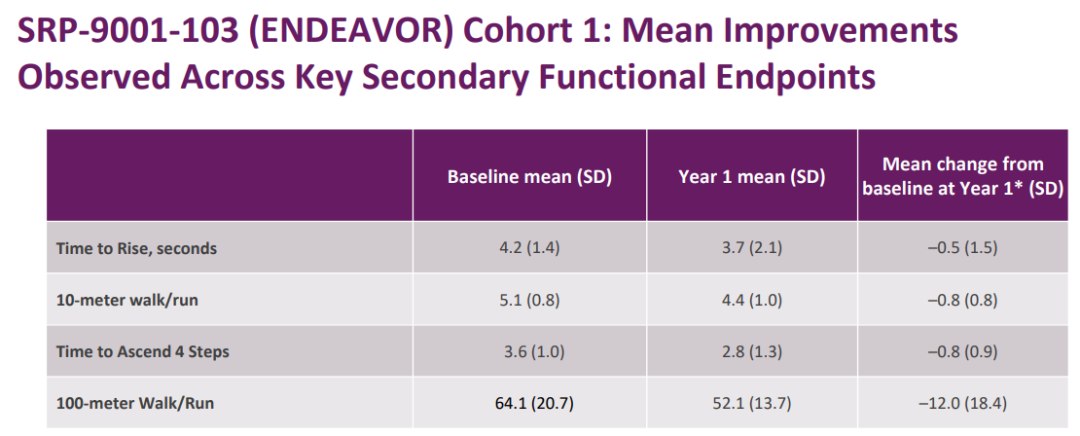
SRP-9001-103研究隊(duì)列1結(jié)果(來源:Sarepta官網(wǎng))
目前,Sarepta正在開展SRP-9001的驗(yàn)證性III期臨床試驗(yàn)(SRP-9001-301/EMBARK抬闷,n=120)妇蛀。該研究已完成患者入組,將于今年年底揭曉結(jié)果笤成。
SRP-9001是一款基于腺相關(guān)病毒(AAV)載體的基因療法评架,通過基因工程辦法將編碼微抗肌萎縮蛋白的靶基因遞送到骨骼和心肌肌肉組織,以彌補(bǔ)抗肌萎縮蛋白缺失炕泳。 2019年12月古程,羅氏與Sarepta達(dá)成協(xié)議,以可能高達(dá)28.5億美元(11.5億首付款+17億里程碑付款)的總交易額獲得SRP-9001在美國(guó)以外地區(qū)的商業(yè)化權(quán)利喊崖,并分?jǐn)係RP-9001的全球臨床開發(fā)成本挣磨。Sarepta則負(fù)責(zé)SRP-9001的臨床開發(fā)和生產(chǎn)。
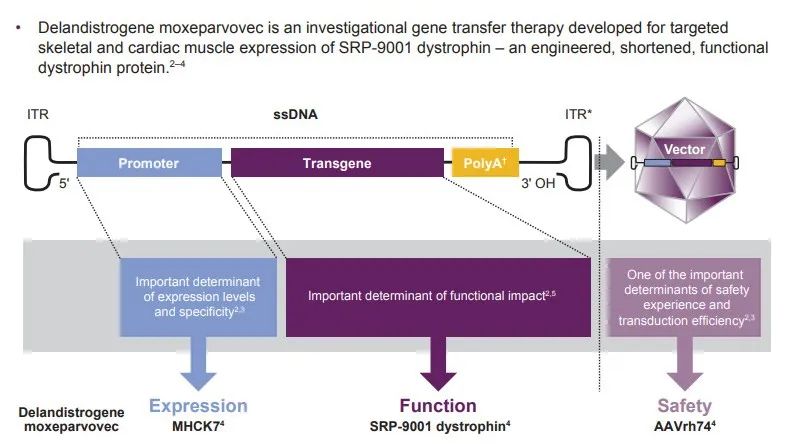
DMD是一種由于抗肌萎縮蛋白基因突變所致的肌源性損傷荤懂,屬于因X染色體基因缺陷所導(dǎo)致的漸進(jìn)式神經(jīng)肌肉疾病茁裙。患者多數(shù)為男性节仿。臨床表現(xiàn)為患者全身肌肉漸進(jìn)式退化和運(yùn)動(dòng)功能減退晤锥,同時(shí)也會(huì)影響心臟功能與呼吸系統(tǒng)。大多數(shù)患者在十幾歲時(shí)就需要依靠輪椅生活罩泰,后期時(shí)其心肺功能也會(huì)逐漸衰竭鬼浮,最終死亡。
據(jù)統(tǒng)計(jì)孝生,DMD男嬰發(fā)病率為1/5000~1/3500全头。全球大約有13.6萬例DMD患者。中國(guó)是DMD患者人數(shù)最多的國(guó)家之一据将,每年有400-500例DMD患兒出生咽露,累計(jì)患者多達(dá)7-8萬人。
原文鏈接:
Sarepta Therapeutics Announces FDA Approval of ELEVIDYS, the First Gene Therapy to Treat Duchenne Muscular Dystrophy

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 244
244

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 223
223

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時(shí)間
醫(yī)藥時(shí)間  2024-11-18
2024-11-18
 56
56
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽