
 研發(fā)追蹤
研發(fā)追蹤
 Medaverse
Medaverse  2023-07-03
2023-07-03
 2515
2515
剛剛捡奖,美國FDA批準(zhǔn)了第一種針對最常見形式A型血友病的基因療法上市高职,治療成人嚴(yán)重A型血友布侠健(先天性凝血因子VIII缺乏癥侣夷,F(xiàn)VIII活性<1 IU/dL)等盏,無需通過FDA批準(zhǔn)的測試檢測到腺相關(guān)病毒血清型5(AAV5)抗體岩哥。(剛剛慷郎!FDA批準(zhǔn)首款DMD基因治療上市啡产,定價320萬美元)

該療法背后的加州公司BioMarin計劃以ROCTAVIAN? (valoctocogene roxaparvovec-rvox) 品牌商業(yè)化。它專門用于治療血友病A促驶,這是由基因突變引起的肢有,基因突變抑制了一種關(guān)鍵的凝血蛋白因子VIII的產(chǎn)生。(重磅物遗!FDA批準(zhǔn)首個B型血友病基因治療上市)
2天前乳侮,F(xiàn)DA接受輝瑞公司B型血友病基因治療上市申請Roctavian在美國的定價為290萬美元份览,高于該療法在歐洲的價格,歐洲的定價約為150萬歐元诉德,去年8月獲得批準(zhǔn)晃纹。(重磅!全球首款A(yù)型血友病基因治療獲有條件批準(zhǔn)上市柱洽,投入近9億美元)目前褂宙,B型血友病基因治療產(chǎn)品Hemgenix定價350萬美元、Bluebird Bio的β-地中海貧血基因療法Zynteglo定價280萬美元和Skysona(定價300萬美元)本谜、PTC開發(fā)的Upstaza定價300萬英鎊初家、DMD基因治療定價320萬美元。
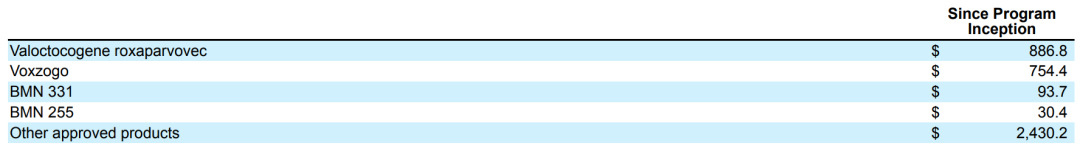
截止2022年6月30日乌助,自立項以來已經(jīng)燒掉8.868億美元
一次性輸注Roctavian是第一個獲批的A型血友病基因療法溜在,它通過提供一種功能基因來發(fā)揮作用旨在使身體能夠自行產(chǎn)生凝血因子VIII,而無需繼續(xù)進(jìn)行血友病預(yù)防他托,從而減輕患者相對于目前可用療法的治療負(fù)擔(dān)掖肋。A型血友病患者的基因發(fā)生突變,該基因負(fù)責(zé)產(chǎn)生凝血因子VIII赏参,一種凝血所必需的蛋白質(zhì)志笼。
FDA的決定結(jié)束了Roctavian進(jìn)入美國市場的漫長旅程。BioMarin最初于2019年底提交了一份批準(zhǔn)申請BLA把篓,得到了一項大型臨床試驗的證據(jù)的支持纫溃,該試驗表明其療法大大降低了嚴(yán)重A型血友病患者的出血率和對凝血因子VIII輸注的需求。
盡管有這些結(jié)果韧掩,F(xiàn)DA還是意外地拒絕了BioMarin的申請紊浩,并要求收集該試驗中每個參與者至少兩年的數(shù)據(jù)。值得注意的是柒汉,基因療法的安全性和長期有效性一直是美國FDA和其他藥品監(jiān)管機(jī)構(gòu)關(guān)注的焦點碘云。還有跡象表明,BioMarin的治療效果可能會隨著時間的推移而減弱否抛。
BioMarin滿足了這一要求拦腌,但2022年底表示,F(xiàn)DA也希望看到三年的數(shù)據(jù)言酪。該公司不久后提交了這些結(jié)果岭限,但為了有足夠的時間進(jìn)行適當(dāng)?shù)膶彶椋現(xiàn)DA將審查截止日期推遲到6月30日败饵。
FDA的批準(zhǔn)是基于全球3期基因8-1研究的數(shù)據(jù)酣器,這是血友病基因治療中最大的3期試驗。在本研究中接受ROCTAVIAN治療的134名患者中,112名患者的基線年化出血率(ABR)數(shù)據(jù)是前瞻性收集的吝重,這些數(shù)據(jù)是在接受ROCTAVIAN治療前至少六個月的FVIII預(yù)防期間收集的征乳。其余22例患者進(jìn)行了基線ABR的回顧性收集。所有患者均接受了至少3年的隨訪沦匿。
隨著現(xiàn)在的批準(zhǔn)律姨,BioMarin的重點將轉(zhuǎn)向確保其療法的成功推出。盡管該公司還有其他七種上市藥物臼疫,但在其26年的運(yùn)營中择份,大部分時間都沒有盈利。但分析人士認(rèn)為烫堤,Roctavian可能是引爆點荣赶。SVB證券公司的Joseph Schwartz預(yù)測,年銷售額峰值約為22億美元鸽斟。
BioMarin和其他基因治療開發(fā)人員認(rèn)為拔创,只給藥一次,這些治療可能比常規(guī)的凝血因子VIII替代品或更新的長效藥物更具成本效益富蓄。例如剩燥,羅氏公司的血友病A藥物Hemlibra的標(biāo)價約為50萬美元,由于它可以每四周服用一次格粪,因此越來越受歡迎。
然而氛改,BioMarin的治療方法不會適用于美國所有的血友病A患者帐萎。FDA只批準(zhǔn)用于一種抗體檢測呈陰性的嚴(yán)重疾病患者,這種抗體攻擊Roctavian用來將其有益的遺傳物質(zhì)輸送到細(xì)胞中的病毒臊癞。
此前辐逝,BioMarin估計,由于這些抗體存在绣嫉,美國約20%的患者和全球約30%的患者將不符合Roctavian的資格黄惭。
原文鏈接:https://www.biomarin.com/blog/fda-approves-biomarins-gene-therapy-for-a-genetic-bleeding-disorder/

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 243
243

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 222
222

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時間
醫(yī)藥時間  2024-11-18
2024-11-18
 56
56
 熱門資訊
熱門資訊