
 研發(fā)追蹤
研發(fā)追蹤
 Insight數(shù)據(jù)庫
Insight數(shù)據(jù)庫  2023-07-24
2023-07-24
 1894
1894
7 月 20 日监征,第一三共宣布够堆,其在研新藥 quizartinib(VANFLYTA?)獲 FDA 批準(zhǔn)上市,用于治療 FLT3-ITD 突變新診斷急性髓細(xì)胞白血踩赂ā(AML)成人患者咕痛。
quizartinib 成為首個也是當(dāng)前唯一一個獲 FDA 批準(zhǔn)用于治療 FLT3-ITD 陽性 AML 的 FLT3 抑制劑痢甘,且涵蓋新診斷 AML 未移植患者的誘導(dǎo)、鞏固以及維持治療三個階段。這也是第一三共腫瘤管線中产阱,第 3 款獲 FDA 批準(zhǔn)的創(chuàng)新藥婉称。

來自:第一三共官網(wǎng)
此次獲批基于 QuANTUM-First 研究結(jié)果,已發(fā)表在柳葉刀期刊上构蹬。
這是一項隨機甩幔、雙盲、安慰劑對照研究祠喻,共納入了 539 名新診斷 FLT3-ITD 陽性 AML 患者栽乘,且按 1:1 被隨機分配接受 quizartinib 或安慰劑聯(lián)合標(biāo)準(zhǔn)誘導(dǎo)和鞏固治療后,繼續(xù)接受單藥維持治療藤瞪。
結(jié)果顯示挚粱,與安慰劑相比,quizartinib 組患者的死亡風(fēng)險降低了 22%(HR = 0.78媳把;95% CI: 0.62-0.98)惊柱,兩組患者的完全緩解(CR)率相似,不過俏妆,quizartinib 組患者 CR 的中位持續(xù)時間為 38.6 個月樱凄,而安慰劑組僅為 12.4 個月。
QuANTUM-First 研究結(jié)果


來自:Insight 數(shù)據(jù)庫網(wǎng)頁版(下同)
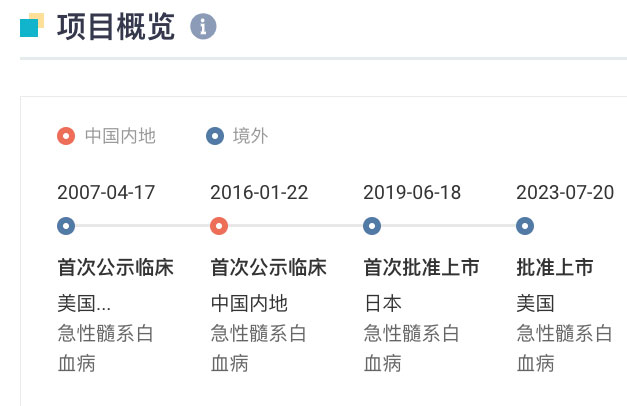
quizartinib 是一款口服失欢、具選擇性的 2 型 FLT3 抑制劑戈弧,據(jù) Insight 數(shù)據(jù)庫顯示,最早于 2019 年 6 月在日本獲批上市晨另,用于治療攜帶 FLT3-ITD 基因變異的復(fù)發(fā)/難治性(R/R)急性骨髓性白血蔡肚А(AML)成人患者。在國內(nèi)借尿,于 2016 年 1 月首次啟動臨床刨晴,當(dāng)前正處于 III 期臨床階段。
Quizartinib 全球項目開發(fā)關(guān)鍵節(jié)點

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125