
 協(xié)會(huì)活動(dòng)
協(xié)會(huì)活動(dòng)
 中國(guó)醫(yī)藥創(chuàng)新促進(jìn)會(huì)
中國(guó)醫(yī)藥創(chuàng)新促進(jìn)會(huì)  2023-07-27
2023-07-27
 1359
1359
在7月21日舉辦的“2023中國(guó)醫(yī)藥創(chuàng)新政策論壇”上,中國(guó)醫(yī)藥創(chuàng)新促進(jìn)會(huì)執(zhí)行會(huì)長(zhǎng)宋瑞霖分享了“推動(dòng)中國(guó)醫(yī)藥創(chuàng)新高質(zhì)量發(fā)展的思考”的主題報(bào)告阐赖。他在報(bào)告中聚焦現(xiàn)階段創(chuàng)新同質(zhì)化的問(wèn)題饼齿,從基礎(chǔ)研究抽述、臨床研究與轉(zhuǎn)化等完善產(chǎn)業(yè)鏈領(lǐng)域实牡,深度分析了制約原始創(chuàng)新的關(guān)鍵因素疗刮,并提出相應(yīng)的政策建議虽抄。

勵(lì)精圖治的政策之路從未停歇脸侥,“第二方陣”毋庸置疑
醫(yī)藥行業(yè)最大的特點(diǎn)在于政策敏感性畏纲,國(guó)家醫(yī)保局關(guān)于創(chuàng)新藥談判準(zhǔn)入的續(xù)約和競(jìng)價(jià)規(guī)則征求意見(jiàn)稿引發(fā)資本市場(chǎng)上漲正是其生動(dòng)體現(xiàn)扇住。宋瑞霖會(huì)長(zhǎng)認(rèn)為,好的政策能夠體現(xiàn)在產(chǎn)業(yè)價(jià)值上霍骄。
他指出我國(guó)是全球醫(yī)藥政策領(lǐng)域最活躍的國(guó)家台囱,中國(guó)緊緊圍繞“推進(jìn)健康中國(guó)建設(shè)”的重大理念,勵(lì)精圖治的政策之路從未停歇读整。從2015年到2022年我們經(jīng)歷了藥品的審評(píng)制度改革簿训,經(jīng)歷了《藥品管理法》的修改,《疫苗管理法》的制定米间,以及《專(zhuān)利法》的修改强品。
政策的改善必然會(huì)帶來(lái)改革的成果。我國(guó)創(chuàng)新穩(wěn)步前行,歷年首次IND的榛、首次NDA琼了、首次獲批上市的國(guó)產(chǎn)創(chuàng)新藥數(shù)量不斷提升。尤為重要的是仔同,我國(guó)醫(yī)藥創(chuàng)新研發(fā)標(biāo)準(zhǔn)已與國(guó)際全面接軌键切,ICH指導(dǎo)原則落地轉(zhuǎn)化率在實(shí)踐中已實(shí)現(xiàn)了100%。在這一過(guò)程中圃靖,中國(guó)深度參與了ICH規(guī)則制定龙喂,為世界醫(yī)藥創(chuàng)新做出了應(yīng)有貢獻(xiàn),也為中國(guó)醫(yī)藥創(chuàng)新未來(lái)奠定了基礎(chǔ)榛蜻。在IFPMA與ICH秘書(shū)處所組成的國(guó)際專(zhuān)家組成員中秧梨,由中國(guó)藥促會(huì)推薦的中國(guó)專(zhuān)家達(dá)到了總數(shù)的53%。中國(guó)醫(yī)藥創(chuàng)新研發(fā)對(duì)全球的貢獻(xiàn)已經(jīng)居于“第二梯隊(duì)”前列盅力,無(wú)可爭(zhēng)議妻行。
直面挑戰(zhàn):產(chǎn)業(yè)創(chuàng)新與臨床需求脫節(jié),原始創(chuàng)新缺失
“雖然中國(guó)穩(wěn)居‘第二方陣’前列按任,但和美國(guó)相比有明顯的差距汉疮。中國(guó)醫(yī)藥創(chuàng)新越是前行的速度快,我們?cè)桨l(fā)現(xiàn)面臨的挑戰(zhàn)多乏唤】沤椋”宋瑞霖會(huì)長(zhǎng)直言。
報(bào)告指出苇经,基礎(chǔ)研究能力仍需提升赘理。從研究機(jī)構(gòu)的世界排名來(lái)看,在2021年Nature index指數(shù)評(píng)估TOP100生命科學(xué)機(jī)構(gòu)和醫(yī)學(xué)研究機(jī)構(gòu)中扇单,中國(guó)機(jī)構(gòu)的數(shù)量與2015年相比幅度提升商模,尤其是醫(yī)學(xué)研究機(jī)構(gòu)與2015年相比從1家增長(zhǎng)至22家。這22家中國(guó)醫(yī)學(xué)研究機(jī)構(gòu)地域分布在上海9家蜘澜、廣州與杭州各3家施流,成都與武漢各2家、北京合肥南京各1家鄙信。
基礎(chǔ)研究的成果轉(zhuǎn)化亟需加強(qiáng)瞪醋。我國(guó)專(zhuān)利申請(qǐng)數(shù)量為全球第一大國(guó),但是相當(dāng)一部分沒(méi)有得到國(guó)際專(zhuān)利授權(quán)装诡,高校及科研院所的專(zhuān)利轉(zhuǎn)化率常年處于低位银受,醫(yī)藥專(zhuān)利授權(quán)轉(zhuǎn)化能力明顯不足。根據(jù)國(guó)家知識(shí)產(chǎn)權(quán)局2021年關(guān)于制約專(zhuān)利轉(zhuǎn)移轉(zhuǎn)化因素的調(diào)查報(bào)告鸦采,有58.3%的專(zhuān)利不能滿足市場(chǎng)化需求宾巍,更有54.8%的專(zhuān)利申請(qǐng)本身不以轉(zhuǎn)移轉(zhuǎn)化為目的因摸。
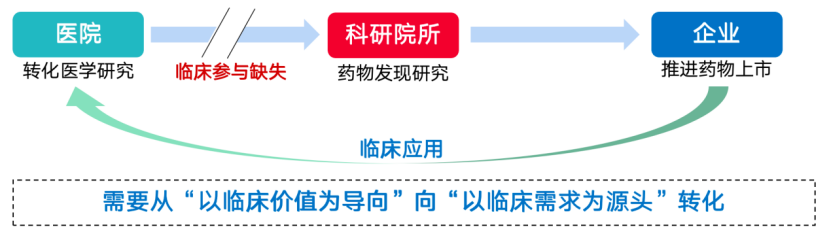
宋瑞霖會(huì)長(zhǎng)解析,專(zhuān)利只能證明是否原創(chuàng)叭蜂,與藥好不好無(wú)關(guān)侦滩,但如果專(zhuān)利申請(qǐng)本身只是為了申請(qǐng)職稱(chēng)卻從未考慮是否可以轉(zhuǎn)化,意味著源頭創(chuàng)新的缺失唬研。臨床需求與產(chǎn)業(yè)創(chuàng)新發(fā)展明顯脫節(jié)假祝,新藥研發(fā)都在“盯著藥”而非“盯著病”,必然導(dǎo)致創(chuàng)新同質(zhì)化的現(xiàn)象嚴(yán)重昵鳍。若要擺脫這一困境抢必,醫(yī)藥的創(chuàng)新研發(fā)就需要從“以臨床價(jià)值為導(dǎo)向”向“以臨床需求為源頭”轉(zhuǎn)化。
宋瑞霖:我國(guó)缺少臨床醫(yī)學(xué)科學(xué)家难宋,是政策導(dǎo)向出了問(wèn)題
基礎(chǔ)研究和技術(shù)轉(zhuǎn)化已經(jīng)成為制約產(chǎn)業(yè)創(chuàng)新發(fā)展的瓶頸。如何將基礎(chǔ)研究和轉(zhuǎn)化醫(yī)學(xué)的研發(fā)落到實(shí)處厕扼、暢通創(chuàng)新產(chǎn)業(yè)鏈乙闰,不僅僅是產(chǎn)業(yè)界,也是醫(yī)學(xué)界認(rèn)真思考的問(wèn)題胚茴。
從完善產(chǎn)業(yè)鏈政策角度來(lái)看互墓,創(chuàng)新鏈條源頭端供給不足,制約了科研成果發(fā)揮創(chuàng)新源頭的作用蒋搜。臨床醫(yī)學(xué)轉(zhuǎn)化是基礎(chǔ)科學(xué)實(shí)現(xiàn)試驗(yàn)轉(zhuǎn)化與產(chǎn)業(yè)化的關(guān)鍵環(huán)節(jié)篡撵,更是醫(yī)藥創(chuàng)新的重要來(lái)源。由申辦方發(fā)起的注冊(cè)性試驗(yàn)(IST)與由研究者發(fā)起的臨床研究(IIT)相輔相成豆挽,共同擴(kuò)展藥物研究的廣度和深度育谬。當(dāng)前我國(guó)新藥臨床試驗(yàn)主要是由藥企發(fā)起,而IIT作為全球醫(yī)療中廣泛存在的重要研究形式帮哈,在我國(guó)開(kāi)展臨床試驗(yàn)用于注冊(cè)的數(shù)量少之又少膛檀。我國(guó)目前醫(yī)療機(jī)構(gòu)主要承擔(dān)臨床治療、臨床試驗(yàn)的職責(zé)娘侍,對(duì)IIT研究的定位僅局限于已上市藥物的適應(yīng)癥探索咖刃,轉(zhuǎn)化醫(yī)學(xué)沒(méi)有在新藥研發(fā)的整體鏈條中發(fā)揮作用。
除了不斷完善創(chuàng)新產(chǎn)業(yè)鏈憾筏,創(chuàng)新藥的市場(chǎng)政策仍需加強(qiáng)嚎杨。宋瑞霖會(huì)長(zhǎng)強(qiáng)調(diào),合理的創(chuàng)新回報(bào)是市場(chǎng)發(fā)展的前提氧腰,藥物創(chuàng)新的目的是能夠應(yīng)用于臨床實(shí)現(xiàn)價(jià)值枫浙。實(shí)施“雙通道”政策是因?yàn)閯?chuàng)新藥在醫(yī)療機(jī)構(gòu)的準(zhǔn)入障礙。根據(jù)RDPAC《國(guó)談藥品落地情況分析》锋辩,2017-2021年談判納入醫(yī)保的49種抗腫瘤藥在三級(jí)醫(yī)院配備率平均為16.8%暖经。

他同時(shí)強(qiáng)調(diào),罕見(jiàn)病患者用藥可及性是不可回避的問(wèn)題。目前談判藥品費(fèi)用支出對(duì)醫(yī)甭乒担基金的影響甚微姚菱,創(chuàng)新藥的市場(chǎng)份額遠(yuǎn)不及輔助用藥的份額,新藥價(jià)格與合理用藥問(wèn)題亟待進(jìn)一步解決葛暇,政策調(diào)整的空間巨大皂汞。
抓短板,找漏洞尼软,激活創(chuàng)新之“源”
今年5月熄晕,習(xí)近平總書(shū)記強(qiáng)調(diào)生物醫(yī)藥產(chǎn)業(yè)是關(guān)系國(guó)計(jì)民生和國(guó)家安全的戰(zhàn)略性新興產(chǎn)業(yè),這是繼國(guó)務(wù)院確定七大戰(zhàn)略性新興產(chǎn)業(yè)之后便透,習(xí)近平總書(shū)記對(duì)生物醫(yī)藥產(chǎn)業(yè)戰(zhàn)略性地位的又一次明確定位尔网。基于此航厚,關(guān)于生物醫(yī)藥產(chǎn)業(yè)的政策研究及發(fā)展規(guī)劃要主動(dòng)對(duì)接這一戰(zhàn)略需求顷歌。
行業(yè)政策的完善需要回歸至黨中央國(guó)務(wù)院對(duì)生物醫(yī)藥的戰(zhàn)略定位,醫(yī)藥行業(yè)政策完善更需前瞻性的目光幔睬。宋瑞霖會(huì)長(zhǎng)認(rèn)為“戰(zhàn)略性決定我們必須要登高望遠(yuǎn)眯漩,我們一定要能夠考慮到未來(lái),當(dāng)我們填補(bǔ)空白之后麻顶,我們吃飽肚子之后赦抖,我們要想明天、后天辅肾、未來(lái)怎么過(guò)队萤。”關(guān)于激發(fā)原始創(chuàng)新動(dòng)力和活力宛瞄,促進(jìn)醫(yī)藥創(chuàng)新高質(zhì)量長(zhǎng)期發(fā)展浮禾,他提出以下幾點(diǎn)思考和建議:
一是建立基礎(chǔ)研究成果轉(zhuǎn)化和市場(chǎng)回報(bào)之間的雙循環(huán)。7月11日習(xí)近平總書(shū)記主持召開(kāi)的中央全面深化改革委員會(huì)第二次會(huì)議強(qiáng)調(diào)開(kāi)展高等學(xué)校份汗、科研院所薪酬制度改革試點(diǎn)盈电。建議政策上放開(kāi)研究成果轉(zhuǎn)化方式,允許基礎(chǔ)研究者個(gè)人與企業(yè)之間建立市場(chǎng)化伤刑、商業(yè)化框架下的合作機(jī)制探快,以激發(fā)個(gè)人和團(tuán)隊(duì)的積極性,促進(jìn)基礎(chǔ)藥物研究的深度發(fā)展入撇。在全球角度下新興生物制藥企業(yè)始終在醫(yī)藥研發(fā)中占據(jù)主體地位榨狐,真正的創(chuàng)新往往是來(lái)自該類(lèi)企業(yè),即“Small company big thinking”晤裆。
二是探索放開(kāi)IIT臨床研究的限制咱漱,推動(dòng)源頭創(chuàng)新能力提升屈腻。基礎(chǔ)臨床研究是原始創(chuàng)新的核心點(diǎn)和起點(diǎn)。我們需要在風(fēng)險(xiǎn)與發(fā)展之間進(jìn)行平衡温履,對(duì)PI進(jìn)行嚴(yán)格的資質(zhì)管理姑王,確保其足以控制IIT臨床試驗(yàn)的風(fēng)險(xiǎn);同時(shí)對(duì)IIT臨床試驗(yàn)機(jī)構(gòu)的資質(zhì)嚴(yán)格管理亥护、逐步放開(kāi)盆战,聯(lián)合形成“產(chǎn)、學(xué)绎彪、研诈火、用”的創(chuàng)新體系。
以CAR-T領(lǐng)域?yàn)槔创穑覈?guó)對(duì)CAR-T的雙軌制監(jiān)管冷守,導(dǎo)致CAR-T臨床研究突破了傳統(tǒng)IIT僅針對(duì)已上市產(chǎn)品的限定,多數(shù)企業(yè)通過(guò)與醫(yī)院合作進(jìn)行IIT收集數(shù)據(jù)并對(duì)細(xì)胞治療產(chǎn)品進(jìn)行早期確證剪况。進(jìn)而造就中國(guó)在CAR-T領(lǐng)域的世界領(lǐng)先地位教沾,目前全球獲批CAR-T產(chǎn)品有8個(gè),其中4個(gè)為中國(guó)企業(yè)研發(fā)译断。
三是需要打破信息孤島,強(qiáng)化醫(yī)研企的合作或悲。以生物樣本庫(kù)為例孙咪,目前我國(guó)眾多的生物樣本均封閉在各個(gè)醫(yī)院的冷庫(kù)里,沒(méi)有實(shí)現(xiàn)信息巡语、數(shù)據(jù)的共享翎蹈。加強(qiáng)合作、數(shù)據(jù)互通是醫(yī)藥創(chuàng)新進(jìn)一步發(fā)展的必要條件男公。
四是尊重創(chuàng)新藥價(jià)值荤堪,不斷完善高價(jià)值創(chuàng)新藥保障體系,建立以臨床價(jià)值為導(dǎo)向的藥品全生命周期準(zhǔn)入體系码完。高價(jià)格的創(chuàng)新藥無(wú)法進(jìn)入醫(yī)保時(shí)办适,受影響最大的為弱勢(shì)群體,這與醫(yī)币模“钡闳埽基本”的原則相違背。建議通過(guò)風(fēng)險(xiǎn)共擔(dān)的形式搭建創(chuàng)新藥的合理回報(bào)模型淫雾,同時(shí)也為商業(yè)保險(xiǎn)留出發(fā)展空間比端;針對(duì)多數(shù)創(chuàng)新藥通過(guò)加速批準(zhǔn)上市、臨床價(jià)值尚不明確的情況簇像,設(shè)立動(dòng)態(tài)評(píng)估機(jī)制侵念,使其能夠基于臨床價(jià)值獲得合理收益帚棚。
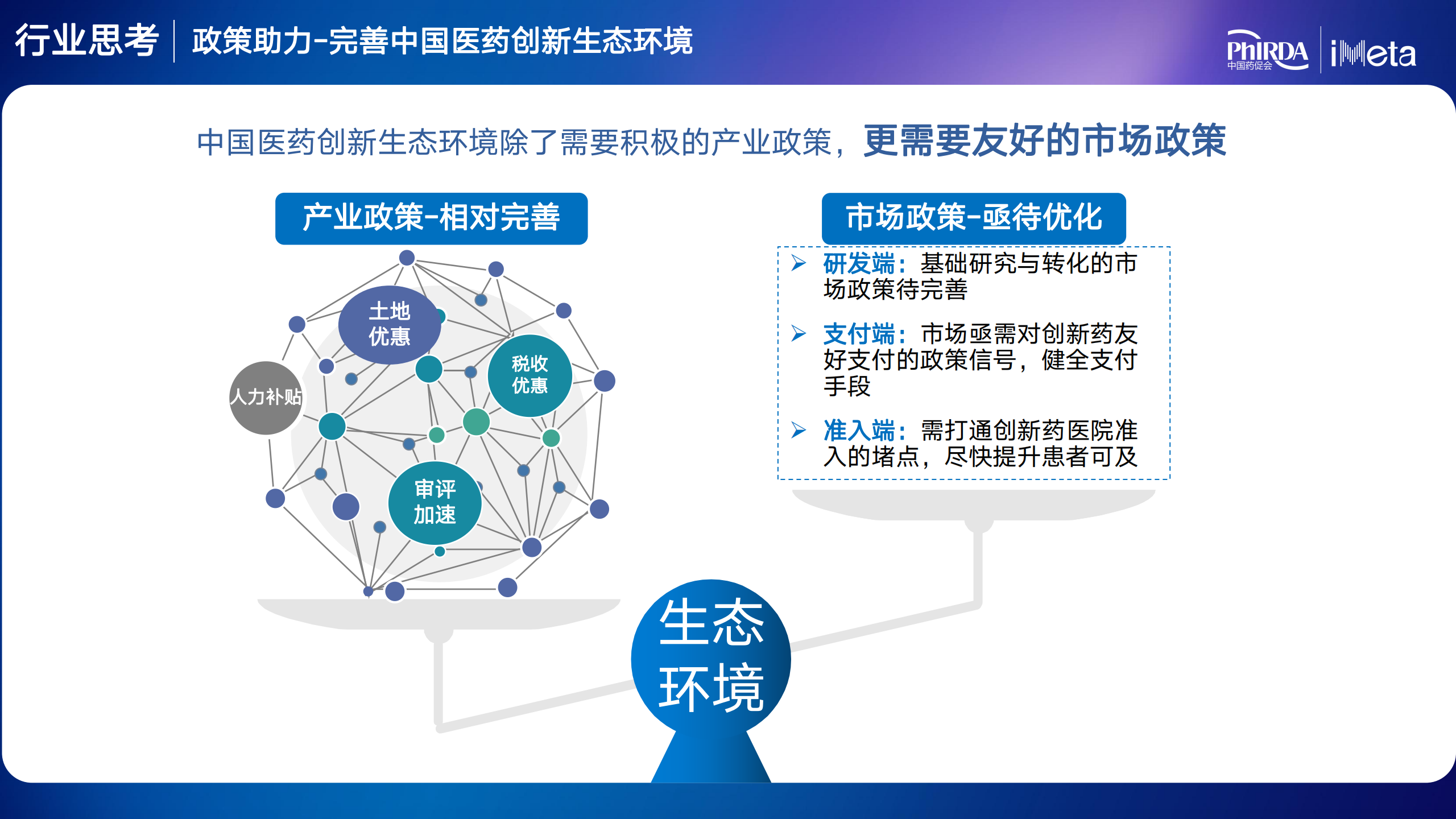
最后,他認(rèn)為中國(guó)醫(yī)藥創(chuàng)新生態(tài)環(huán)境除了需要積極的產(chǎn)業(yè)政策捎虚,更需要友好的市場(chǎng)政策兆性。只有不斷完善藥物創(chuàng)新的政策生態(tài)環(huán)境,才能有效帶動(dòng)產(chǎn)業(yè)投資和發(fā)展亮花,激發(fā)原始創(chuàng)新動(dòng)力和活力副瀑,進(jìn)而推動(dòng)中國(guó)醫(yī)藥創(chuàng)新高質(zhì)量發(fā)展。

 協(xié)會(huì)活動(dòng)
協(xié)會(huì)活動(dòng)
 中國(guó)食品藥品監(jiān)管雜志
中國(guó)食品藥品監(jiān)管雜志  2024-08-18
2024-08-18
 196
196

 協(xié)會(huì)活動(dòng)
協(xié)會(huì)活動(dòng)
 中國(guó)醫(yī)藥創(chuàng)新促進(jìn)會(huì)
中國(guó)醫(yī)藥創(chuàng)新促進(jìn)會(huì)  2024-07-29
2024-07-29
 1548
1548

 協(xié)會(huì)活動(dòng)
協(xié)會(huì)活動(dòng)
 中國(guó)醫(yī)藥創(chuàng)新促進(jìn)會(huì)
中國(guó)醫(yī)藥創(chuàng)新促進(jìn)會(huì)  2024-07-09
2024-07-09
 1521
1521
 熱門(mén)資訊
熱門(mén)資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽