
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2023-09-04
2023-09-04
 2418
2418
8月28日,艾伯維宣布舷蒲,已向FDA和EMA遞交了利生奇珠單抗(Skyrizi例书,1200 mg靜脈注射[IV][誘導(dǎo)劑量]和180mg和360mg皮下注射[維持劑量])的新適應(yīng)癥上市申請(qǐng),用于治療中度至重度活動(dòng)性潰瘍性結(jié)腸炎成人患者攀隔。

此次向FDA和EMA的申請(qǐng)得到了兩項(xiàng)III期臨床試驗(yàn)數(shù)據(jù)的支持:誘導(dǎo)研究INSPIRE和維持研究COMMAND皂贩。INSPIRE研究顯示接受利生奇珠單抗(1200 mg,第0二焰、4和8周IV)治療的中度至重度活動(dòng)性潰瘍性結(jié)腸炎成人患者在第12周達(dá)到臨床緩解(根據(jù)改良Mayo評(píng)分)纹站,以及所有次要研究終點(diǎn)。該研究中谣旨,接受利生奇珠單抗治療的患者達(dá)到臨床緩解的比例為20.3%泌位,相比之下,接受安慰劑治療的患者達(dá)到臨床緩解的比例為6.2%(p<0.00001)尘蟋。
COMMAND維持試驗(yàn)中酒妄,來(lái)自INSPIRE試驗(yàn)對(duì)誘導(dǎo)治療產(chǎn)生應(yīng)答的患者被重新隨機(jī)分配,接受利生奇珠單抗180 mg巍也、360 mg皮下注射蜜硫,或著停止治療。結(jié)果顯示兵蟹,接受利生奇珠單抗180mg和360mg組患者在52周時(shí)達(dá)到臨床緩解的比例顯著更高谚碌,分別為40%和38%,對(duì)照組為25%(p<0.01)笆抱。利生奇珠單抗180mg和360mg組患者達(dá)到內(nèi)鏡檢查改善广料、組織學(xué)內(nèi)鏡檢查粘膜改善、無(wú)皮質(zhì)類固醇的臨床緩解的患者比例也明顯更高。
INSPIRE和COMMAND的安全性結(jié)果與先前研究中觀察到的利生奇珠單抗在其他適應(yīng)癥中的安全性基本一致艾杏,未觀察到新的安全性風(fēng)險(xiǎn)韧衣。
利生奇珠單抗是一種白細(xì)胞介素-23(IL-23)抑制劑,可通過(guò)與IL-23 p19亞基結(jié)合來(lái)選擇性阻斷IL-23购桑。IL-23是一種參與炎癥過(guò)程的細(xì)胞因子畅铭,被認(rèn)為與許多慢性免疫介導(dǎo)疾病有關(guān)。利生奇珠單抗已獲得美國(guó)FDA和歐洲藥品管理局批準(zhǔn)用于治療多種不同類型銀屑病勃蜘、銀屑病關(guān)節(jié)炎和克羅恩病硕噩。
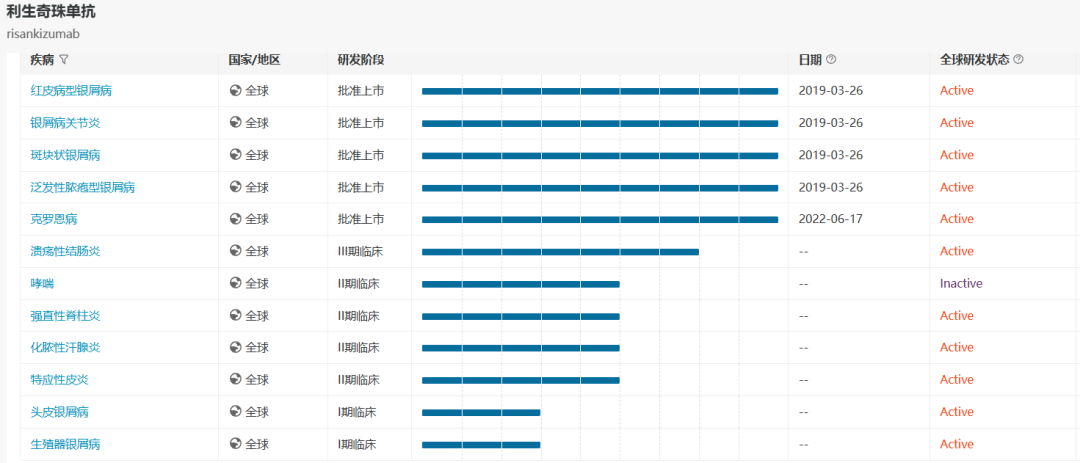
利生奇珠單抗適應(yīng)癥布局(來(lái)源:醫(yī)藥魔方NextPharma)
2023年,隨著Humira專利到期元旬,安進(jìn)的阿達(dá)木單抗生物類似藥正式進(jìn)入美國(guó)市場(chǎng)榴徐,Humira“稱王”的時(shí)代將結(jié)束。IL-23單抗Skyrizi和口服JAK1抑制劑Rinvoq(烏帕替尼)已強(qiáng)勢(shì)補(bǔ)位匀归,在2022年均以50%以上的增長(zhǎng)率交出亮眼答卷坑资,分別實(shí)現(xiàn)51.65和25.22億美元收入√何瑁基于這3款產(chǎn)品的優(yōu)異表現(xiàn)爹故,毫無(wú)疑問(wèn),艾伯維在全球自免領(lǐng)域的領(lǐng)導(dǎo)地位不可撼動(dòng)沥院。

 研發(fā)追蹤
研發(fā)追蹤
 藥時(shí)代
藥時(shí)代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125
 熱門(mén)資訊
熱門(mén)資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽