
 研發(fā)追蹤
研發(fā)追蹤
 E信使
E信使  2023-09-11
2023-09-11
 3077
3077
2023年9月6日椿每,楊森宣布其腫瘤產(chǎn)品Amivanatamab的一項III期臨床試驗(MARIPOSA-2)達(dá)到主要研究終點PFS然低。

MARIPOSA-2(NCT04988295)是一項隨機、開放標(biāo)簽的III期臨床試驗妒贞,旨在評估奧希替尼耐藥后翁写,amivantamab+lazertinib+卡鉑+培美曲塞(LACP,A組)vs.卡鉑+培美曲塞(CP剑银,B組)在EGFR常見突變(Exon19del/Exon21 L858R)的局部晚期或轉(zhuǎn)移性NSCLC患者中的有效性和安全性汰检。與此同時,該研究還另設(shè)amivantamab+卡鉑+培美曲塞組(ACP嫩玻,C組)以對比評估lazertinib在LACP組患者中的治療效果六呼。該臨床試驗的主要終點是無進(jìn)展生存期(PFS);關(guān)鍵次要終點包括客觀緩解率(ORR)尘腕、總生存期(OS)刨税、緩解持續(xù)時間(DoR)、顱內(nèi)PFS等摸马。
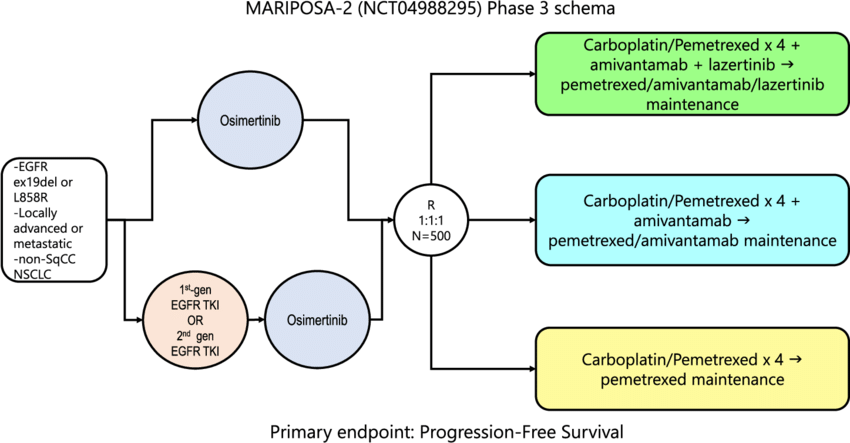
MARIPOSA-2研究設(shè)計
數(shù)據(jù)結(jié)果表明筏所,MARIPOSA-2研究達(dá)到雙重主要終點,即與單獨化療組(B組)相比五逢,兩個治療組(A組和C組)PFS具有統(tǒng)計學(xué)意義和臨床意義的顯著改善蜀悯。安全性方面,與以前研究的數(shù)據(jù)一致竹观,沒有觀察到新的安全信號镐捧。楊森將在后續(xù)的醫(yī)學(xué)大會上公布詳細(xì)結(jié)果。
MARIPOSA-2研究的陽性結(jié)果臭增,調(diào)高了業(yè)界對amivantamab+lazertinib組合在一線與奧希替尼和lazertinib頭對頭比較的預(yù)期懂酱,非常激進(jìn)的一線臨床試驗MARIPOSA正在進(jìn)行中,信心來自于CHRYSALIS研究CohortE結(jié)果,Amivantamab聯(lián)合Lazertinib用于EGFR突變晚期NSCLC一線治療列牺,mDoR和mPFS超過28個月整陌,超出當(dāng)前三代EGFR-TKI單藥的療效,如果安全性沒有疊加瞎领,阿斯利康的拳頭產(chǎn)品奧希替尼在EGFR突變陽性NSCLC的地位將受到挑戰(zhàn)泌辫。
MARIPOSA研究(NCT04487080)旨在評估Amivantamab聯(lián)合Lazertinib對比奧希替尼在EGFR Exon19del或Exon 21(L858R)突變NSCLC患者一線治療中的有效性和安全性。
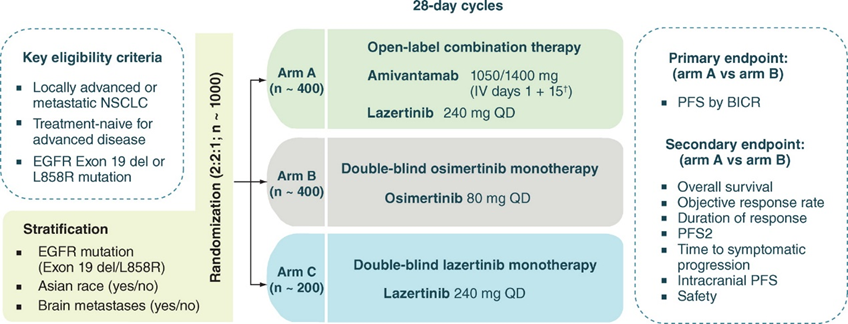
MARIPOSA研究設(shè)計圖
Amivantamab是楊森研發(fā)的EGFR/c-MET雙抗九默。2021年5月震放,amivantamab首次獲FDA批準(zhǔn),用于治療鉑類化療進(jìn)展后的攜帶EGFR外顯子20插入突變的晚期或轉(zhuǎn)移性NSCLC患者荤西,該藥物也是全球首款獲批的EGFR/c-MET雙抗澜搅。
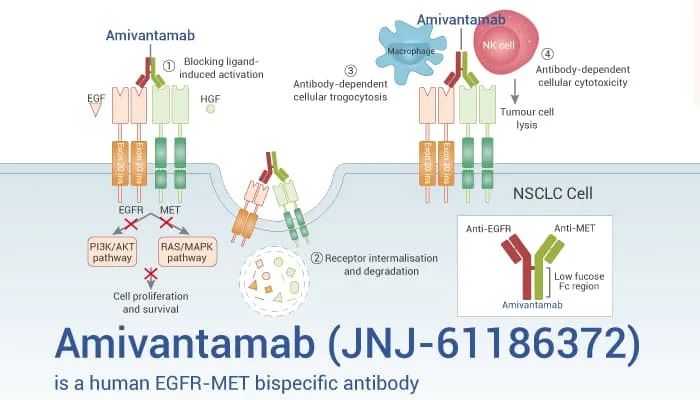
圖源:medchemexpress
2023年7月17日,楊森宣布amivantamab治療新診斷EGFR外顯子20插入突變的晚期或轉(zhuǎn)移性NSCLC患者的III期PAPILLON研究結(jié)果饲肪,達(dá)到PFS的主要終點屋犯。該結(jié)果讓武田的莫博賽替尼承受巨大壓力,武田在2023年財報中披露塔苦,莫博賽替尼的一線NSCLC臨床研究未能達(dá)到主要研究終點滑期。
拉澤替尼(Lazertinib)是韓國柳韓洋行(Yuhan)研發(fā)的第三代EGFR酪氨酸激酶抑制劑。2021年1月18日医窖,韓國食品藥品管理局(MFDS)批準(zhǔn)Lazertinib用于既往接受過EGFR-TKI治療的EGFRT790M突變陽性局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌患者的治療账阳。2018年楊森與Yuhan簽署協(xié)議聯(lián)合研發(fā)lazertinib。
原文鏈接

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-10-21
2024-10-21
 88
88

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-10-21
2024-10-21
 79
79

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-10-21
2024-10-21
 90
90