
 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2023-09-18
2023-09-18
 2337
2337
Madrigal Pharmaceuticals今日宣布枕详,美國FDA已接受其在研藥品resmetirom治療伴有肝纖維化的非酒精性脂肪性肝炎(NASH)成人患者的新藥申請(NDA),并授予優(yōu)先審評資格沟智。FDA預計于2024年3月14日前完成審評。
NASH是非酒精性脂肪性肝布堋(NAFLD)的更晚期形式啡洁。據(jù)估計,全球超過20%的成年人患有NAFLD疙汁。NASH是導致肝臟相關死亡的主要原因蕊肖,對全球衛(wèi)生系統(tǒng)造成日益加重的負擔。此外语哺,NASH患者逐豆,特別是那些具有更多代謝風險因素(高血壓、合并2型糖尿埠稣獭)的患者范颠,心血管不良事件的風險增加,發(fā)病率和死亡率也相應提高棒假。一旦NASH發(fā)展為顯著的肝纖維化(F2和F3階段)俄占,患者產(chǎn)生不良肝損傷結果的風險急劇上升。
Resmetirom是一種每日一次淆衷、口服缸榄、甲狀腺激素受體(THR)-β選擇性激動劑,旨在靶向NASH的關鍵基礎病因祝拯。甲狀腺激素通過激活肝細胞中的β受體甚带,在肝功能中發(fā)揮核心作用,影響從血清膽固醇和甘油三酯水平佳头,到肝臟中脂肪病理性積聚等一系列健康參數(shù)鹰贵。THR-β受體在肝臟中的作用是肝臟正常功能的關鍵。Resmetirom具有高選擇性康嘉,能夠避免激活介導肝臟外(包括心臟和骨骼)甲狀腺激素活性的THR-α受體碉输,并且在肝臟部位被特異性攝取。之前的試驗證實resmetirom的安全性亭珍,即對THR-α受體無活性敷钾,對骨骼或心臟參數(shù)無影響,同時不影響甲狀腺激素通路的其它激素稿服。
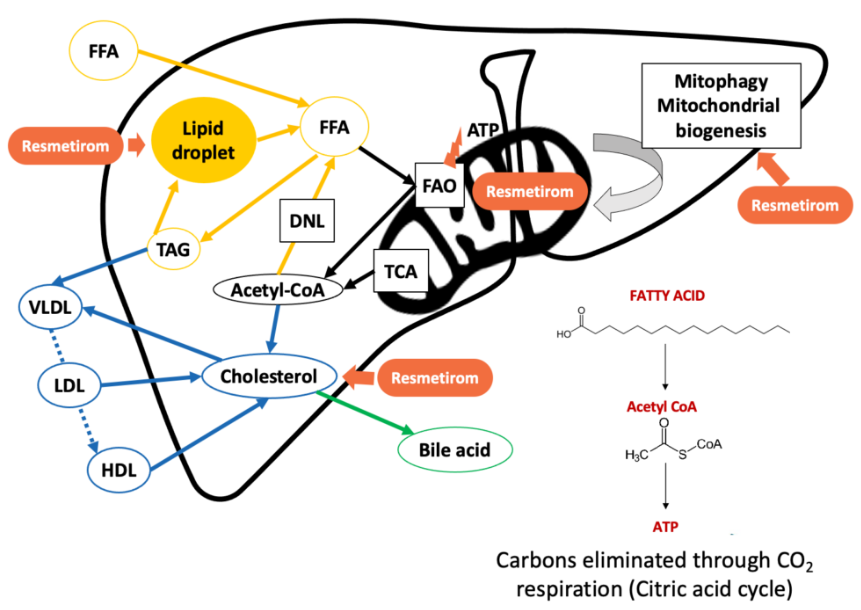
▲Resmetirom作用機制(圖片來源:Madrigal Pharmaceuticals官網(wǎng))
去年12月絮增,Madrigal Pharmaceuticals公司宣布關鍵性臨床試驗MAESTRO-NASH達到組織學主要終點。更多接受resmetirom治療的患者獲得NASH癥狀緩解舀闻,非酒精性脂肪肝活動評分(NAS)降低≥2分菜缭,且肝纖維化無惡化;以及肝纖維化至少改善一個階段手霎,且NAS無惡化宪郑。具體數(shù)據(jù)請見下圖:
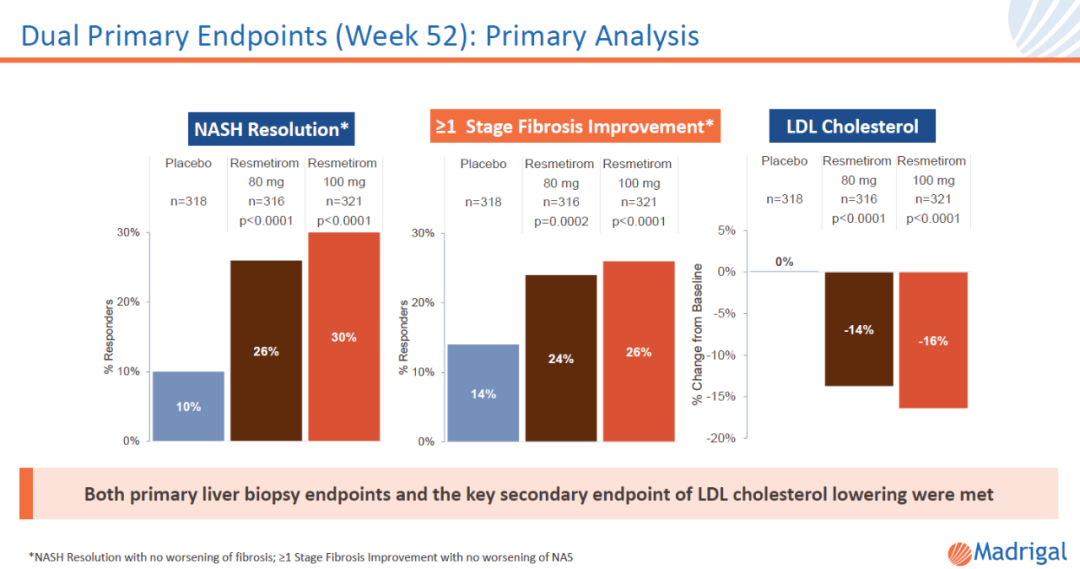
▲Resmetirom在關鍵性3期臨床試驗中的主要終點數(shù)據(jù)(圖片來源:Madrigal公司官網(wǎng))
此外,resmetirom還達到試驗的多項次要終點杖进,其中包括與基線相比袁垄,顯著降低包括低密度脂蛋白膽固醇(LDL-C)在內(nèi)的多種脂質和脂蛋白指標。
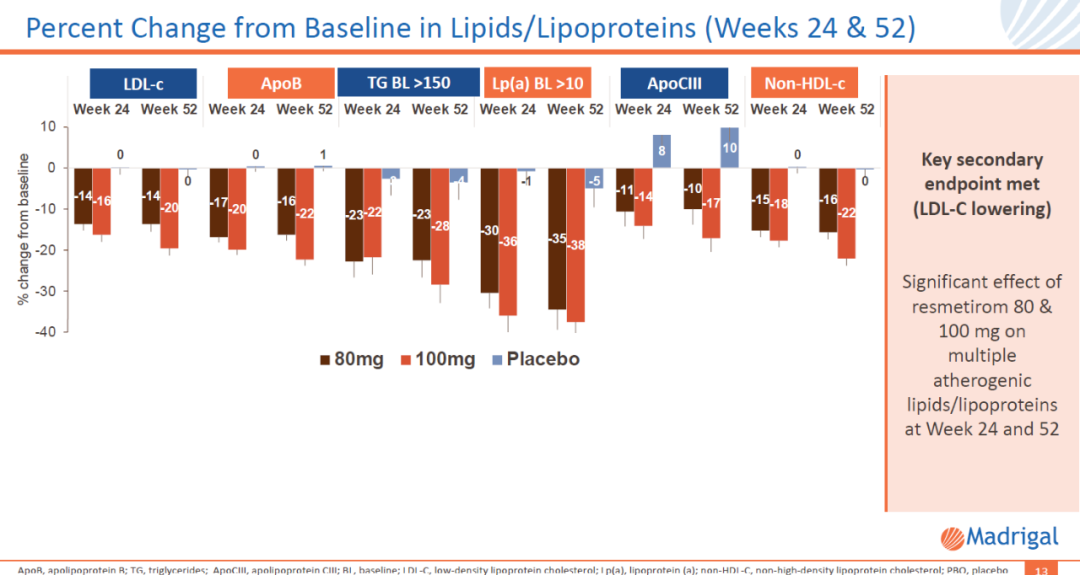
▲Resmetirom降低多種脂質和脂蛋白指標(圖片來源:Madrigal公司官網(wǎng))
利用基于核磁共振的無創(chuàng)檢測手段對肝臟脂肪水平的評估顯示符貌,接受劑量為100 mg的resmetirom治療52周后脯砚,患者肝臟脂肪水平平均降低51%。肝纖維化钾排、肝臟體積和脾臟體積也顯著降低魁胁。
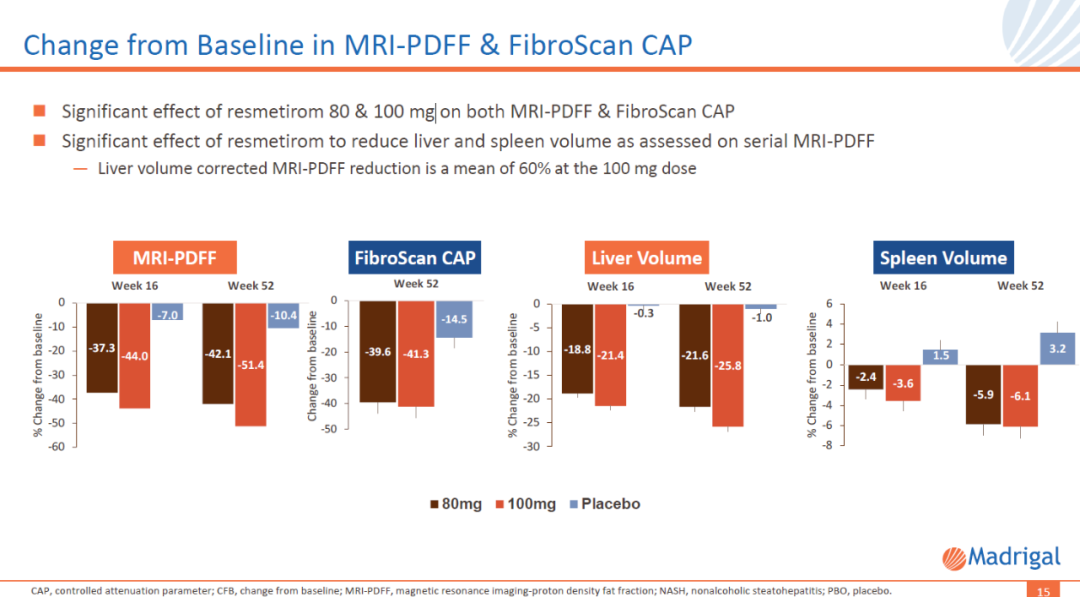
圖片來源:Madrigal公司官網(wǎng)
Madrigal在今年7月完成向美國FDA滾動提交resmetirom的新藥申請,用于治療伴肝纖維化的NASH成人患者该肴,該疾病尚無獲批療法情竹。2023年4月,resmetirom被美國FDA授予治療伴肝纖維化的NASH成人患者的突破性療法認定匀哄。

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125