
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥明康德
藥明康德  2024-05-22
2024-05-22
 398
398
今日,強(qiáng)生(Johnson & Johnson)公布其抗IL-23抗體Tremfya(guselkumab)在QUASAR臨床3期維持研究中绩郎,用于治療中度至重度活動性潰瘍性結(jié)腸炎(UC)患者的首批數(shù)據(jù)。分析顯示翁逞,guselkumab達(dá)到試驗(yàn)主要終點(diǎn)肋杖,可顯著緩解潰瘍性結(jié)腸炎患者的癥狀。強(qiáng)生已在今年3月向美國FDA遞交補(bǔ)充生物制品許可申請(sBLA)熄攘,尋求批準(zhǔn)guselkumab用于治療中重度活動性UC成人患者兽愤。
潰瘍性腸炎是炎癥性腸病(IBD)的一種挪圾,是一種由于大腸慢性炎癥引起的疾病浅萧。由于免疫系統(tǒng)的過度活躍反應(yīng),結(jié)腸內(nèi)壁出現(xiàn)炎癥哲思,并且產(chǎn)生潰瘍版挣,患者癥狀包括持續(xù)腹瀉、腹痛柴羞、便血婆裹、食欲不良、體重減輕和疲憊等稳嘁。癥狀的嚴(yán)重程度和疾病復(fù)發(fā)的不確定性給患者造成了沉重的負(fù)擔(dān)乱险,并經(jīng)常導(dǎo)致殘疾。全球有上百萬人受到潰瘍性結(jié)腸炎的困擾托习。
QUASAR是一項隨機(jī)石检、雙盲、安慰劑對照虏淋、平行組惯斥、多中心的2b/3期試驗(yàn),旨在評估選擇性IL-23抑制劑guselkumab對治療應(yīng)答不足或?qū)ΤR?guī)療法尸查、其他生物制品和/或JAK抑制劑不耐受的中度至重度活動性UC成年患者的療效和安全性病趋。
分析顯示愿凶,guselkumab達(dá)成主要終點(diǎn)。在接受每四周一次皮下注射200毫克guselkumab的中至重度活動性UC患者中存哲,有50.0%達(dá)到了第44周的臨床緩解主要終點(diǎn)(p<0.001)因宇,有45.2%接受每八周一次皮下注射100毫克guselkumab的患者達(dá)到了該終點(diǎn)(p<0.001),此數(shù)值在安慰劑組患者中僅為18.9%祟偷。在對已達(dá)到臨床緩解的患者進(jìn)行的額外分析中羽嫡,分別有67%和71%的患者在第44周還達(dá)到了內(nèi)鏡緩解(即Mayo內(nèi)鏡分?jǐn)?shù)[MES]=0),表明其腸道黏膜外觀正常肩袍。
此外,接受guselkumab治療的兩個隊列均達(dá)到了所有關(guān)鍵次要終點(diǎn)婚惫,與安慰劑相比具有高度統(tǒng)計學(xué)和臨床意義的改善氛赐。44周維持研究的部分次要終點(diǎn)結(jié)果如下表:
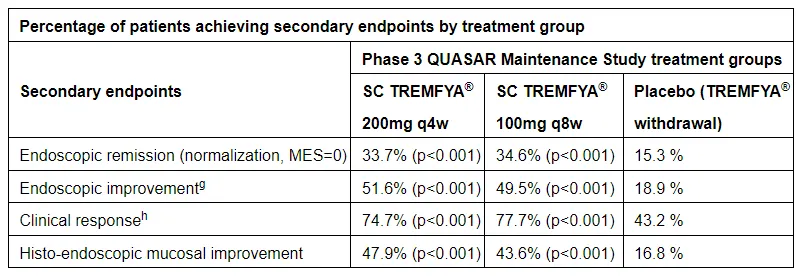
▲Guselkumab試驗(yàn)關(guān)鍵次要終點(diǎn)結(jié)果摘要(圖片來源:參考資料[1])
安全性方面,各治療組中出現(xiàn)一種以上不良事件(AE)的患者比例相似先舷。Guselkumab兩組合并后的安全性數(shù)據(jù)與安慰劑相比艰管,最常見的AE分別為COVID-19(11.2% vs 14.1%)、UC(11.2% vs 29.7%)和關(guān)節(jié)痛(6.1% vs 6.8%)蒋川。安全性結(jié)果與guselkumab在獲批的中度至重度斑塊狀銀屑采蟆(PsO)和活動性銀屑病關(guān)節(jié)炎(PsA)適應(yīng)癥中的安全性特征一致。
Guselkumab是一款通過與IL-23受體的p19亞基結(jié)合倡挚,選擇性抑制IL-23信號傳導(dǎo)的人源化單克隆抗體情庐。目前,guselkumab已在美國蒸拦、加拿大辙资、日本和許多其他國家/地區(qū)獲得批準(zhǔn),用于治療中重度斑塊狀銀屑病蜘把,以及銀屑病關(guān)節(jié)炎癌雷。
開發(fā)潰瘍性結(jié)腸炎的有效療法是許多藥企與生物公司的目標(biāo)。去年10月衅滞,禮來(Eli Lilly and Company)的“first-in-class”單抗Omvoh(mirikizumab)獲美國FDA批準(zhǔn)魄仙,用于治療中重度活動性UC成人患者。新聞稿指出抓惫,這是首個用于治療這一患者群體的IL-23 p19拮抗劑水惑。艾伯維(AbbVie)則在去年8月向美國FDA和歐洲藥品管理局(EMA)遞交其IL-23 p19靶向單抗Skyrizi(risankizumab)用以治療中度至重度UC成人患者的擴(kuò)展適應(yīng)癥申請。此外氛赞,Ventyx Biosciences則在去年10月公布其口服小分子療法VTX002在2期試驗(yàn)中達(dá)到臨床緩解的主要終點(diǎn)再拴,并伴有高比例完全內(nèi)鏡緩解。而Roivant Sciences則在去年6月宣布其潛在“first-in-class”抗TL1A抗體RVT-3101在治療UC患者的2b期臨床試驗(yàn)中取得積極的長期結(jié)果赔癌,獲得內(nèi)鏡改善患者比例在56周時達(dá)到50%诞外。
參考資料:[1] TREMFYA? (guselkumab) QUASAR Maintenance Study in UC met its primary endpoint and all major secondary endpoints, including highly statistically significant rates of endoscopic remission. Retrieved May 20, 2024 from https://www.prnewswire.com/news-releases/tremfya-guselkumab-quasar-maintenance-study-in-uc-met-its-primary-endpoint-and-all-major-secondary-endpoints-including-highly-statistically-significant-rates-of-endoscopic-remission-302150061.html

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍(lán)觀
深藍(lán)觀  2024-11-28
2024-11-28
 69
69

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 72
72

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 74
74
 熱門資訊
熱門資訊