
 研發(fā)追蹤
研發(fā)追蹤
 2015-07-28
2015-07-28
 4313
4313
來源:新康界/金伊??? 2015-7-28
為了掌握美國FDA否決抗腫瘤新分子實體藥物新藥上市申請的原因,美國FDA藥品評審中心的管理人員系統(tǒng)調查了2005年3月17日到2015年3月17日這十年間污筷,向美國FDA提交的抗腫瘤新分子實體藥物新藥上市申請的審批情況辜窑。對美國FDA否決的抗腫瘤新分子實體藥物萝玷,詳細研究了新藥上市申請被拒絕的深層原因奕纫,以期對從事抗腫瘤新分子實體藥物研發(fā)的企業(yè)提供參考莫瞬。
一里状、2005-2015年抗腫瘤新分子實體藥物新藥上市申請被否決概況
2005年3月17日到2015年3月17日這十年間蜘傻,共有15個抗腫瘤新分子實體藥物的新藥上市申請被否決硝荚。根據(jù)新藥上市申請被否決原因的不同赌骏,科研人員將新藥分成兩大類:1)有效性不足的新藥(10個新藥,占全部藥物的67%)焙蹭;2)臨床試驗設計存在缺陷的新藥(5個新藥晒杈,占全部藥物的33%)。 沒有藥物因為安全性問題而未能通過FDA審批孔厉。
表 2005-2015年未通過美國FDA審批抗腫瘤新分子實體藥物上市申請原因統(tǒng)計
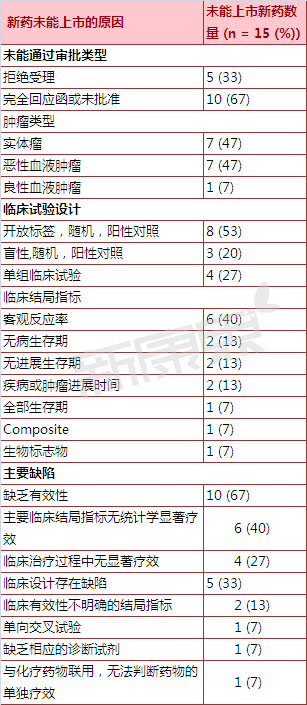
二拯钻、10個抗腫瘤新分子實體藥物的新藥申請因有效性問題而被FDA否決
10個抗腫瘤新分子實體藥物的新藥上市申請因為有效性問題而被FDA否決,其中6個新藥因為主要臨床結局指標無統(tǒng)計學顯著療效而被FDA否決撰豺,因此申請人如果想獲得新藥批準粪般,最好針對亞組的數(shù)據(jù)詳細分析結局指標,如從受試者地理分布污桦、病人特點亩歹、不同治療周期等方面分析結局指標的差異。
另外4個新藥因臨床治療效果不顯著而被FDA否決凡橱。其中2個新藥開展的隨機試驗中小作,盡管治療效果顯著,但是與對照藥物相比優(yōu)勢不明顯。 另外2個新藥開展的單組臨床試驗躲惰,由于提供的客觀緩解率數(shù)據(jù)不足以反映臨床療效因此被FDA否決致份。
三、5個抗腫瘤新分子實體藥物的新藥申請因臨床試驗設計存在缺陷而被FDA否決
5個抗腫瘤新分子實體藥物的新藥申請因臨床試驗設計存在缺陷而被FDA否決驳达,其中2個新藥因采用的臨床結局指標不能很好的反映藥物的治療效果而被FDA否決挣仅;第3個新藥開展的是國際多中心臨床試驗,采用一線治療藥物為對照缆瑟。由于在研究該新藥對不同國家患者的療效時采用的是單向交叉試驗胀司,因此被FDA認為存在臨床設計缺陷而被否決。第4個新藥開展的是單組臨床試驗嫁慌,納入的是腫瘤發(fā)生特定型突變的患者坚达。但是由于在臨床是沒有相應的診斷試劑鑒別遴選出相應的腫瘤患者,因此被FDA否決爆始。第5個新藥開展的是單獨臨床試驗鹦卫,在服用完該藥后患者繼續(xù)開展化學治療,由于不能很好的說明該藥的單獨療效因而被FDA否決门贫。
四沥萄、小結
??? 抗腫瘤新藥的審批總體上來說是一個利益-風險平衡的過程,藥監(jiān)部門需要綜合考慮新藥的安全性數(shù)據(jù)玷秋、有效性數(shù)據(jù)冒窍、腫瘤的發(fā)病率、疾病的危害程度豺鼻、患者可選擇的用藥類型综液、臨床對新治療方法需求的迫切程度等方方面面的因素。對于抗腫瘤新藥研發(fā)公司來說儒飒,了解和掌握藥監(jiān)部門否決相關新藥上市申請的原因谬莹,設計更加合理完善的臨床試驗方案和臨床結局指標,將有助于提高新藥上市申請的批準的可能性桩了。
 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 193
193

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 195
195

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 200
200