
 會員動態(tài)
會員動態(tài)
 信達(dá)生物
信達(dá)生物  2023-08-17
2023-08-17
 2778
2778
2023年8月16日,美國羅克維爾和中國蘇州——信達(dá)生物制藥集團(tuán)(香港聯(lián)交所股票代碼:01801)木锈,一家致力于研發(fā)、生產(chǎn)和銷售腫瘤结款、自身免疫肪才、代謝、眼科等重大疾病領(lǐng)域創(chuàng)新藥物的生物制藥公司昼薯,宣布信必樂?(托萊西單抗注射液网访,抗PCSK9單克隆抗體)獲得國家藥品監(jiān)督管理局(NMPA)批準(zhǔn),用于治療原發(fā)性高膽固醇血癥(包括雜合子型家族性和非家族性高膽固醇血癥)和混合型血脂異常的成人患者彪珠。作為中國首個獲批的本土自主研發(fā)PCSK9抑制劑质法,信必樂?(托萊西單抗注射液)是信達(dá)生物布局心血管疾病領(lǐng)域的首款產(chǎn)品,也是信達(dá)生物成立12年來的第十款產(chǎn)品浸船。截至目前妄迁,信達(dá)生物是中國擁有單克隆抗體產(chǎn)品上市數(shù)量最多的企業(yè)之一。
△ 信達(dá)生物上市產(chǎn)品合照
心血管疾病是威脅人類安全的頭號殺手李命。在我國登淘,心血管疾病流行情況持續(xù)升高,以動脈粥樣硬化性心血管疾卜庾帧(ASCVD)為主的心血管疾病更是高居我國城鄉(xiāng)居民死因第一位形帮,死因構(gòu)成貢獻(xiàn)高達(dá)40%以上。而在心血管疾病的諸多高危因素中周叮,血脂異常是最常見和最危險(xiǎn)的因素之一辩撑。尤其低密度脂蛋白膽固醇(LDL-C)升高被認(rèn)為是驅(qū)動ASCVD發(fā)生和進(jìn)展的主要因素。信必樂?(托萊西單抗注射液)是首個獲批的中國原研全人源抗PCSK9單克隆抗體仿耽,能顯著降低 LDL-C 水平合冀,為我國血脂臨床管理帶來了全新治療選擇。
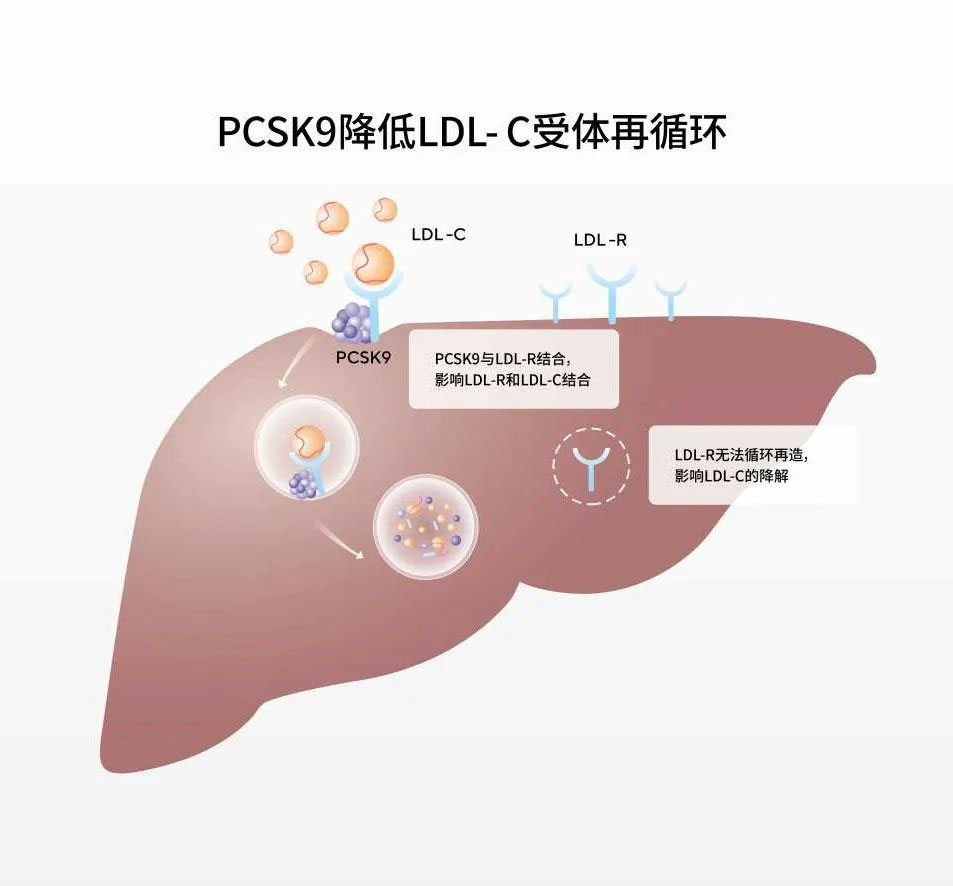
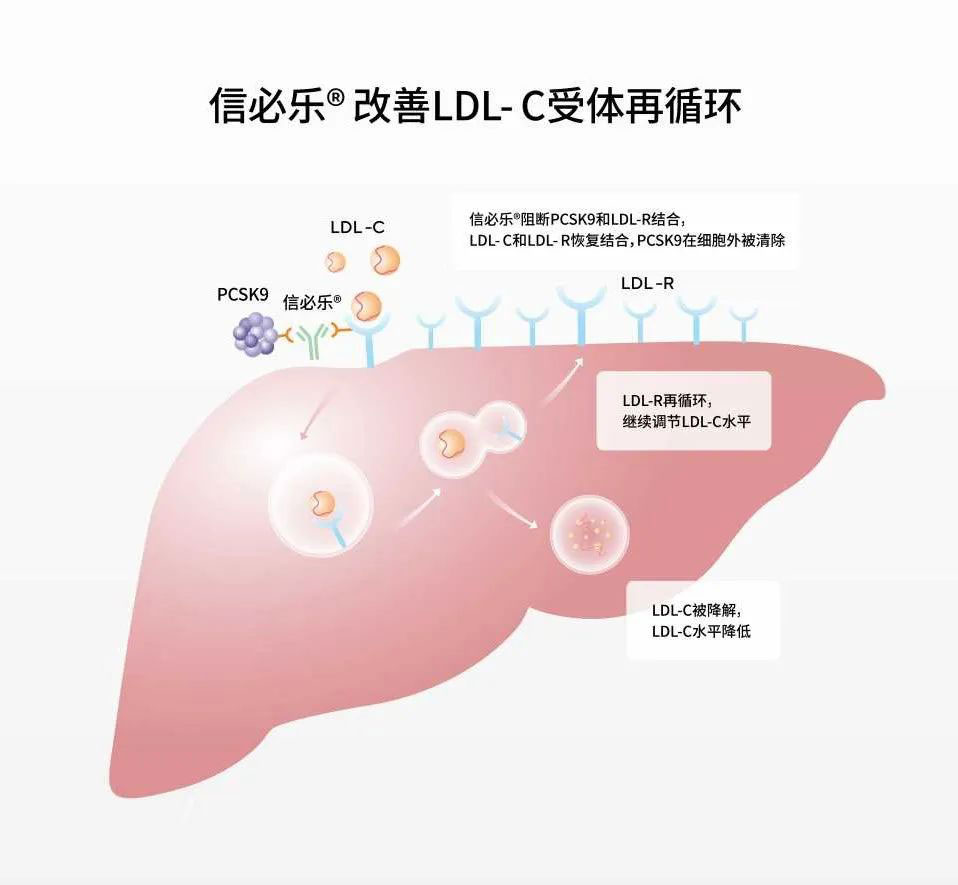
△ 信必樂?作用機(jī)制圖
本次獲批主要是基于三項(xiàng)III期注冊臨床試驗(yàn)(CREDIT-1项贺、CREDIT-2和CREDIT-4)的結(jié)果君躺。信必樂?(托萊西單抗注射液)獲批的給藥方案包括150 mg Q2W、450 mg Q4W和600 mg Q6W开缎,在III期注冊臨床試驗(yàn)中均能有效降低LDL-C痹埠、總膽固醇(TC)、非高密度脂蛋白膽固醇(non-HDL-C)妙帆、載脂蛋白B(ApoB)和脂蛋白a(Lp(a))水平仙尔;多樣的治療方案也將給醫(yī)生和患者提供更多個性化的選擇。
復(fù)旦大學(xué)附屬中山醫(yī)院的葛均波院士表示:“盡管經(jīng)過中國心血管醫(yī)生幾十年的努力兵雪,心血管事件下降的拐點(diǎn)仍然沒有到來编撵,我們亟待更多的有效手段,幫助中國的心血管醫(yī)生及患者管理各種心血管風(fēng)險(xiǎn)晒茁,減少心血管事件發(fā)生易仍,降低國家的心血管疾病負(fù)擔(dān)答海。LDL-C作為導(dǎo)致心血管死亡的重要因素,當(dāng)前的控制現(xiàn)狀依然很不理想绵盔,PCSK9抑制劑在血脂的管理中勢必會扮演重要角色壁万。很高興看到中國第一個原研創(chuàng)新PCSK9抑制劑托萊西單抗的上市,也相信信達(dá)生物這樣一家以‘開發(fā)出老百姓用得起的高質(zhì)量生物藥’為己任的中國生物制藥公司璃璧,能在未來為我們心血管治療領(lǐng)域帶來更多更好的解決方案荔鸵。”
北京大學(xué)第一醫(yī)院的霍勇教授表示:“PCSK9抑制劑是一種新型降膽固醇藥物横朋,能強(qiáng)效降低LDL-C水平且安全性良好仑乌。托萊西單抗在多個注冊III期研究中展現(xiàn)出強(qiáng)大的降脂療效和良好的安全性,與國內(nèi)已上市PCSK9單抗相比琴锭,具有更長的給藥間隔晰甚。盡管目前臨床上已有多種降脂藥物,但中國患者血脂整體達(dá)標(biāo)情況并不盡如人意决帖,相信托萊西單抗能為廣大高膽固醇血癥及混合型血脂異巢蘧牛患者提供更可及和優(yōu)質(zhì)的治療選擇〉鼗兀”
首都醫(yī)科大學(xué)附屬北京安貞醫(yī)院的周玉杰教授表示:“家族性高膽固醇血癥患者發(fā)病年齡早扁远,心血管風(fēng)險(xiǎn)極高,危害巨大刻像。即使經(jīng)中高劑量他汀類藥物和依折麥布聯(lián)合治療畅买,患者的血脂達(dá)標(biāo)率仍極低,亟需強(qiáng)效且安全的降脂藥物细睡。CREDIT-2是在國內(nèi)雜合子型家族性高膽固醇血癥人群中開展的首個隨機(jī)谷羞、雙盲、安慰劑對照的大型臨床研究簿馍,其結(jié)果充分證明了托萊西單抗的療效和安全性脯黎。托萊西單抗成功在國內(nèi)獲批上市,勢必惠及中國雜合子型家族性高膽固醇血癥患者忆帐””
信達(dá)生物制藥集團(tuán)臨床開發(fā)副總裁錢鐳博士表示:“與其他已獲批的PCSK9單抗相比,托萊西單抗有更長給藥間隔的優(yōu)勢梢纫,同時(shí)觀察到脂蛋白a的明顯下降窖硝。作為國內(nèi)首個具有本土自主知識產(chǎn)權(quán)的PCSK9單抗,托萊西單抗的臨床開發(fā)凝聚了國內(nèi)多位心血管領(lǐng)域?qū)<业男难婀沧C明了信達(dá)生物在心血管藥物開發(fā)和臨床開發(fā)領(lǐng)域的實(shí)力起胡,以及監(jiān)管機(jī)構(gòu)對其療效和安全性的認(rèn)可。托萊西單抗的獲批標(biāo)志著信達(dá)生物在心血管及代謝(CVM)領(lǐng)域的前瞻布局開始進(jìn)入收獲期抛伏,信達(dá)生物將秉持著‘開發(fā)出老百姓用得起的高質(zhì)量生物藥’的使命息沐,將為更廣闊的慢病患者提供更多更優(yōu)的治療選擇△⒛啵”
關(guān)于高膽固醇血癥
近年來中國人群的血脂水平逐步升高盛惩,血脂異常患病率明顯增加鹃唯。中國成人血脂異嘲牛總體患病率高達(dá)40.4%。人群血清膽固醇水平的升高將導(dǎo)致2010~2030年期間我國心血管病事件約增加920萬坡慌。以LDL-C或TC升高為特點(diǎn)的血脂異常是動脈粥樣硬化性心血管疾病重要的獨(dú)立危險(xiǎn)因素黔酥。
當(dāng)前,在中國洪橘,高血脂的治療情況不容樂觀跪者。根據(jù)2020年中國心血管健康與疾病報(bào)告,現(xiàn)階段我國成年人血脂異常診斷率熄求、治療率和控制率總體仍處于較低水平渣玲。血脂異常患者LDL-C治療達(dá)標(biāo)率更是不盡理想弟晚。目前的降脂治療不能滿足高血脂領(lǐng)域的臨床需求忘衍。抗PCSK9單克隆抗體作用機(jī)制不同于現(xiàn)有的降脂藥物卿城,能有效降低LDL-C水平枚钓,有望為中國高膽固醇血癥患者提供更優(yōu)的治療選擇。
關(guān)于CREDIT系列關(guān)鍵注冊性臨床研究
CREDIT-1研究是一項(xiàng)評估中國非家族性高膽固醇血癥(高膽固醇血癥合并高危/極高危心血管風(fēng)險(xiǎn))患者應(yīng)用托萊西單抗的療效和安全性的隨機(jī)粟宣、雙盲喳卫、安慰劑對照的III期臨床研究(ClinicalTrials.gov, NCT04289285)。第48周時(shí)盗闯,托萊西單抗450 mg Q4W組和600 mg Q6W組的LDL-C水平較基線的平均百分比變化與相應(yīng)安慰劑組的差值分別為?65.04%(97.5% CI:?70.22%, ?59.86%)蕴嘹,?57.31%(97.5% CI:?63.95%, ?50.68%),P值均<0.0001球灰。兩組LDL-C水平較基線下降50%及以上的患者比例分別為87.8%和71.8%闹只,相應(yīng)的安慰劑組分別為1.0%和2.0%,與相應(yīng)安慰劑組相比的P值均<0.0001迂溉。
CREDIT-2研究是一項(xiàng)評估中國雜合子型家族性高膽固醇血癥受試者應(yīng)用托萊西單抗的療效和安全性的隨機(jī)羡逃、雙盲、安慰劑對照III期臨床研究(ClinicalTrials.gov, NCT04179669)狡舞。第12周時(shí)硬白,托萊西單抗150 mg Q2W組和450 mg Q4W組的LDL-C水平較基線的平均百分比變化與相應(yīng)安慰劑組的差值分別為?57.37%(97.5% CI:?69.21%,?45.54%)和?61.90%(97.5% CI:?73.40%,?50.41%)畴栖,P值均<0.0001随静。兩組LDL-C水平較基線下降50%及以上的患者比例分別為59.6%和75.0%,相應(yīng)的安慰劑組均為0吗讶,與相應(yīng)安慰劑組相比的P值均<0.0001燎猛。
CREDIT-4研究是一項(xiàng)評估中國高膽固醇血癥(包含非家族性高膽固醇血癥和雜合子型家族性高膽固醇血癥)患者應(yīng)用托萊西單抗的療效和安全性的隨機(jī)、雙盲照皆、安慰劑對照的III期臨床研究(ClinicalTrials.gov, NCT04709536)重绷。第12周時(shí),托萊西單抗450 mg Q4W組的LDL-C水平較基線的平均百分比變化與安慰劑組的差值為?63.02%(97.5% CI:?66.48%膜毁,?59.56%)昭卓,P值<0.0001。LDL-C水平較基線下降50%及以上的患者比例為90.5%瘟滨,安慰劑組為2.0%候醒,與安慰劑組相比的P值<0.0001。
在以上3項(xiàng)研究中室奏,均觀察到TC火焰、non-HDL-C、載脂蛋白B和脂蛋白a水平較基線具有臨床意義和統(tǒng)計(jì)學(xué)顯著性的下降胧沫。
一項(xiàng)納入1091例接受托萊西單抗治療的原發(fā)性高膽固醇血癥患者的安全性匯總分析結(jié)果表明塘憨,托萊西單抗雙盲治療階段的不良反應(yīng)包括上呼吸道感染(9.6%)、尿路感染(7.3%)智础、注射部位反應(yīng)(5.7%)士到、關(guān)節(jié)痛(3.1.%)、背痛(2.2%)和鼻咽炎(2.0%)助安。
托萊西單抗的療效和安全性也得到了學(xué)術(shù)界的認(rèn)可辰诱。CREDIT-1研究的主要結(jié)果以大會壁報(bào)的形式發(fā)表于2022年美國心臟協(xié)會年會(AHA)1,研究論文近期將會在同行評議的學(xué)術(shù)期刊發(fā)表莽裤。CREDIT-2研究的主要結(jié)果以大會壁報(bào)的形式發(fā)表于2022年美國心臟病學(xué)會年會(ACC)2拱缆,研究論文發(fā)表于BMC Medicine3。CREDIT-4研究論文已于2023年7月在線發(fā)表于JACC: Asia4店烛。
關(guān)于信必樂?(托萊西單抗注射液)
信必樂?(托萊西單抗注射液)是信達(dá)生物制藥自主研發(fā)的創(chuàng)新生物藥谢奕,IgG2全人源單克隆抗體,能特異性結(jié)合PCSK9 (前蛋白轉(zhuǎn)化酶枯草桿菌蛋白酶/ kexin 9 型) 分子辱甫,通過減少PCSK9介導(dǎo)的低密度脂蛋白受體(LDLR)內(nèi)吞來增加LDLR水平遍送,繼而增加LDL-C清除,降低LDL-C水平店诗。
信必樂?(托萊西單抗注射液)在中國獲批的適應(yīng)癥為裹刮,在控制飲食的基礎(chǔ)上音榜,與他汀類藥物、或者與他汀類藥物及其他降脂療法聯(lián)合用藥捧弃,用于在接受中等劑量或中等劑量以上他汀類藥物治療赠叼,仍無法達(dá)到低密度脂蛋白膽固醇(LDL-C)目標(biāo)的原發(fā)性高膽固醇血癥(包括雜合子型家族性和非家族性高膽固醇血癥)和混合型血脂異常的成人患者,以降低低密度脂蛋白膽固醇(LDL-C)塔橡、總膽固醇(TC)梅割、載脂蛋白B(ApoB)水平霜第。
關(guān)于信達(dá)生物
“始于信葛家,達(dá)于行”,開發(fā)出老百姓用得起的高質(zhì)量生物藥泌类,是信達(dá)生物的理想和目標(biāo)癞谒。信達(dá)生物成立于2011年,致力于開發(fā)刃榨、生產(chǎn)和銷售腫瘤弹砚、自身免疫、代謝寺斟、眼科等重大疾病領(lǐng)域的創(chuàng)新藥物虫棚。2018年10月31日,信達(dá)生物制藥在香港聯(lián)合交易所有限公司主板上市溪胖,股票代碼:01801黔琢。
自成立以來,公司憑借創(chuàng)新成果和國際化的運(yùn)營模式在眾多生物制藥公司中脫穎而出肤不。建立起了一條包括35個新藥品種的產(chǎn)品鏈寻癌,覆蓋腫瘤、自身免疫豌腮、代謝绪封、眼科等多個疾病領(lǐng)域,其中7個品種入選國家“重大新藥創(chuàng)制”專項(xiàng)椰骇。公司已有 10個產(chǎn)品獲得批準(zhǔn)上市历扭,它們分別是信迪利單抗注射液(達(dá)伯舒?),貝伐珠單抗注射液(達(dá)攸同?)膨吼,阿達(dá)木單抗注射液(蘇立信?)棺氢,利妥昔單抗注射液(達(dá)伯華?),佩米替尼片(達(dá)伯坦?)允瞧,奧雷巴替尼片(耐立克?)简软, 雷莫西尤單抗注射液(希冉擇?),塞普替尼膠囊(睿妥?)述暂,伊基奧侖賽注射液(副陨可蘇?)和托萊西單抗注射液(信必樂?)。1個品種在NMPA審評中,6個新藥分子進(jìn)入III期或關(guān)鍵性臨床研究疼蛾,另外還有18個新藥品種已進(jìn)入臨床研究肛跌。
信達(dá)生物已組建了一支具有國際先進(jìn)水平的高端生物藥開發(fā)、產(chǎn)業(yè)化人才團(tuán)隊(duì)察郁,包括眾多海歸專家衍慎,并與禮來、羅氏皮钠、賽諾菲稳捆、Adimab、Incyte和MD Anderson 癌癥中心等國際合作方達(dá)成30項(xiàng)戰(zhàn)略合作麦轰。
信達(dá)生物在不斷自研創(chuàng)新藥物乔夯、謀求自身發(fā)展的同時(shí),秉承經(jīng)濟(jì)建設(shè)以人民為中心的發(fā)展思想潘吸。多年來醇疮,始終心懷科學(xué)善念,堅(jiān)守“以患者為中心”卤撬,心系患者并關(guān)注患者家庭巴移,積極履行社會責(zé)任。公司陸續(xù)發(fā)起柄楼、參與了多項(xiàng)藥品公益援助項(xiàng)目瞭驴,讓越來越多的患者能夠得益于生命科學(xué)的進(jìn)步,用得上殴据、用得起高質(zhì)量的生物藥墙目。至2023年3月,信達(dá)生物患者援助項(xiàng)目已惠及16余萬普通患者又信,藥物捐贈總價(jià)值數(shù)億元胰绢。
信達(dá)生物希望和大家一起努力,提高中國生物制藥產(chǎn)業(yè)的發(fā)展水平抛冗,以滿足百姓用藥可及性和人民對生命健康美好愿望的追求切省。
詳情請?jiān)L問公司網(wǎng)站:www.innoventbio.com或公司領(lǐng)英賬號:Innovent Biologics。
1. Huo Y, Li Y, Zhang P, et al. Efficacy and Safety of Tafolecimab in Chinese Patients With Non-Familial Hypercholesterolemia (CREDIT-1): A 48-Week Randomized, Double-Blind, Placebo-Controlled Phase 3 Trial. Circulation. 2022;146(Suppl_1):10111.
2. Zhou Y, Chai M, He Y, et al. Efficacy and Safety of Tafolecimab in Chinese Patients with Heterozygous Familial Hypercholesterolemia (CREDIT-2): A Randomized, Double-Blind, Placebo-Controlled Phase 3 Trial. ACC. 2022;1188-005/5.
3. Chai M, He Y, Zhao W, et al. Efficacy and safety of tafolecimab in Chinese patients with heterozygous familial hypercholesterolemia: a randomized, double-blind, placebo-controlled phase 3 trial (CREDIT-2). BMC Med. 2023;21(1):77. Published 2023 Feb 28.
4. Qi L, Liu D, Qu Y, et al. Tafolecimab in Chinese Patients With Hypercholesterolemia (CREDIT-4). JACC:

 會員動態(tài)
會員動態(tài)
 信達(dá)生物
信達(dá)生物  2024-09-04
2024-09-04
 39
39

 會員動態(tài)
會員動態(tài)
 中國醫(yī)藥創(chuàng)新促進(jìn)會
中國醫(yī)藥創(chuàng)新促進(jìn)會  2024-08-30
2024-08-30
 92
92

 會員動態(tài)
會員動態(tài)
 中國醫(yī)藥創(chuàng)新促進(jìn)會
中國醫(yī)藥創(chuàng)新促進(jìn)會  2024-08-23
2024-08-23
 97
97
 熱門資訊
熱門資訊