
 會(huì)員動(dòng)態(tài)
會(huì)員動(dòng)態(tài)
 醫(yī)藥觀瀾
醫(yī)藥觀瀾  2024-06-28
2024-06-28
 440
440
中國(guó)國(guó)家藥監(jiān)局藥品審評(píng)中心(CDE)官網(wǎng)近日公示,和黃醫(yī)藥申報(bào)的氫溴酸他澤司他片擬納入優(yōu)先審評(píng)疼尺,擬定適應(yīng)癥為EZH2突變陽(yáng)性且既往接受過(guò)至少兩種系統(tǒng)性治療的復(fù)發(fā)或難治性濾泡性淋巴瘤(FL)成人患者果漾。根據(jù)和黃醫(yī)藥公開資料闯揪,他澤司他是由益普生(Ipsen)旗下公司Epizyme開發(fā)的EZH2甲基轉(zhuǎn)移酶抑制劑裙戏,和黃醫(yī)藥負(fù)責(zé)在中國(guó)大陸尔粮、香港姆打、澳門和臺(tái)灣地區(qū)進(jìn)行他澤司他的研究沧卢、開發(fā)鲫懒、生產(chǎn)以及商業(yè)化嫩实。
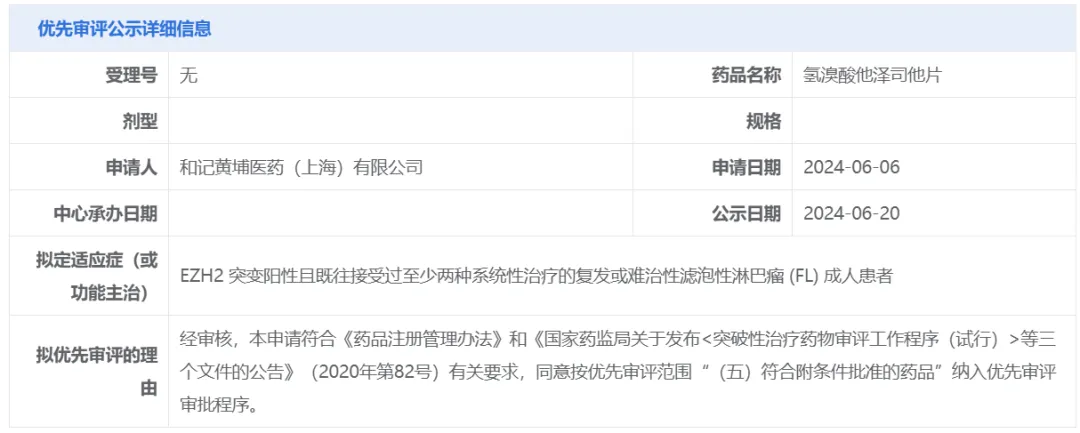
截圖來(lái)源:CDE官網(wǎng)
濾泡性淋巴瘤(FL)是非霍奇金淋巴瘤的一種亞型,約占非霍奇金淋巴瘤的17%。他澤司他是一款“first-in-class”EZH2甲基轉(zhuǎn)移酶抑制劑甲献,它可通過(guò)抑制EZH2進(jìn)而抑制H3K27的甲基化宰缤,恢復(fù)抑癌基因的表達(dá),讓B細(xì)胞繼續(xù)分化或者產(chǎn)生細(xì)胞凋亡晃洒,從而控制腫瘤的生長(zhǎng)慨灭。該藥分別于2020年1月和6月獲美國(guó)FDA加速批準(zhǔn)用于治療晚期上皮樣肉瘤患者和某些復(fù)發(fā)/難治性濾泡性淋巴瘤患者。
2022年5月球及,他澤司他的臨床急需進(jìn)口藥品申請(qǐng)獲海南省衛(wèi)生健康委員會(huì)和海南省藥品監(jiān)督管理局批準(zhǔn)慢夸,于海南博鰲樂城國(guó)際醫(yī)療旅游先行區(qū)使用,用于治療某些上皮樣肉瘤和濾泡性淋巴瘤患者化歪,與FDA已批準(zhǔn)的標(biāo)簽一致咕菱。2023年3月,他澤司他于中國(guó)澳門地區(qū)獲批上市敛档。
2023年9月娶匠,和黃醫(yī)藥宣布他澤司他在中國(guó)的一項(xiàng)橋接研究已完成患者入組,該研究用以支持在美國(guó)獲批的基礎(chǔ)上尋求中國(guó)附條件批準(zhǔn)唠延。該項(xiàng)橋接研究是一項(xiàng)多中心炭答、開放標(biāo)簽的2期臨床試驗(yàn),研究的主要目標(biāo)是評(píng)估他澤司他用于治療伴有EZH2突變的復(fù)發(fā)/難治性濾泡性淋巴瘤患者(隊(duì)列一)的客觀緩解率(ORR)袜簇;其他次要目標(biāo)是評(píng)估他澤司他用于治療伴有或不伴有EZH2突變的復(fù)發(fā)/難治性濾泡性淋巴瘤患者(隊(duì)列二)的緩解持續(xù)時(shí)間(DoR)匾颁、無(wú)進(jìn)展生存期(PFS)及總生存期(OS),并評(píng)估安全性和藥代動(dòng)力學(xué)枷量。
此外帮观,和黃醫(yī)藥還正在參與益普生的SYMPHONY-1研究,并領(lǐng)導(dǎo)在中國(guó)進(jìn)行的研究桃熄。在既往接受過(guò)至少兩種治療后復(fù)發(fā)或難治性濾泡性淋巴瘤患者中開展的SYMPHONY-1全球1b/3期研究的1b期部分已經(jīng)公布了令人鼓舞的數(shù)據(jù):ORR為90.9%先口;在使用3期臨床試驗(yàn)推薦劑量的隊(duì)列中,18個(gè)月的PFS和DoR估計(jì)分別為94.4%和100%瞳收,并且未出現(xiàn)劑量限制性毒性碉京。
參考資料:
[1]中國(guó)國(guó)家藥監(jiān)局藥品審評(píng)中心(CDE)官網(wǎng). Retrieved June 20,2024, From https://www.cde.org.cn/main/xxgk/listpage/9f9c74c73e0f8f56a8bfbc646055026d
[2]和黃醫(yī)藥公布2023年全年業(yè)績(jī)及最新業(yè)務(wù)進(jìn)展. Retrieved Feb 28螟深,2024, From https://mp.weixin.qq.com/s/3nAreiu7pYcHlxFjkZHMMg
[3]和黃醫(yī)藥完成他澤司他用于治療復(fù)發(fā)/難治性濾泡性淋巴瘤患者的中國(guó)橋接研究患者入組. Retrieved Sep 12谐宙,2023, From https://mp.weixin.qq.com/s/nYCULKqQsYMojKJPpSUzeQ

 會(huì)員動(dòng)態(tài)
會(huì)員動(dòng)態(tài)
 信達(dá)生物
信達(dá)生物  2024-09-04
2024-09-04
 38
38

 會(huì)員動(dòng)態(tài)
會(huì)員動(dòng)態(tài)
 中國(guó)醫(yī)藥創(chuàng)新促進(jìn)會(huì)
中國(guó)醫(yī)藥創(chuàng)新促進(jìn)會(huì)  2024-08-30
2024-08-30
 92
92

 會(huì)員動(dòng)態(tài)
會(huì)員動(dòng)態(tài)
 中國(guó)醫(yī)藥創(chuàng)新促進(jìn)會(huì)
中國(guó)醫(yī)藥創(chuàng)新促進(jìn)會(huì)  2024-08-23
2024-08-23
 97
97
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽