
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 Insight數(shù)據(jù)庫
Insight數(shù)據(jù)庫  2024-07-12
2024-07-12
 574
574
2024 年悄然過半,據(jù) Insight 數(shù)據(jù)庫顯示专钉,上半年國內(nèi)獲批上市的新藥共有 87 款(不含改良新藥诗宣,包括新適應癥獲批)涨醋。展望 2024 年下半年龟虎,NMPA 又將批準多少款新藥呢砸狞?
為了回答上述問題蒿荤,Insight 數(shù)據(jù)庫基于當前上市申請中的新藥項目和平均審評時長否癣,預測了下半年有望獲批的創(chuàng)新藥物,數(shù)據(jù)顯示共計 56 款勤焕,其適應癥涵蓋腫瘤學脾膨、皮膚病學、內(nèi)分泌學和消化病學等多個領域〈裕現(xiàn)從中選出 10 款進行解讀幔嫂。
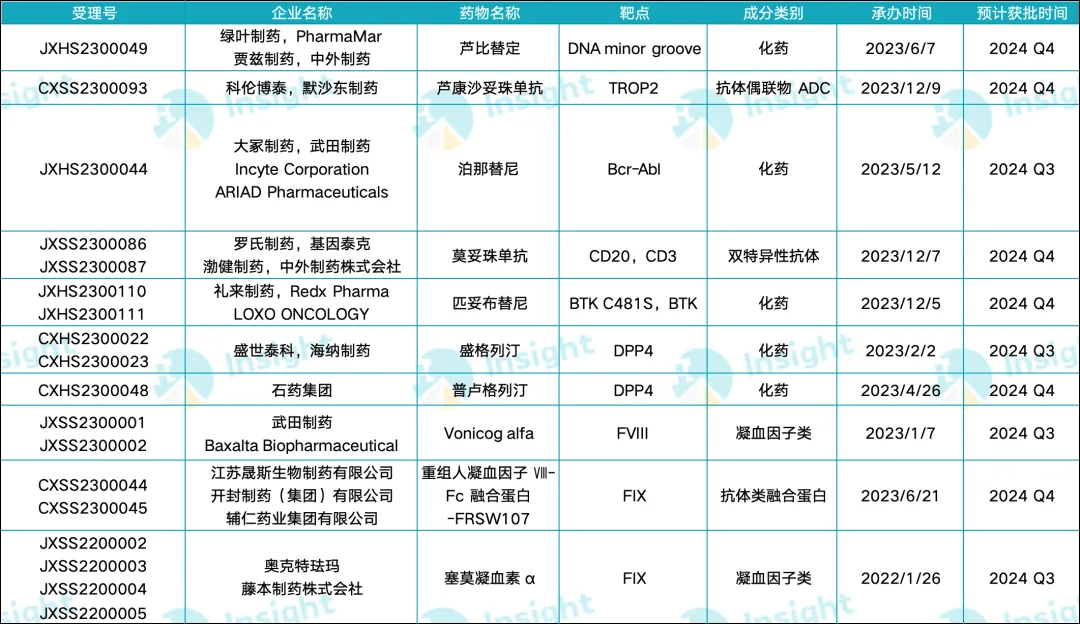
來自:Insight 整理
綠葉制藥:蘆比替定
2023 年 6 月,綠葉制藥宣布其注射用蘆比替定針對小細胞肺癌(SCLC)的適應癥在國內(nèi)申報上市(受理號:JXHS2300049)誊薄。

早在 2020 年 6 月履恩,蘆比替定就獲得 FDA 附條件批準,用于治療接受鉑類藥物化療期間或期后出現(xiàn)疾病進展的 SCLC 成人患者呢蔫;2023 年 3 月切心,蘆比替定擬納入優(yōu)先審評品種,進一步加速其上市進程片吊。
蘆比替定是一種源自海鞘素的化合物绽昏,通過與 DNA 小溝中的鳥嘌呤殘基結(jié)合,引發(fā) DNA 斷裂并誘導細胞凋亡俏脊。此外全谤,蘆比替定還能夠引起 RNA 聚合酶 II 的降解、抑制腫瘤血管生成爷贫,并調(diào)控腫瘤微環(huán)境认然,從而展現(xiàn)出多方面的抗腫瘤作用。
單藥治療方面惯篇,蘆比替定在中國 SCLC 患者中的 IRC 評估的 ORR 為 45.5%反俱,耐藥復發(fā)患者的 ORR 超過 30%。聯(lián)合治療方面辱囤,2024 ASCO 年會披露的 Ⅱ 期擴展研究結(jié)果顯示攘宗,蘆比替定與伊立替康聯(lián)用在 SCLC 患者中具有良好的抗腫瘤活性和可控的安全性,尤其是對于 CTFI 超過 30 天的亞組人群拌九。
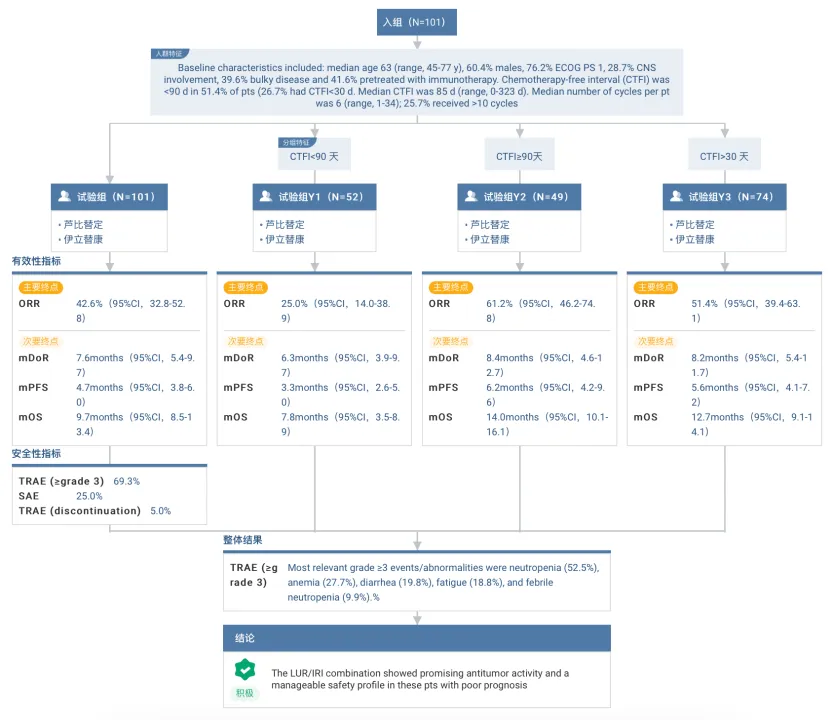
截圖來自:Insight 數(shù)據(jù)庫官網(wǎng)
據(jù)悉,蘆比替定最初由 PharmaMar 進行開發(fā)吻蟹,2019 年 4 月綠葉制藥獲得該藥物在中國開發(fā)及商業(yè)化的獨家權(quán)利恐丧。
蘆比替定醫(yī)藥交易
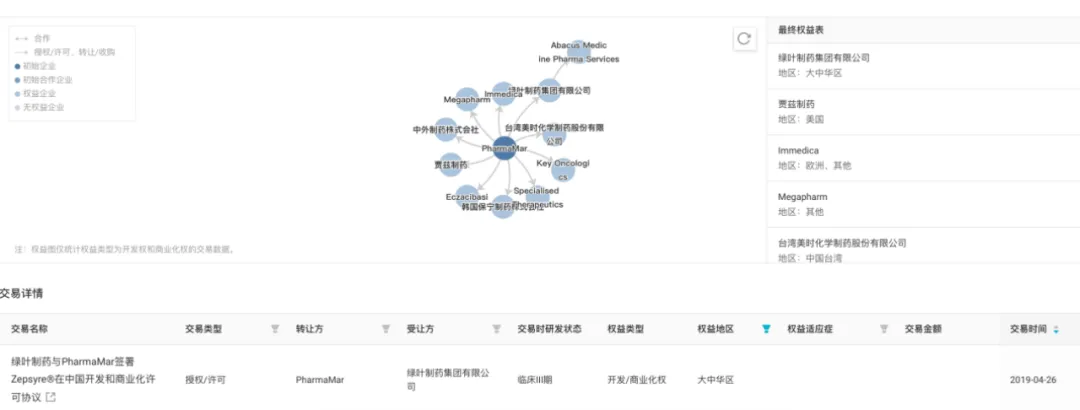
截圖來自:Insight 數(shù)據(jù)庫官網(wǎng)
科倫博泰:蘆康沙妥珠單抗
在乳腺癌領域瀑乡,科倫博泰于 2023 年 12 月申報上市的蘆康沙妥珠單抗預計在今年第四季度獲批(受理號:CXSS2300093)。

TROP2 在三陰性乳腺癌中呈現(xiàn)顯著高表達晚沙,當前針對 TROP2 靶點的藥物研發(fā)主要集中在抗體藥物偶聯(lián)物(ADC)領域橙挽。蘆康沙妥珠單抗是由默沙東與科倫博泰聯(lián)合開發(fā)的 TROP2 ADC,它在今年 3 月獲得 NMPA 授予的第四項突破性療法認定喝赎,適應癥為一線治療不可手術(shù)切除的局部晚期冶驴、復發(fā)或轉(zhuǎn)移性 PD-L1 陰性三陰性乳腺癌。
在 ASCO 2024 年會上田炭,蘆康沙妥珠單抗帶來了針對三陰性乳腺癌的 OptiTROP-Breast01 和針對 SCLC 的 OptiTROP-Lung01 的研究成果师抄。
OptiTROP-Breast01 研究顯示,蘆康沙妥珠單抗組相較于化療組在 mPFS(5.7 個月vs 2.3 個月)教硫、6 個月 PFS 率(43.4% vs 11.1%)以及 ORR(43.8% vs 12.8%)等各項指標上均表現(xiàn)出顯著優(yōu)勢叨吮。尤其是在 TROP2 H 評分>200 的亞組患者中,蘆康沙妥珠單抗組的 mPFS 為 5.8 個月瞬矩,化療組為 1.9 個月茶鉴。安全性方面,該藥物與 Ⅰ 期景用、Ⅱ 期研究表現(xiàn)一致涵叮,無新的安全事件發(fā)生。
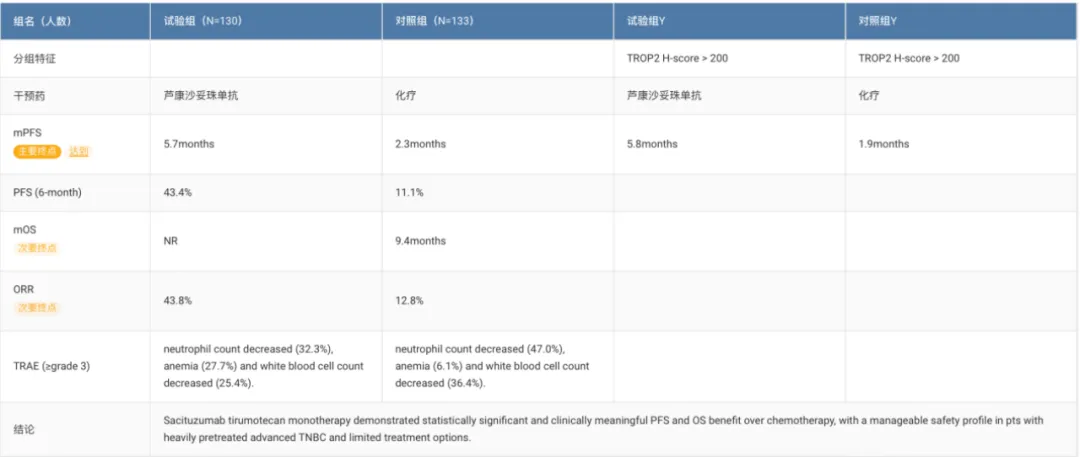
截圖來自:Insight 數(shù)據(jù)庫官網(wǎng)
在 OptiTROP-Lung01 研究中伞插,患者接受蘆康沙妥珠單抗與 KL-A167 兩種不同劑量組合治療割粮。隊列 1A 的 ORR 為 48.6%,DCR 為 94.6%蜂怎,mPFS 為 15.4 個月(6.7穆刻,NE),6 個月 PFS 率為 69.2%登彪。隊列 1B 的 ORR 達 77.6%籍勘,DCR 為 100%,mPFS 未達到(8.4标狼,NE)挤胃,6 個月 PFS 率為 84.6%。安全性方面纠徘,未觀察到新的安全性信號君博。

截圖來自:Insight 數(shù)據(jù)庫官網(wǎng)
總體來看,蘆康沙妥珠單抗在今年 ASCO 年會的突出表現(xiàn)暴雕,無疑將進一步推動其臨床應用慧贩。作為科倫博泰的核心產(chǎn)品,蘆康沙妥珠單抗不僅在乳腺癌和肺癌中顯示出潛力豫鞭,其通過默沙東推進的全球三期臨床試驗還覆蓋了子宮內(nèi)膜癌抡悼、胃癌等多個瘤種卿俺,展現(xiàn)出廣闊的應用前景。
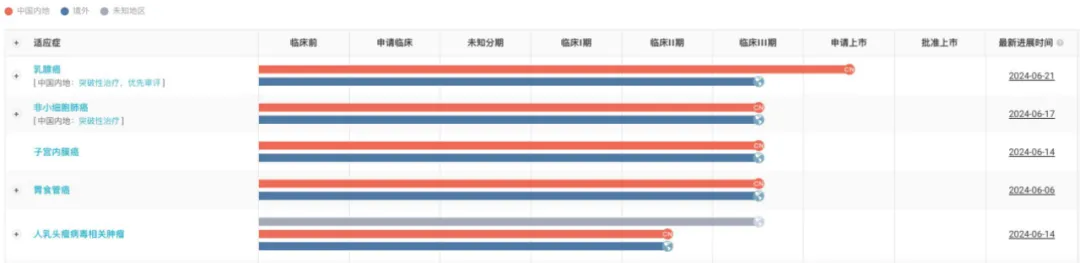
截圖來自:Insight 數(shù)據(jù)庫官網(wǎng)
大冢制藥:第三代 Bcr-Abl 激酶抑制劑
2023 年 5 月篮烈,大冢制藥第三代 Bcr-Abl 激酶抑制劑泊那替尼在國內(nèi)申報上市(受理號:JXHS2300044)颜说,有望于今年下半年獲批。

今年 4 月汰聋,該產(chǎn)品就被 CDE 納入優(yōu)先審評门粪,擬定適應癥涵蓋三個領域:1)對前期治療產(chǎn)生耐藥或不耐受的慢性髓性白血病(CML)烹困;2)復發(fā)或難治性費城染色體陽性急性淋巴細胞白血残琛(Ph+ALL);3)攜帶 T315I 突變的 CML 或 Ph+ALL韭邓。
目前措近,泊那替尼多個三期臨床研究成果在國際學術(shù)大會上引起廣泛關(guān)注。在 2024 年 ASCO 年會上公布的 OPTIC 研究數(shù)據(jù)表明女淑,對于攜帶 T315I 突變的 CML 患者瞭郑,泊那替尼表現(xiàn)出顯著的長期療效及可控的安全性。在該研究中鸭你,采用 45 mg 的起始劑量屈张,并在達到 BCR::ABL1 IS ≤ 1% 后將劑量降至 15 mg。這一劑量調(diào)整策略在療效與安全性之間提供了最佳平衡袱巨。
在 2024 年 EHA 年會上公布的 PhALLCON 研究結(jié)果顯示讽益,泊那替尼聯(lián)合低強度化療作為 Ph+ ALL 患者的一線治療方案,其療效優(yōu)于標準治療方案伊馬替尼遥喘。研究表明泞叉,在監(jiān)測期間的任何時間點,泊那替尼在不同年齡亞組和 BCR::ABL1 突變亞組中均實現(xiàn)了更高的 MRD 陰性率纯殖。各亞組中嫡决,泊那替尼組的 PFS 是伊馬替尼組的兩倍,同時其安全性與伊馬替尼相當动荚。
不僅如此坷疙,泊那替尼作為 Ph+ ALL 一線治療的 III 期臨床研究已經(jīng)完成,顯示泊那替尼聯(lián)合降低強度化療方案的療效顯著優(yōu)于伊馬替尼悉通。
泊那替尼臨床試驗結(jié)果
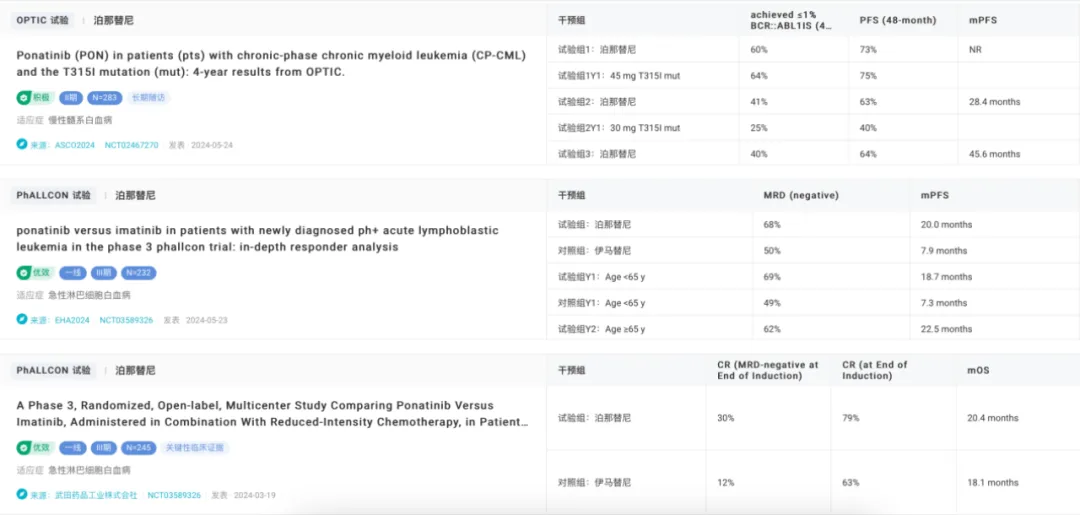
截圖來自:Insight 數(shù)據(jù)庫官網(wǎng)
非霍奇金淋巴瘤亞型:羅氏與禮來均有突破
非霍奇金淋巴瘤(NHL)涵蓋眾多亞型涕肪,每種亞型具有獨特的病理特征、遺傳標志和臨床表現(xiàn)滤填。
在這一領域锌烫,羅氏第二款 CD20/CD3 雙特異性抗體莫妥珠單抗和禮來可逆性 BTK 抑制劑匹妥布替尼分別針對不同的 NHL 亞型。前者主要用于治療濾泡性淋巴瘤,后者則用于治療套細胞淋巴瘤瓣颅。這兩款藥物均在 2023 年 12 月申請上市倦逐,預計在今年下半年獲批。
羅氏·莫妥珠單抗
莫妥珠單抗是一款 CD20/CD3 T 細胞銜接雙特異性抗體宫补,旨在靶向 B 細胞表面的 CD20 和 T 細胞表面的 CD3。這種雙重靶向策略能激活并重新定向患者的 T 細胞曾我,通過釋放細胞毒性蛋白來清除惡性 B 細胞粉怕。
在關(guān)鍵 II 期研究的 3 年隨訪中,莫妥珠單抗顯示出較高 CR 率和長久的臨床療效抒巢。中位隨訪 37.4 個月后贫贝,患者的 CR 率達到 60%,其安全性概況可控蛉谜,并與先前報告一致稚晚。在治療結(jié)束后中位 18 個月,有證據(jù)顯示 B 細胞得到恢復型诚。目前客燕,歐盟委員會和 FDA 已批準該藥物上市,用于治既往接受過至少兩種系統(tǒng)性治療的復發(fā)或難治性濾泡性淋巴瘤狰贯。

截圖來自:Insight 數(shù)據(jù)庫官網(wǎng)
在淋巴瘤領域张鸟,羅氏還基于 CD20 和 CD3 兩個成熟靶點的組合推出了格菲妥單抗。該藥物于 2023 年 11 月獲得 NMPA 的附條件批準吼闽,用于治療既往接受過至少兩線系統(tǒng)性治療的復發(fā)或難治性彌漫大 B 細胞淋巴瘤(DLBCL)成人患者牌度,這也是國內(nèi)獲批的首款 CD3/CD20 雙抗。
作為雙抗研發(fā)領域的領跑者驱香,羅氏已陸續(xù)布局多個雙抗技術(shù)平臺揖蜒,除以上兩者外,羅氏還有 2 款雙抗藥物獲批上市示奉,分別是治療 A 型血友病的艾美賽珠單抗以及治療糖尿病性黃斑水腫的法瑞西單抗升诡。
禮來·匹妥布替尼
匹妥布替尼屬于口服高選擇性可逆 BTK 抑制劑,對野生型和 C481S 獲得性耐藥突變型 BTK 具有顯著的抑制效果净耍。這一特性使得匹妥布替尼能夠有效解決傳統(tǒng)一代不可逆 BTK 抑制劑面臨的耐藥問題健需。
在 I/II 期 BRUIN 研究中,接受匹妥布替尼治療的 120 例套細胞淋巴瘤患者中有一半實現(xiàn)了客觀緩解嘉警,其中 15 例為完全緩解蕴来。憑借這項關(guān)鍵性臨床證據(jù),匹妥布替尼獲 FDA 加速批準上市拼缝,用于治療既往接受過至少二線系統(tǒng)治療(包括 BTK 抑制劑)的復發(fā)或難治性套細胞淋巴瘤成人患者娱局。自此,它也成為了全球首款獲 FDA 批準的可逆 BTK 抑制劑。
2023 年 12 月衰齐,匹妥布替尼憑借 BRUIN 研究中慢性淋巴細胞白血病或小淋巴細胞淋巴瘤的隊列結(jié)果再次獲 FDA 加速批準擴大適應癥任斋。研究發(fā)現(xiàn),在 108 例接受匹妥布替尼治療的患者中耻涛,0RR 為 72%废酷,mDOR 為 12.2 個月。
匹妥布替尼 BRUIN 研究結(jié)果
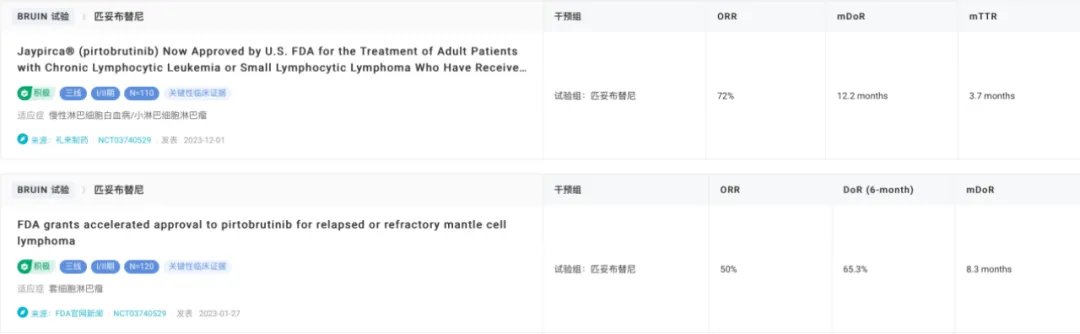
截圖來自:Insight 數(shù)據(jù)庫官網(wǎng)
匹妥布替尼最初由 Redx Pharma 開發(fā)抹缕,并于 2017 年 7 月被 Loxo Oncology 購得澈蟆。在 Loxo Oncology 被禮來收購后,匹妥布替尼被納入禮來研發(fā)產(chǎn)品線卓研。2022 年 3 月趴俘,信達生物在中國獲得了匹妥布替尼商業(yè)化權(quán)益的優(yōu)先談判權(quán)。
2 型糖尿沧嘧浮:兩款 DPP4 抑制劑
DPP-4 抑制劑是治療 2 型糖尿病的重要新藥寥闪。
縱觀當前,我國獲批上市的國產(chǎn) DPP-4 抑制劑有海思科的考格列汀钮药、恒瑞的瑞格列汀以及信立泰的福格列汀椭梁。預計今年下半年將再有兩款獲批,為 2 型糖尿病患者帶來更多選擇氮栏。

盛世泰科·盛格列汀
2023 年 4 月插棱,盛世泰科核心產(chǎn)品盛格列汀上市申請獲受理(受理號:CXHS2300022/3)。
作為新型口服 DPP-4 抑制劑左蛙,盛格列汀具有高選擇性和強效抑制等優(yōu)點肘何。據(jù)盛世泰科官網(wǎng)顯示,該藥物此前已被批準豁免 2 期臨床直接進入 3 期試驗裁甘。
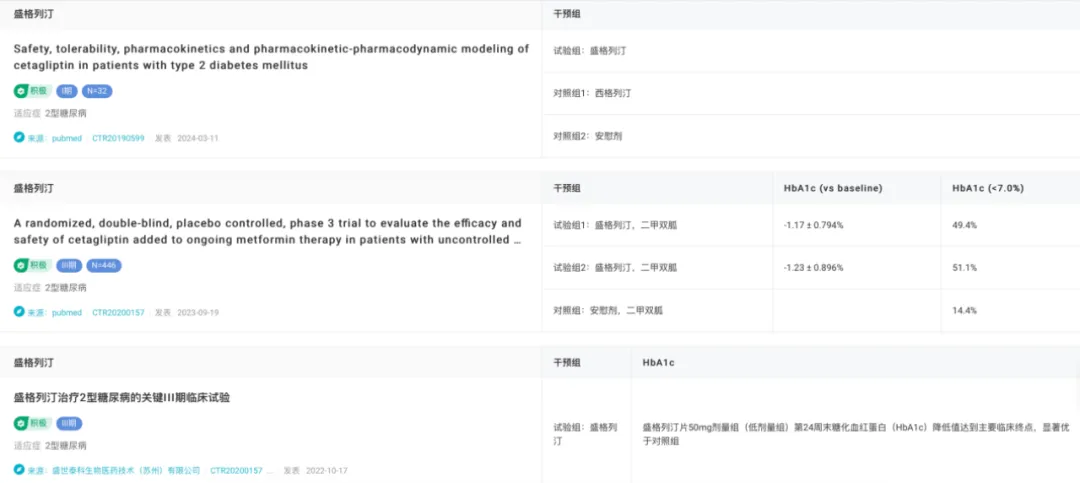
在國內(nèi)艰膀,盛世泰科積極開展多項臨床試驗,包括盛格列汀單藥的 III 期臨床試驗区蛹、盛格列汀聯(lián)合二甲雙胍的 III 期臨床試驗辫田,以及一項利用 PK-PD 模型量化盛格列汀 PK 和 PD 特征的 I 期臨床試驗。
在 III 期臨床試驗中艺挽,治療 24 周后嚎论,低劑量(50 mg)盛格列汀組的 HbA1c 水平顯著降低并達到主要臨床終點,且效果顯著優(yōu)于對照組麦撵。
同時刽肠,盛格列汀聯(lián)合二甲雙胍 III 期試驗結(jié)果顯示,盛格列汀 100 mg 和 50 mg 加二甲雙胍組的 HbA1c 降低值分別為 -1.17 ± 0.794% 和 -1.23 ± 0.896%免胃,兩組間無顯著差異音五,高基線 HbA1c 水平(≥8.5%)的患者降低更顯著。與二甲雙胍單藥治療組(14.4%)相比,有更多的患者在盛格列汀 100 mg(49.4%)和 50 mg(51.1%)加二甲雙胍組實現(xiàn) HbA1c<7.0%躺涝。
在基于 PK-PD 模型的 I 期試驗中厨钻,盛格列汀多次口服后可迅速被吸收,平均半衰期為 34.9-41.9 小時坚嗜,連續(xù)每日給藥 1 周后達到穩(wěn)態(tài)夯膀。盛格列汀 50 mg 劑量的 DPP-4 抑制效果與西格列汀相似,100 mg 劑量的抑制效果更持久苍蔬。此外棍郎,50 mg 和 100 mg 劑量組血漿中活性 GLP-1 分別增加 2.20 倍和 3.36 倍∫遥口服葡萄糖耐量試驗(OGTT)顯示,盛格列汀治療組血糖下降斜曾,胰島素和 C 肽水平增加螺喂,甘油三酯有下降趨勢,而 HbA1c 水平無顯著變化南椒。
盛格列汀臨床試驗結(jié)果
截圖來自:Insight 數(shù)據(jù)庫官網(wǎng)
石藥集團·普盧格列汀
2023 年 7 月范咖,石藥集團 1 類新藥普盧格列汀上市申請獲受理(受理號:CXHS2300048)。
普盧格列汀屬于新型口服 DPP-4 抑制劑呐取,它通過抑制 DPP-4 來提升內(nèi)源性活性 GLP-1 的水平鳄盗。這一作用增強了β細胞和α細胞對葡萄糖的敏感性,從而促進了葡萄糖刺激下的胰島素釋放拂炉,并強化了葡萄糖對胰升糖素的抑制效果送写,進而來降低血糖水平。
當前旱婚,普盧格列汀在單藥以及與二甲雙胍聯(lián)合治療 2 型糖尿病的關(guān)鍵臨床試驗中均成功達到預設的主要療效終點婉劲。單藥治療上,24 周的結(jié)果顯示针执,普盧格列汀在降低 HbA1c 水平方面顯著優(yōu)于安慰劑便锨,其療效不劣于陽性對照組西格列汀。
在聯(lián)合治療的臨床試驗中我碟,普盧格列汀與二甲雙胍的組合治療在 24 周時相較于治療前在降低 HbA1c 水平方面表現(xiàn)出顯著的優(yōu)勢放案。從安全性評估來看,普盧格列汀片的安全性與西格列汀及安慰劑組相似矫俺,顯示出良好的耐受性吱殉。
普盧格列汀臨床試驗結(jié)果

截圖來自:Insight 數(shù)據(jù)庫官網(wǎng)
在今年 3 月發(fā)布的 I 期試驗中,研究人員比較了普盧格列汀在中國輕中度肝功能障礙患者和健康人群中的藥代動力學特性及安全性恳守。結(jié)果顯示考婴,相比于健康受試者,肝功能障礙的受試者中的普盧格列汀藥物暴露水平有所增高。在此期間沥阱,沒有報告任何受試者出現(xiàn)不良事件缎罢。
血友病領域:三家藥企攜手推進新療法
血管性血友病與 A 型血友病雖同屬于血液凝固功能障礙的病癥,但各自的病理機制與臨床表現(xiàn)不同考杉,因此需要實施針對性的治療策略策精。
在血管性血友病領域,武田制藥研發(fā)出重組血管性血友病因子(rVWF)注射用藥物 Vonicog alfa崇棠。同時求旷,晟斯生物和奧克特琺瑪針對 A 型血友病分別研制了重組人凝血因子 Ⅷ-Fc 融合蛋白-FRSW107 和塞莫凝血素 α。這三種新型治療藥物均有望在今年下半年獲批上市燎匪。

武田制藥·Vonicog alfa
Vonicog alfa 借助先進的基因工程技術(shù)生產(chǎn)而成赊手,它包含完整的 VWF 多聚體系列,尤其是具備較長半衰期的超大型多聚體(ULMs)购畴。這一創(chuàng)新配置賦予了該藥物在體內(nèi)的持續(xù)活性猫乃,為血管性血友病患者開辟了更為有效的替代治療途徑。
截至目前铣才,Vonicog alfa 已在美國责祥、加拿大、英國旱樊、瑞士壳坞、澳大利亞和日本獲得上市許可。2023 年 1 月述茂,該產(chǎn)品被 CDE 納入優(yōu)先審評搂瓣,用于診斷為血管性血友病的成人患者,包括按需治療和出血事件的控制朗涩,以及圍手術(shù)期出血管理忽孽。
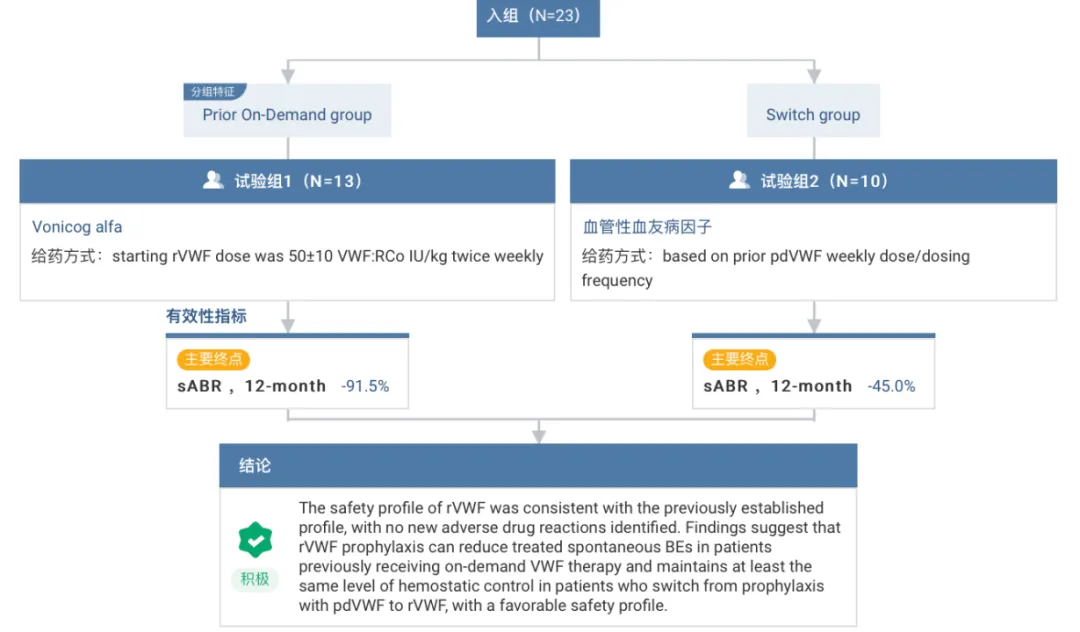
在一項前瞻性、開放式谢床、多中心研究中兄一,研究人員評估了 18 歲及以上重度血管性血友病患者在擇期外科手術(shù)中使用 Vonicog alfa 的止血效果及安全性。結(jié)果顯示识腿,在 15 例手術(shù)中出革,總體止血療效達到 100%。
在另一項三期研究中渡讼,研究人員評估了重度血管性血友病成人在接受 Vonicog alfa 預防治療時骂束,其治療性自發(fā)性出血事件的年化出血率(sABR)與歷史數(shù)據(jù)的對比。研究納入了 23 名患者成箫,分為需求時給藥組和血漿衍生 VWF(pdVWF)預防治療切換組展箱。12 個月的結(jié)果顯示旨枯,需求時給藥組 sABR 下降 91.5%,切換組下降 45.0%混驰。
截圖來自:Insight 數(shù)據(jù)庫官網(wǎng)
晟斯生物·重組人凝血因子Ⅷ-Fc 融合蛋白-FRSW107
晟斯生物推出的 FRSW107 注射用重組人凝血因子 Ⅷ-Fc 融合蛋白是首款國產(chǎn)長效重組凝血八因子新藥攀隔。該藥物利用創(chuàng)新的剛性 linker 技術(shù),首次成功制備具有凝血活性的「同源二聚」結(jié)構(gòu)捣柿,顯著延長了凝血因子的半衰期嚎区,并提高了產(chǎn)品的穩(wěn)定性與產(chǎn)能。
在 2022 年 ASH 年會上公布的一項多中心疚都、開放標簽蝶桑、單臂三期臨床試驗中,共納入了 119 名患者哥笤,其中 83 人接受預防治療窄切,36 人接受按需治療。結(jié)果顯示协悼,預防治療組的年度出血率(ABR)下降了 95.01%巍也,而按需治療組的 ABR 下降了 67.5%。
2024 年 ISTH 年會上公布的該試驗開放標簽延伸研究進一步驗證了 FRSW107 的長效性和療效极胸。在延伸期內(nèi),預防治療組的 ABR 進一步減少至平均 1.5±3.8 次谚碌,表明 FRSW107 在減少出血事件方面表現(xiàn)出顯著效果眯穴,尤其是在預防治療方面。此外广料,按需治療組的 ABR 也有所下降砾脑,平均為 1.2±3.5 次。
FRSW107 臨床試驗結(jié)果

截圖來自:Insight 數(shù)據(jù)庫官網(wǎng)
綜上所述艾杏,F(xiàn)RSW107 不僅在預防治療中表現(xiàn)出顯著的效果韧衣,還在按需治療中顯示出穩(wěn)定的療效,為 A 型血友病患者提供了一種有效的治療選擇购桑。
奧克特琺瑪·塞莫凝血素 α
奧克特琺瑪研發(fā)的塞莫凝血素 α 是針對 A 型血友病的創(chuàng)新藥物畅铭,特別適用于對常規(guī)因子 VIII 產(chǎn)生抗體的患者。該藥物不通過與組織因子(TF)結(jié)合勃蜘,形成 TF-rFVIIa 復合物硕噩,而是替代因子 VIII,激活因子 X(FX)轉(zhuǎn)化為活化因子 Xa(FXa)缭贡,繞過因子 VIII 依賴的凝血途徑炉擅,直接催化凝血酶原轉(zhuǎn)化為凝血酶(FIIa),迅速啟動凝血級聯(lián)反應阳惹,增強纖維蛋白形成谍失,從而快速有效地控制出血眶俩。
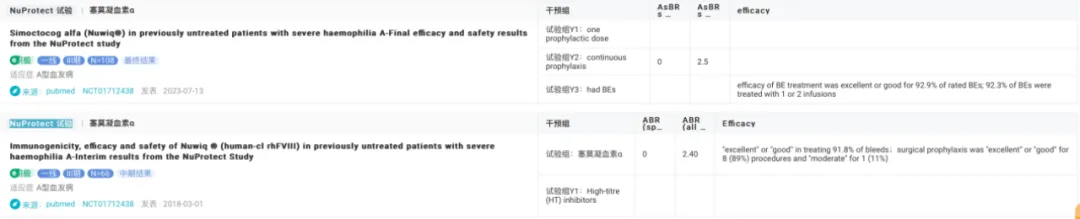
NuProtect 試驗評估了塞莫凝血素 α 在未曾接受治療的嚴重 A 型血友病患者中的免疫原性、療效和安全性铝比。中期結(jié)果顯示荠补,在 66 名初治患者中,8 名發(fā)展出高滴度抑制物妹茬,5 名發(fā)展出低滴度抑制物尚和。在無抑制物期間,患者自發(fā)性出血的中位年化出血率為 0 次泳唇,總出血率為 2.40 次十吐。出血事件治療效果在 91.8% 的病例中被評為「優(yōu)秀」或「良好」,手術(shù)預防效果在 89% 的手術(shù)中被評為「優(yōu)秀」或「良好」夜勋。
最終結(jié)果顯示曼舟,在接受塞莫凝血素 α 治療的 108 名初治患者中,103 名接受了至少一次預防性劑量聚伤,50 名連續(xù)預防治療至少 24 周嗤积。在這些患者中,自發(fā)性出血的中位年化出血率為 0坠天,總出血的中位年化出血率為 2.5夯秃。出血事件治療效果在 92.9% 的評估中被評為「優(yōu)秀」或「良好」,手術(shù)預防效果在 94.7% 的手術(shù)中被評為「優(yōu)秀」或「良好」痢艺。研究期間未發(fā)現(xiàn)安全性問題或血栓事件仓洼,表明塞莫凝血素 α 在嚴重 A 型血友病初治患者中具有顯著療效和良好耐受性。
塞莫凝血素 α 臨床試驗結(jié)果
截圖來自:Insight 數(shù)據(jù)庫官網(wǎng)
除以上提及的 10 款新藥外堤舒,安斯泰來佐妥昔單抗色建、艾伯維 IL-23 抑制劑利生奇珠單抗、阿斯利康抗 IL-5Rα 本瑞利珠單抗以及輝瑞 PARP 抑制劑他拉唑帕利等均有望在今年下半年獲批上市舌缤。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 長風藥業(yè)
長風藥業(yè)  2024-11-27
2024-11-27
 41
41

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 賽柏藍
賽柏藍  2024-11-27
2024-11-27
 45
45

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 碧博生物
碧博生物  2024-11-27
2024-11-27
 44
44