
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 艾美達(dá)醫(yī)藥咨詢
艾美達(dá)醫(yī)藥咨詢  2024-07-12
2024-07-12
 477
477
“iMeta發(fā)布” :
艾美達(dá)醫(yī)藥咨詢團(tuán)隊(duì)聚焦市場動(dòng)態(tài)箕径、剖析行業(yè)痛點(diǎn)伙窃,持續(xù)發(fā)布權(quán)威遂遂、高價(jià)值醫(yī)藥行業(yè)分析報(bào)告吕晌,賦能產(chǎn)業(yè)創(chuàng)新與發(fā)展。
隨著藥品審評(píng)審批制度改革的不斷深化引導(dǎo)醫(yī)藥產(chǎn)業(yè)創(chuàng)新轉(zhuǎn)型升級(jí)斤斧,我國醫(yī)藥創(chuàng)新整體水平已邁入全球第二梯隊(duì)的前列捂刺。站在新的高度下,我國醫(yī)藥創(chuàng)新進(jìn)一步高質(zhì)量發(fā)展面臨新的挑戰(zhàn)囚痴,美歐等發(fā)達(dá)國家逐步聯(lián)合起來試圖以產(chǎn)業(yè)鏈脫鉤的形式對(duì)我國生物醫(yī)藥產(chǎn)業(yè)的進(jìn)一步發(fā)展加以限制出革。
面對(duì)國際新形勢,艾美達(dá)醫(yī)藥咨詢公司在全球生命科學(xué)領(lǐng)域?qū)I(yè)信息平臺(tái)PharmaBoardroom上發(fā)表專欄文章介紹中國醫(yī)藥創(chuàng)新產(chǎn)業(yè)發(fā)展現(xiàn)狀并指出中國在全球醫(yī)藥創(chuàng)新鏈條中的重要作用渡讼,呼吁進(jìn)一步加強(qiáng)醫(yī)藥創(chuàng)新國際合作骂束、共建人類命運(yùn)健康共同體。
以下內(nèi)容節(jié)選自PharmaBoardroom專欄文章成箫,原文可掃描二維碼查看展箱。

中國醫(yī)藥創(chuàng)新政策持續(xù)優(yōu)化
2020年中國藥品監(jiān)督管理局以優(yōu)先審評(píng)、突破性治療蹬昌、附條件批準(zhǔn)等方式對(duì)創(chuàng)新藥搭建起完善的加速審評(píng)通道混驰,創(chuàng)新藥的審評(píng)效率得以大幅度提升,為創(chuàng)新藥研發(fā)加速提供助推劑皂贩。2022年各類別藥品注冊申請整體按時(shí)限審結(jié)率達(dá)到99.80%捣柿,其中NDA注冊審評(píng)和臨床急需境外新藥的按時(shí)限審結(jié)率分別為98.59%與100%。
在國際視角下拘挡,中國與美國的審評(píng)審批效率同樣逐步接近疚都。對(duì)近6年中美雙報(bào)(在中國NDA時(shí),尚未獲得FDA批準(zhǔn))獲批產(chǎn)品的審評(píng)時(shí)間(自然日掌社,批準(zhǔn)時(shí)間-NDA時(shí)間)進(jìn)行統(tǒng)計(jì)哥笤,盡管中國的審評(píng)時(shí)間長于美國,但平均時(shí)間差在逐步縮小簇茉,近兩年批準(zhǔn)產(chǎn)品的審評(píng)審批平均時(shí)間差在100個(gè)自然日左右协悼。
圖1 中美雙報(bào)上市藥品的審評(píng)審批時(shí)間差(單位:天)(以中國NDA年份統(tǒng)計(jì))
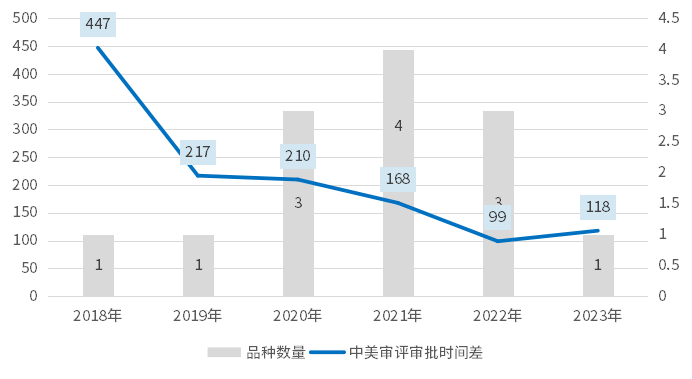
備注:以申報(bào)上市至獲批的時(shí)間記為審評(píng)審批時(shí)間;時(shí)間差為同一藥物“CDE審評(píng)審批時(shí)間-FDA審評(píng)審批時(shí)間”
數(shù)據(jù)來源:CDE與FDA官網(wǎng)哈寂、藥渡數(shù)據(jù)庫残昔、艾美達(dá)統(tǒng)計(jì)
中國醫(yī)藥創(chuàng)新能力位于世界前列
據(jù)IQVIA統(tǒng)計(jì)中國醫(yī)藥企業(yè)研發(fā)管線貢獻(xiàn)率從2013年的4%增長至2023年已經(jīng)達(dá)到28%,中國的醫(yī)藥企業(yè)研發(fā)全球貢獻(xiàn)率已經(jīng)超越歐洲佑茴,僅次于美國物即。
圖2 2008-2023年各國新藥研發(fā)管線數(shù)量占比變化(以企業(yè)總部所在國統(tǒng)計(jì))
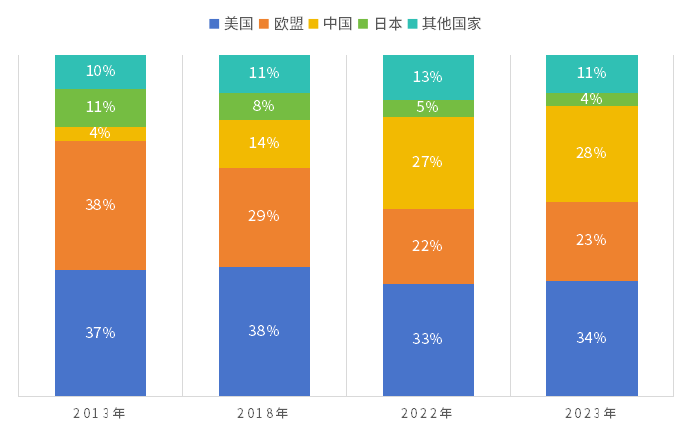
數(shù)據(jù)來源:IQVIA、艾美達(dá)統(tǒng)計(jì)
在研發(fā)規(guī)模飛速增長的同時(shí)广料,中國創(chuàng)新研發(fā)質(zhì)量同樣經(jīng)受住考驗(yàn)砾脑。2022年國家藥品監(jiān)督管理局審查核驗(yàn)中心完成注冊類新藥臨床試驗(yàn)核查任務(wù)215個(gè)幼驶,通過率為99.07%。在國際范圍內(nèi)韧衣,中國新藥研發(fā)質(zhì)量同樣值得信賴盅藻。對(duì)2022年至今FDA展開的核查進(jìn)行統(tǒng)計(jì),中國在生產(chǎn)核查和臨床核查方面通過率均高于美國畅铭。
圖3 2022年-2024年5月FDA對(duì)中美企業(yè)核查通過率對(duì)比
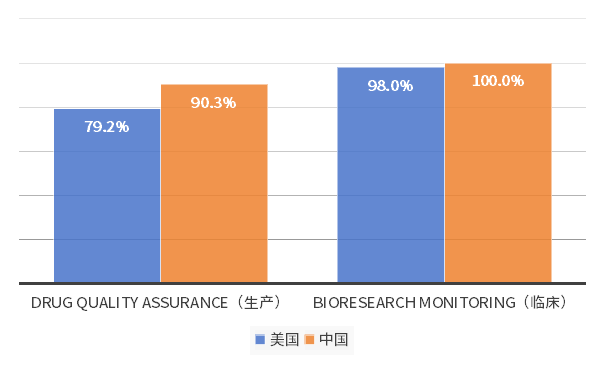
數(shù)據(jù)來源:FDA官網(wǎng)氏淑、艾美達(dá)統(tǒng)計(jì)
合作共贏,中國是全球創(chuàng)新不可或缺的一部分
隨著科學(xué)技術(shù)的不斷發(fā)展硕噩,學(xué)科之間的交叉融合以及疾病病理的廣泛認(rèn)知假残,醫(yī)藥創(chuàng)新的“低垂果實(shí)”逐漸被采摘殆盡,新藥研發(fā)的難度和風(fēng)險(xiǎn)進(jìn)一步增加炉擅。據(jù)統(tǒng)計(jì)全球臨床開發(fā)成功率在逐步降低辉懒,2022年綜合成功率降至6.3%。新藥研發(fā)成功率的降低疊加研發(fā)周期逐漸延長谍失,導(dǎo)致全球新藥研發(fā)的投入產(chǎn)出比越來越低眶俩。如何通過合作進(jìn)一步提升研發(fā)效率已經(jīng)成為全球醫(yī)藥企業(yè)共同面臨的問題。
圖4 全球范圍內(nèi)不同階段臨床開發(fā)成功率
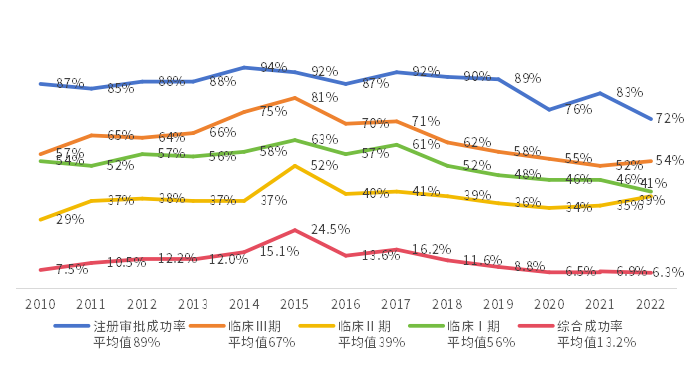
數(shù)據(jù)來源:IQVIA《Global Trends in R&D 2023》
醫(yī)藥創(chuàng)新是一個(gè)典型的由“邊緣革命”驅(qū)動(dòng)的產(chǎn)業(yè)铝比,新技術(shù)荠补、新靶點(diǎn),往往都是由Biotech等小型企業(yè)去探索穷筒,而大型MNC往往更愿意“守株待兔”宁线,待Biotech取得研發(fā)進(jìn)展之后,再謀求合作與并購弦撤。然而Biotech企業(yè)往往并不具備孵化一款創(chuàng)新藥的能力僻一,高度依賴于CXO企業(yè)的研發(fā)能力和效率。
隨著中國研發(fā)標(biāo)準(zhǔn)的國際化程度不斷提升夜勋,中國企業(yè)在全球研發(fā)中的合作參與達(dá)到了新的高度曼舟,中國的一眾CXO企業(yè)以優(yōu)質(zhì)的服務(wù)水平和極具競爭力的價(jià)格優(yōu)勢為全球醫(yī)藥創(chuàng)新提供研發(fā)服務(wù)。美國近期推進(jìn)的BIOSECURE法案不僅是對(duì)于中國的CXO行業(yè)的限制聚伤,從長遠(yuǎn)角度來看同樣是對(duì)美國Biotech企業(yè)進(jìn)一步創(chuàng)新的遏制。
同時(shí)在研發(fā)階段的全球合作之外虱怖,藥品市場的互相支撐已經(jīng)成為全球醫(yī)藥產(chǎn)業(yè)發(fā)展不可或缺的一部分坠天。眾多跨國藥企多年深耕中國市場,對(duì)于部分典型MNC企業(yè)座咆,中國市場的營收占比日趨升高痢艺,且營收增速遠(yuǎn)高于其全球營收增速。
圖5 典型MNC企業(yè)2023年中國營收情況
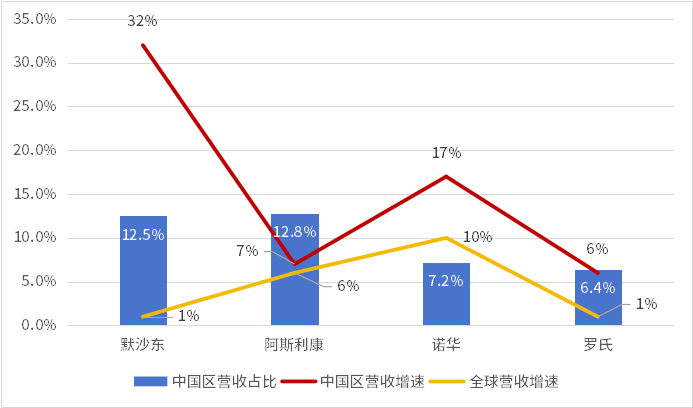
在國家戰(zhàn)略的引導(dǎo)下介陶,中國政府始終致力于推動(dòng)全球醫(yī)藥創(chuàng)新高質(zhì)量發(fā)展堤舒,在滿足國內(nèi)患者日益增長的臨床需求的同時(shí)色建,希望進(jìn)一步承擔(dān)大國責(zé)任,為全球的醫(yī)藥健康產(chǎn)業(yè)作出應(yīng)有貢獻(xiàn)舌缤。中國醫(yī)藥創(chuàng)新發(fā)展成果應(yīng)當(dāng)惠及世界各國箕戳,中國政府、產(chǎn)業(yè)等各方均為此共同努力著国撵。中國長期以來倡導(dǎo)建立更加平等均衡的新型全球發(fā)展伙伴關(guān)系陵吸,同舟共濟(jì),權(quán)責(zé)共擔(dān)介牙,增進(jìn)人類共同利益壮虫。
文章來源:PharmaBoardroom專欄:加強(qiáng)醫(yī)藥創(chuàng)新國際合作、共建人類命運(yùn)健康共同體 丨iMeta發(fā)布

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 長風(fēng)藥業(yè)
長風(fēng)藥業(yè)  2024-11-27
2024-11-27
 39
39

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 賽柏藍(lán)
賽柏藍(lán)  2024-11-27
2024-11-27
 42
42

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 碧博生物
碧博生物  2024-11-27
2024-11-27
 41
41
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽