
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 同寫意
同寫意  2024-07-18
2024-07-18
 321
321
應(yīng)同寫意邀請汗销,美國FDA生物制品評價(jià)和研究中心(CBER)主任Peter Marks在同寫意20周年大會上做了題為《Advancing the Development of Cell and Gene Therapy》的報(bào)告。埃格林醫(yī)藥CEO杜新博士主持了Peter Marks博士的報(bào)告抬吟,并針對中國CGT同行目前切身關(guān)切的幾個(gè)問題與Peter Marks 博士進(jìn)行了實(shí)時(shí)問答。
本文系寫意君根據(jù)大會現(xiàn)場英文演講內(nèi)容進(jìn)行的翻譯和整理统抬。
CGT療法概況
目前火本,共有兩種方式可以遞送基因治療產(chǎn)品。一種是通過改造體外細(xì)胞聪建,再把這些細(xì)胞輸送回人體钙畔,比如嵌合抗原受體T細(xì)胞或者造血干細(xì)胞;另一種方法是直接局部輸注基因治療載體槽悼,如進(jìn)入眼睛或者靜脈埂荤,主要用于Adino相關(guān)病毒載體的方法,這也是目前正在研究的一些直接輸注的CRISPR/cas9產(chǎn)品页梁。
在美國蒿疲,共有19款被批準(zhǔn)的基因療法。
如圖锻刹,深藍(lán)色的字體是針對血液系統(tǒng)惡性腫瘤的CAR-T療法棉玻;綠色的是基因修飾的干細(xì)胞療法,尤其是針對鐮狀細(xì)胞和β肌萎縮癥壕矿,以及一款針對腎上腺皮質(zhì)營養(yǎng)不良代謝疾病的療法坝亿;紫色標(biāo)注的是直接使用的基因療法。隨著技術(shù)的進(jìn)步李荚,分組還在繼續(xù)灰囤。

雖然我們一直在基因療法領(lǐng)域有所進(jìn)展,但進(jìn)展可能沒有我們希望的那么快鸥层。
基因編輯已經(jīng)成為基因治療的一種主要方式锐拟,并以ZFNs、TALENs的形式存在了幾十年慧邮。但這些基因編輯的方式效率非常低调限,無法有效生產(chǎn)產(chǎn)品。而CRISPR/cas9技術(shù)的發(fā)現(xiàn)误澳,使得以其為基礎(chǔ)的基因編輯工具到達(dá)了一個(gè)新高度耻矮。
事實(shí)上,在CRISPR/cas9技術(shù)面世大概10年后忆谓,就在去年誕生了首個(gè)基于CRIPSR/Cas9基因編輯技術(shù)的基因療法Casgevy裆装,這是一個(gè)里程碑。這個(gè)產(chǎn)品是用第一代CRISPR制成的倡缠,可以切斷兩條鏈哨免,存在一定的問題,不過新的CRISPR結(jié)構(gòu)不會切斷兩條鏈昙沦,具有一定優(yōu)勢琢唾。
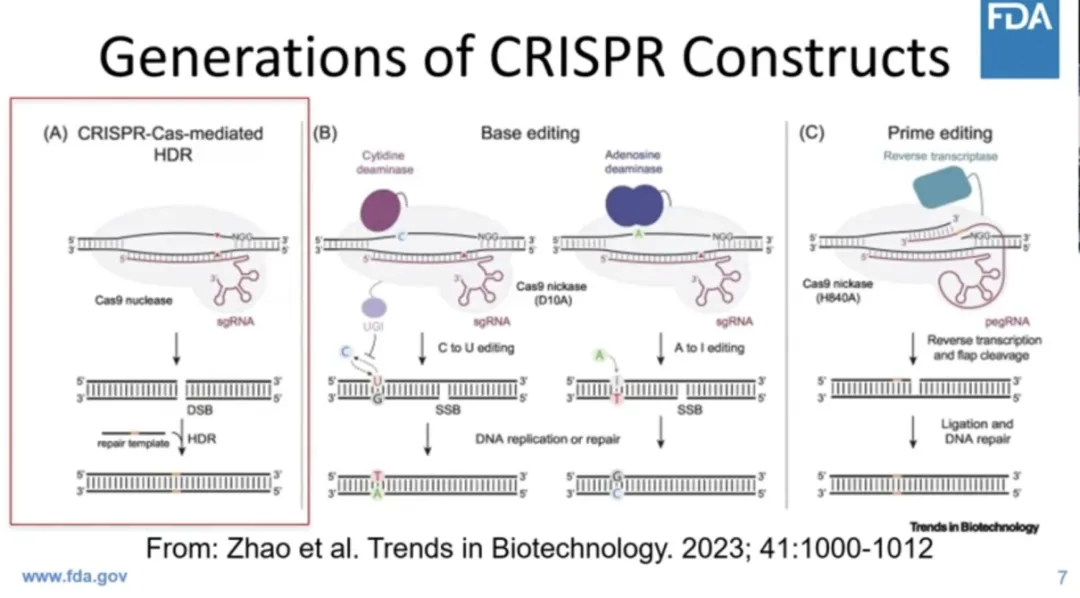
CRISPR Based Base Editors和CRISPR Based Prime Editors是非常令人興奮的第二代和第三代產(chǎn)品载荔,可能會改變我們對事物的看法。
但是慧耍,所有這些產(chǎn)品面臨的問題也正處在一個(gè)關(guān)鍵節(jié)點(diǎn)。我們?nèi)〉昧撕艽蟮募夹g(shù)進(jìn)步推妈,但仍然需要努力解決制造問題了赖,來治療罕見疾病,且要高效地做到這一點(diǎn)显哨。
臨床開發(fā)時(shí)間表是努力跟上科學(xué)的一種方式笆滓,但有時(shí)延遲會限制產(chǎn)品通過臨床,這是因?yàn)槿狈y(tǒng)一的全球監(jiān)管篙绎,也意味著罕見病療法通常無法在全球得到通行初肥。一般來說,制藥商會在一個(gè)國家取得監(jiān)管批準(zhǔn)后盡快地獲取另一個(gè)國家的監(jiān)管批準(zhǔn)亿隔。這也意味著在某些情況下午螺,可能需要花費(fèi)數(shù)年的時(shí)間。
FDA在做什么乃蔬?
在推進(jìn)基因療法的制造技術(shù)上跷它,CBER做了很多事情。其中一部分是提供更多的制造標(biāo)準(zhǔn)刁夺,以及致力于某些基因療法生產(chǎn)步驟的自動化唾诺,例如相關(guān)病毒載體的純化。
基因療法確實(shí)與其他生物制品或藥物不同途凫。不管是病毒載體還是非病毒載體垢夹,大部分產(chǎn)品的原理在本質(zhì)上是相同的,區(qū)別只是特定基因的插入维费。
如果制藥商使用相同的生產(chǎn)技術(shù)果元、相同的生產(chǎn)程序、相同的控制方法犀盟,可能只做了一次毒理學(xué)和生產(chǎn)描述噪漾,然后不斷進(jìn)行重復(fù)生產(chǎn)產(chǎn)品,那么FDA就會批準(zhǔn)這個(gè)平臺而非單一產(chǎn)品且蓬。通過這種方式欣硼,制藥商可以重復(fù)使用生產(chǎn)信息、毒理學(xué)信息恶阴,減少返工诈胜。

就比如CRISPR,下圖幻燈片右邊的兩個(gè)CRISPR Based Prime Editors非常相似冯事,盡管一個(gè)可能是治療血友病A這類出血性疾病焦匈,另一個(gè)可能是敲除PCSK9称侣,治療肝臟高膽固醇血癥。
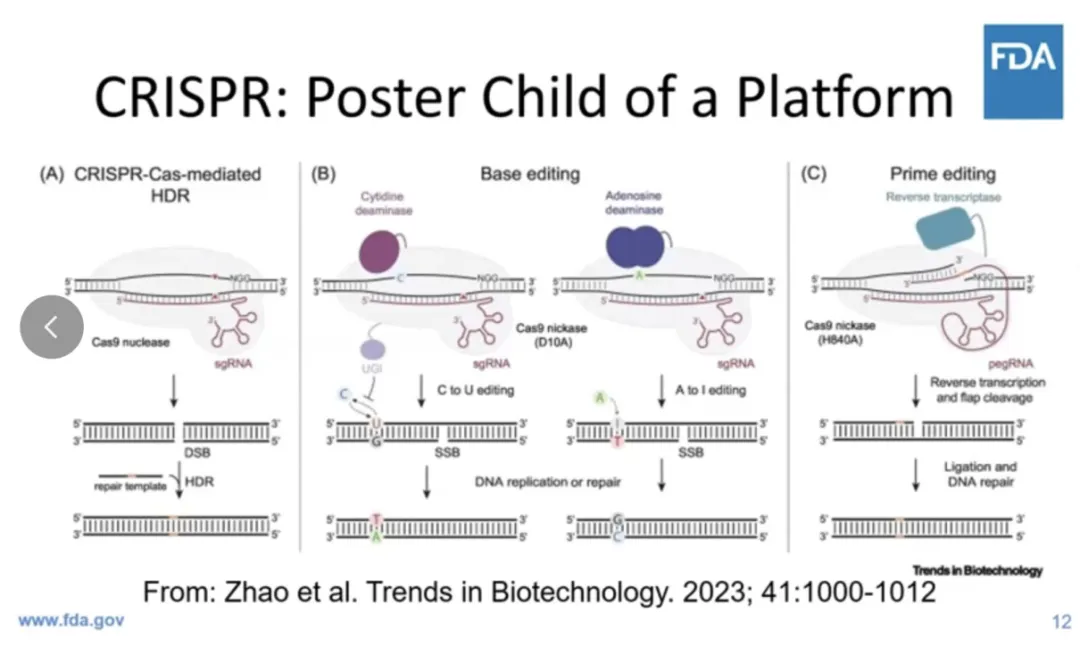
這些在RNA分子中可能只有150或200個(gè)核苷酸不同淳胆,其余的結(jié)構(gòu)赁挚、大分子組裝、用來傳遞的脂質(zhì)納米粒子螃方,可能都是一樣的照腐。因此,這種平臺方法非常重要担灭,為此制定監(jiān)管框架也非常重要贿册,這也是我們正在努力的方向。
我們也在進(jìn)行嘗試寓综,看是否可以利用所掌握的基因醫(yī)學(xué)來幫助產(chǎn)品更快地通過審批過程睦忘。其中一個(gè)方法是使用加速批準(zhǔn),這種方法允許我們在生物標(biāo)志物或中間臨床終點(diǎn)的基礎(chǔ)上證明產(chǎn)品療效耿堕,但這只是可能預(yù)測的一個(gè)臨床結(jié)果而不是真正的最終臨床結(jié)果砖啄。
這對基因療法來說并不是一件瘋狂的事∥独龋基因療法本身的產(chǎn)物是可以測量的午磁,是有可能預(yù)測臨床結(jié)果的。比如毡们,在血友病A中迅皇,測量的因子水平就很有可能預(yù)測臨床結(jié)果。因?yàn)槲覀冎姥萌郏艘蜃铀降幕颊咧械峭牵^30%的人實(shí)際上從不出血,甚至超過15%的出血都是不尋常的红氯。所以我們認(rèn)為這是可以利用的一種方式框咙。
但這種方法并不是一直都有效,有時(shí)科學(xué)家們無法測量基因產(chǎn)物痢甘,或者只能測量上游或下游的代謝物喇嘱,但這也有一定的幫助。很明顯塞栅,你可以回溯整個(gè)過程者铜,并得到最終的臨床終點(diǎn)。
這只是說我們可以在水平之間建立這種相關(guān)性放椰。實(shí)際的預(yù)測是通過使用動物模型或者有時(shí)是人類的觀察绵颅,如果可以通過使用基因療法達(dá)到同樣的水平,這就是合理的可能預(yù)測。
基因療法對于患者來說非常重要忙体,不僅僅是在高收入國家济谢。為了達(dá)到這個(gè)目標(biāo),我們需要更好的監(jiān)管融合怨级。FDA正在與世界衛(wèi)生組織合作情腥,試圖將框架付諸實(shí)施。實(shí)際上钮核,我們最近參加了一個(gè)會議辰张,會上有來自世界各地的中國同事,討論如何更有效地推進(jìn)基因療法和細(xì)胞療法樱凄。
另一件FDA 正在試行的事标炭,是利用各國監(jiān)管部門的資源共同對BLA進(jìn)行審批失欢。我們首先在歐洲藥品機(jī)構(gòu)進(jìn)行嘗試戈弧,后續(xù)可能會擴(kuò)大試點(diǎn)。

底線是晨另,一份提交的監(jiān)管報(bào)告可以由多個(gè)監(jiān)管機(jī)構(gòu)審查潭千,提高在多國獲得批準(zhǔn)的效率,讓許多不同國家的患者都能獲得這些產(chǎn)品借尿。
FDA還有一個(gè)試點(diǎn)項(xiàng)目刨晴,通過持續(xù)跟進(jìn),改善與開發(fā)罕見疾病療法制藥商的溝通路翻。
在COVID-19大流行期間狈癞,我們與產(chǎn)品開發(fā)人員保持聯(lián)系,通過與開發(fā)產(chǎn)品的制藥商進(jìn)行持續(xù)對話以加快開發(fā)速度茂契,而不是安排需要60天或75天的會議蝶桶。
目前,F(xiàn)DA正在四種產(chǎn)品或其中的一部分產(chǎn)品中試用這種方法掉冶,嘗試通過避免在正式會議中出現(xiàn)的延誤真竖,以及通過提供持續(xù)的建議來加快產(chǎn)品開發(fā)。

如果試點(diǎn)工作成功厌小,我們將會把這種方法擴(kuò)大到更多罕見病療法的審批中恢共,希望能更快地推動基因療法的進(jìn)展。
一些你關(guān)注的問題

杜新博士
埃格林醫(yī)藥CEO
杜新:在您的領(lǐng)導(dǎo)下璧亚,F(xiàn)DA/CBER最近批準(zhǔn)了幾種個(gè)性化/精準(zhǔn)藥物產(chǎn)品柴炉。對于正在進(jìn)入該領(lǐng)域BLA階段的公司,您對他們有什么建議价岭,尤其是在臨床和CMC方面含话,能夠使他們的產(chǎn)品順利通過BLA環(huán)節(jié)?
Peter Marks:CMC對于個(gè)性化產(chǎn)品的開發(fā)來說是一個(gè)不可或缺的過程,可以很好地定義在個(gè)性化過程中需要的關(guān)鍵質(zhì)量屬性。每個(gè)產(chǎn)品之間會有細(xì)微的不同茂钠,需要有一些可靠的測試來證明你正在開發(fā)的產(chǎn)品是有效的脚们。
臨床試驗(yàn)是驗(yàn)證產(chǎn)品有效性的重要部分。好消息是径塔,在處理緩解癌癥或增加生存時(shí)期部分鳖路,大多數(shù)產(chǎn)品的療效都非常明顯。我認(rèn)為凰番,這些個(gè)性化產(chǎn)品最具挑戰(zhàn)性的部分是確保質(zhì)量的一致性盏萝。
杜新: 接著上一個(gè)問題,很多中國公司在中國進(jìn)行IND臨床試驗(yàn)褒堆,并獲取數(shù)據(jù)澡呼,F(xiàn)DA是否接受來自中國的數(shù)據(jù)?
Peter Marks: 對于我們來說,任何通過良好的臨床實(shí)踐收集到的數(shù)據(jù)厉碟,只要收集得當(dāng)喊巍,我們都愿意接受和評估。FDA對收到的任何數(shù)據(jù)都持開放態(tài)度箍鼓,這一點(diǎn)不必?fù)?dān)憂崭参。如果制藥商擔(dān)心他們只有來自中國的單一數(shù)據(jù)可能會出問題,建議他們可以事先來和我們交流款咖。FDA非常樂意提前與制藥商們進(jìn)行溝通何暮,打消他們的疑慮。
杜新: 近年來铐殃,中國公司在藥物研發(fā)方面取得了重大進(jìn)展海洼,許多中國公司已經(jīng)向FDA申請了IND或BLA。對于這些中國企業(yè)富腊,您有什么建議可以幫助他們避免項(xiàng)目的不足之處?
Peter Marks:不要猶豫坏逢,利用任何可以與FDA溝通的會議,確保走在正確的道路上蟹肘。有時(shí)候词疼,制藥商會認(rèn)為FDA想要某些東西,或者認(rèn)為某些東西是必要的谅儡;但事實(shí)上秫丐,他們認(rèn)為的這些可能FDA并不需要,大家有時(shí)候是在做額外的工作妈扁。所以竹俱,我鼓勵(lì)制藥商盡早來和我們一起交流計(jì)劃、進(jìn)行討論粘胧、彼此提供反饋摊房,盡可能提高工作效率。
杜新:是否有新的FDA/CBER項(xiàng)目或指南,可以使制藥公司在藥物開發(fā)中受益?
Peter Marks:FDA的指南或項(xiàng)目都是完全開放的昨哑,比如再生醫(yī)學(xué)高級療法你朝、突破性療法等項(xiàng)目,制藥商都可以申請域毡,而且有中國藥企已經(jīng)成功申請過爪只。制藥商們可以自由申請,我們很樂意對這些提交申請的項(xiàng)目進(jìn)行評估考余,利用這些項(xiàng)目推進(jìn)藥物的研發(fā)先嬉。再生醫(yī)學(xué)高級療法、突破性療法等項(xiàng)目是額外的會議楚堤,制藥商們應(yīng)該充分利用這些機(jī)會疫蔓。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 長風(fēng)藥業(yè)
長風(fēng)藥業(yè)  2024-11-27
2024-11-27
 35
35

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 賽柏藍(lán)
賽柏藍(lán)  2024-11-27
2024-11-27
 35
35

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 碧博生物
碧博生物  2024-11-27
2024-11-27
 36
36
 熱門資訊
熱門資訊