
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥筆記
醫(yī)藥筆記  2024-07-19
2024-07-19
 435
435
2024年7月18日,和鉑醫(yī)藥巴托利單抗注射液重新遞交的上市申請(qǐng)獲得NMPA受理,用于治療全身型重癥肌無力咆耿。根據(jù)臨床試驗(yàn)方案拔馆,和鉑醫(yī)藥已順利完成三期臨床試驗(yàn)的擴(kuò)展研究豺谈,在未招募新患者的情況下收集了更多長期安全性數(shù)據(jù)蔚携。

重癥肌無力是一種由AchR抗體榴痢、MuSK抗體等自身抗體介導(dǎo)的獲得性自身免疫性疾病污益,絕大多數(shù)患者會(huì)發(fā)展為全身型重癥肌無力(gMG)鬓催,累計(jì)多個(gè)器官肺素,嚴(yán)重影響生活質(zhì)量,嚴(yán)重者會(huì)危及生命宇驾。美國約有5.9萬-11.6萬重癥肌無力患者倍靡,中國至少有20萬例重癥肌無力患者,存在嚴(yán)重的未滿足臨床需求课舍。
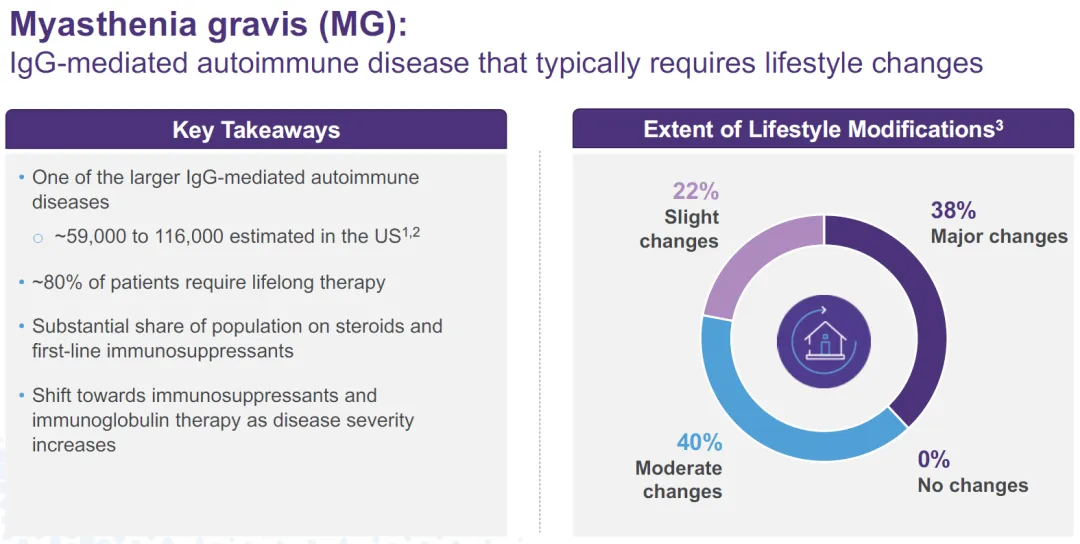
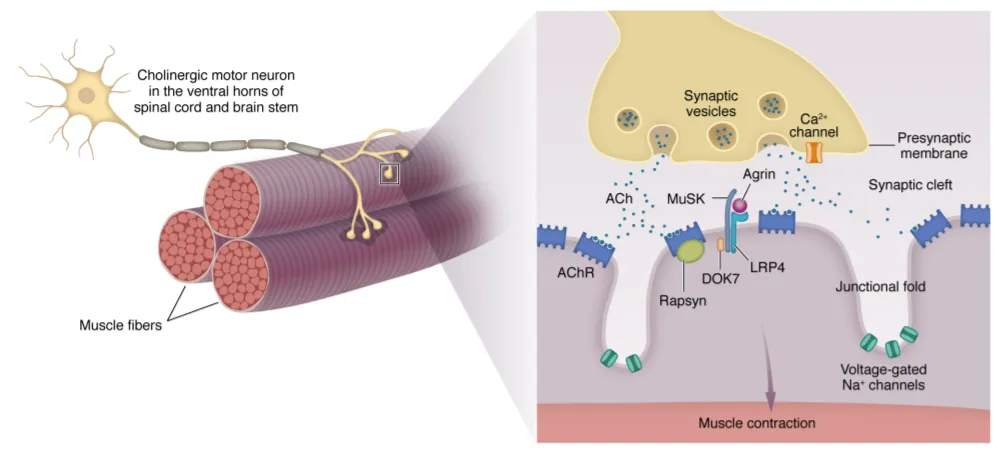
和鉑醫(yī)藥巴托利單抗于2021年獲得突破療法認(rèn)證塌西,2023年3月,和鉑醫(yī)藥宣布全身性重癥肌無力三期臨床獲得積極數(shù)據(jù)筝尾。
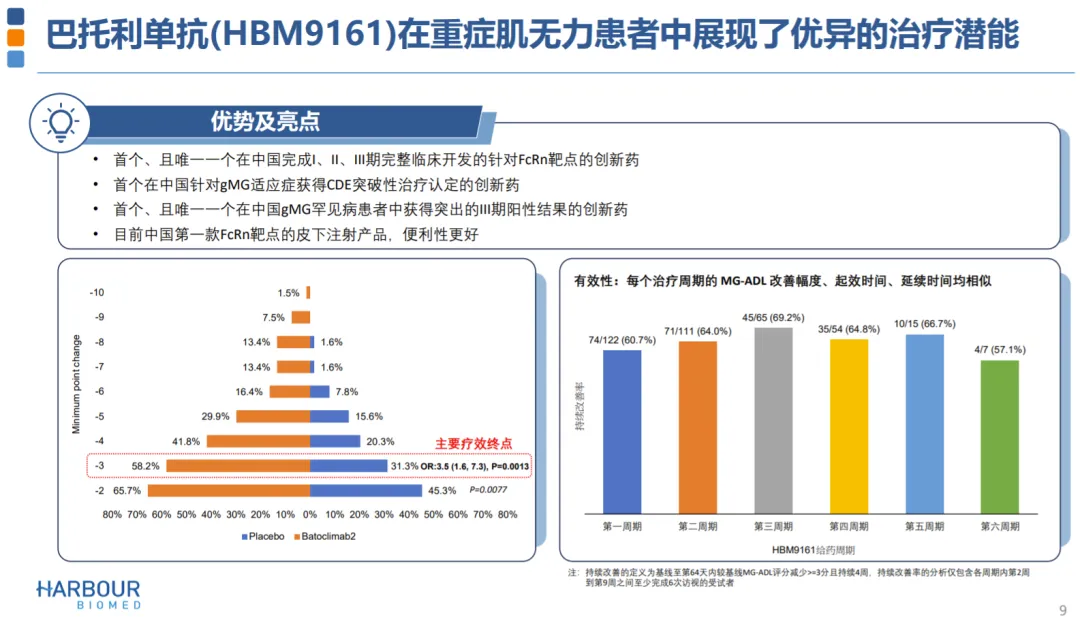
2024年3月捡需,巴托利單抗三期臨床數(shù)據(jù)發(fā)表在JAMA Neurology期刊上。

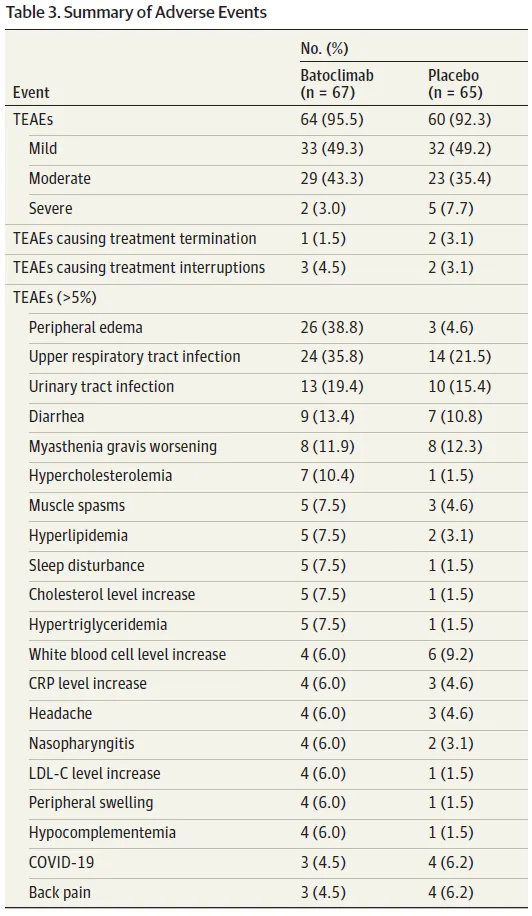
該三期臨床共納入132例全身型重癥肌無力成人患者筹淫,其中131例AChR/MuSK抗體陽性患者站辉,每周給藥一次,連續(xù)治療6周损姜,主要終點(diǎn)為患者重癥肌無力日常生活量表(MG-ADL)得分較基線的變化情況饰剥。結(jié)果表明,巴托利單抗治療可以快速起效摧阅,第2周開始癥狀即顯著改善朗溶。在第43天,巴托利單抗治療組的ADL評(píng)分持續(xù)改善率達(dá)58.2%(39/67)腥默,顯著高于安慰劑對(duì)照組(31.1%彼窥,20/64)。在MG定量評(píng)分(QMGs)匿微、MG復(fù)合評(píng)分(MGC)写阐、15項(xiàng)重癥肌無力生活質(zhì)量評(píng)分(MG-QOL15r)分析中,巴托利單抗治療組與安慰劑對(duì)照組也呈現(xiàn)了相似的趨勢(shì)翎味。
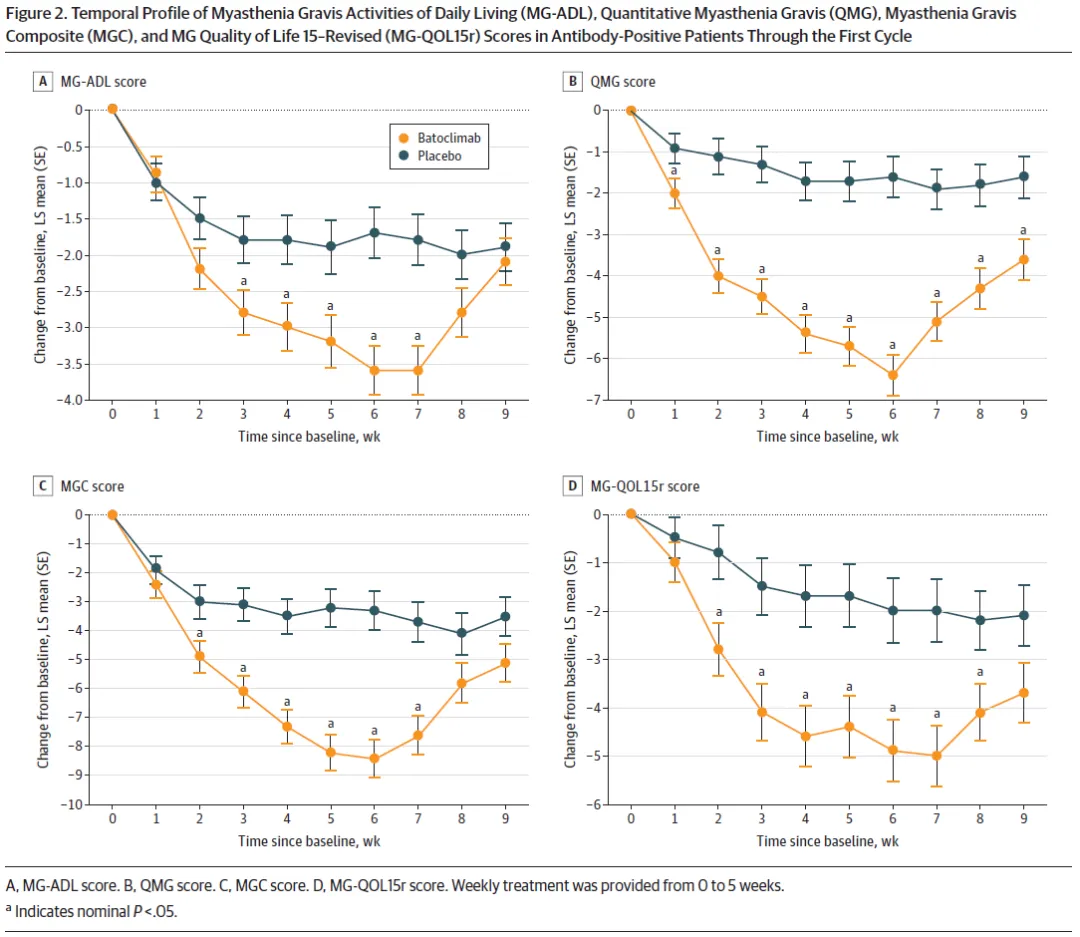
安全性方面蝉择,巴托利單抗治療組與安慰劑對(duì)照組不良事件發(fā)生率相近,總體耐受性和安全性數(shù)據(jù)良好民逾。
總結(jié)
2022年10月蛀植,和鉑醫(yī)藥與石藥集團(tuán)達(dá)成合作協(xié)議,在大中華區(qū)共同開發(fā)巴托利單抗垫凝,和鉑醫(yī)藥負(fù)責(zé)巴托利單抗在中國針對(duì)全身型重癥肌無力完整臨床試驗(yàn)的設(shè)計(jì)與執(zhí)行, 并將根據(jù)產(chǎn)品年度凈銷售額獲得分層銷售提成填要。
FcRn抗體市場(chǎng)價(jià)值潛力巨大苦厅,Argenx的Efgartigimod和優(yōu)時(shí)比的Rozanolixizumab僅獲批gMG一個(gè)適應(yīng)癥,前者在2023年即實(shí)現(xiàn)12億美元銷售額关串。Immunovant擁有巴托利單抗大中華區(qū)外權(quán)益拧廊,目前在開發(fā)全身性重癥肌無力、甲狀腺眼病晋修、Graves' disease吧碾、慢性炎癥性脫髓鞘性多發(fā)性神經(jīng)病等。


 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 長風(fēng)藥業(yè)
長風(fēng)藥業(yè)  2024-11-27
2024-11-27
 32
32

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 賽柏藍(lán)
賽柏藍(lán)  2024-11-27
2024-11-27
 32
32

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 碧博生物
碧博生物  2024-11-27
2024-11-27
 33
33
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽