
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥明康德
藥明康德  2024-07-26
2024-07-26
 449
449
吉利德科學(xué)(Gilead Sciences)今日公布其關(guān)鍵3期PURPOSE 1試驗的中期分析詳細(xì)結(jié)果屋问。該公司每半年注射一次的艾滋病毒(HIV)衣殼抑制劑lenacapavir在女性中的HIV預(yù)防用途上顯示出100%的有效性偶摔,相比于每日一次口服療法以及HIV的背景發(fā)病率皆表現(xiàn)出顯著的優(yōu)效性。據(jù)此積極結(jié)果祝峻,獨立數(shù)據(jù)監(jiān)測委員會建議吉利德提早解盲瓣车,并提供所有受試者開放標(biāo)簽的lenacapavir脱处。根據(jù)新聞稿缚宜,如果獲批犯弯,lenacapavir將成為首款每年僅需使用兩次的HIV暴露前預(yù)防(PrEP)療法。該試驗的詳細(xì)結(jié)果也同步刊登于《新英格蘭醫(yī)學(xué)雜志》(NEJM)當(dāng)中型圈。
全球每年新增約130萬艾滋病毒感染病例意澡。近年來研究發(fā)現(xiàn)昙椭,在未受到感染時服用抗病毒藥物,可以降低艾滋病毒感染的風(fēng)險蒜丙。這種預(yù)防艾滋病毒感染的療法稱為PrEP療法因饥。首款獲批的艾滋病PrEP藥物是每日口服的Truvada(F/TDF),如果按指示服用溯童,預(yù)防艾滋病的效果顯著请立。自2012年美國FDA首次批準(zhǔn)F/TDF以來,估計已有600多萬人使用PrEP求馋。然而捐憔,全球女性對PrEP的接受度、依從性和持久性仍然有限喷楣,凸顯了開發(fā)創(chuàng)新PrEP藥物的必要性趟大。
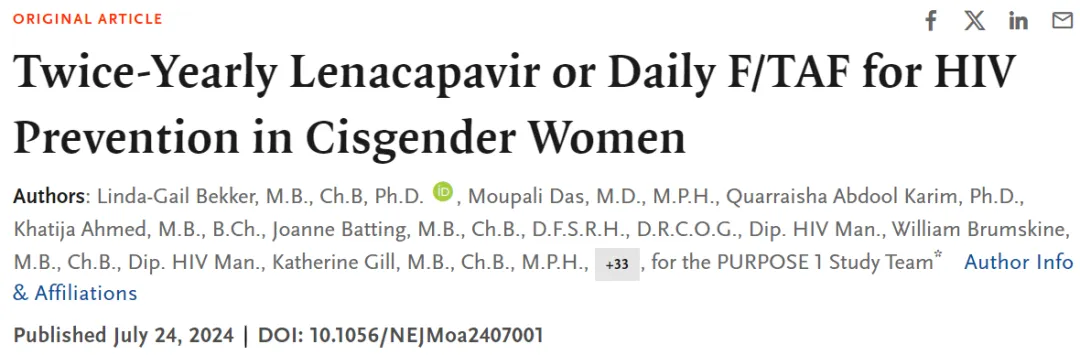
這次所公布的PURPOSE 1是一項雙盲鹤树、隨機3期研究铣焊。共有5338位16-25歲的一般女性和青春期女孩入組,受試者在入組前皆受檢測為HIV陰性罕伯。受試者按2:2:1的比例曲伊,分別接受半年一次的lenacapavir皮下注射、每日一次口服抗病毒療法Descovy(F/TAF)或與每日一次口服F/TDF追他。所有受試者并在試驗中同時接受相應(yīng)的安慰劑皮下注射或口服治療坟募。由于考慮到在這種情況下使用安慰劑的道德倫理問題,試驗還包括未注冊的篩查者作為無PrEP觀察組邑狸。
中期分析預(yù)定為當(dāng)50%隨機分配的受試者完成至少52周的隨訪時進行(臨床數(shù)據(jù)截止日期為2024年5月28日懈糯,實驗室數(shù)據(jù)截止日期為2024年5月29日)。結(jié)果顯示单雾,在5338名受試者中赚哗,觀察到55例新發(fā)HIV感染。其中l(wèi)enacapavir組(n=2134)中沒有受試者感染(0/100人年乐慌;95% CI:0.00-0.19)妈唯,F(xiàn)/TAF組(n=2136)中有39例感染(2.02/100人年;95% CI:1.44-2.76)飘含,F(xiàn)/TDF組(n=1068)中有16例感染(1.69/100人年燃悍;95% CI:0.96-2.74)。在篩查群體(n=8094)中的HIV背景發(fā)病率則為2.41/100人年(95% CI:1.82-3.19)鼓笨。
▲Lenacapavir組受試者的HIV感染率為零(圖片來源:參考資料[2])
Lenacapavir組的HIV感染率顯著低于背景HIV感染率(感染率比=0.00箭瘫;95% CI:0.00-0.04;P<0.001)锰胀,也低于F/TDF組的HIV感染率(感染率比=0.00猩吕;95% CI:0.00-0.10茫失;P<0.001)。F/TAF組的HIV感染率與背景HIV感染率沒有顯著差異(感染率比=0.84绵捡;95% CI:0.55-1.28真王;P=0.21),而且F/TAF組和F/TDF組之間的HIV感染率也沒有顯著差異(感染率比=1.20安揣;95% CI:0.67-2.14)街立。
根據(jù)試驗方案,由于PURPOSE 1在中期分析時達到主要終點埠通,即lenacapavir相比于背景HIV發(fā)病率和每日一次口服F/TDF具有優(yōu)效性赎离,獨立數(shù)據(jù)監(jiān)測委員會建議吉利德停止試驗的雙盲階段,并向所有受試者提供開放標(biāo)簽的lenacapavir端辱。截至7月23日梁剔,已有超過840名試驗參與者選擇轉(zhuǎn)用lenacapavir。
患者依從性分析顯示lenacapavir注射的高依從性和持續(xù)性舞蔽。所有組別的注射依從性皆很高荣病,無論是注射lenacapavir或是安慰劑,91.5%的受試者在第26周按時注射渗柿,92.8%的受試者在一年時按時注射个盆。所有隊列的按時注射率相似,無論是接受lenacapavir還是安慰劑注射朵栖。相比之下颊亮,通過檢測部分受試者血液中的藥物水平發(fā)現(xiàn),每日一次口服F/TAF和F/TDF的依從性差且隨著時間的推移而下降陨溅。在試驗中受試者對每日一次口服PrEP藥物的低依從性水平與過往研究中所觀察到的一致终惑。值得一提的是,在病例對照分析中健十,F(xiàn)/TAF的艾滋病毒保護性與受試者的服藥依從性密切相關(guān)诊拦。
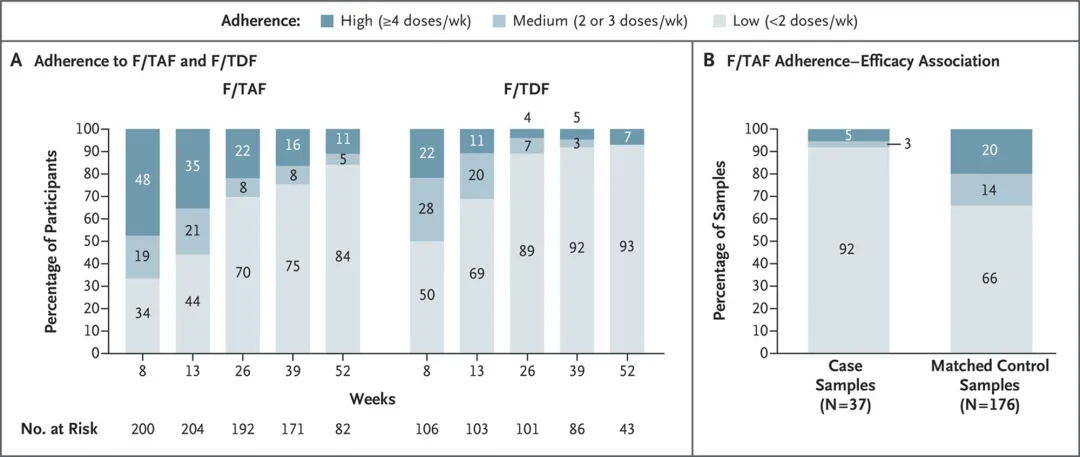
▲接受每日一次口服療法患者的服藥依從性低(圖片來源:參考資料[2])
安全性方面,lenacapavir决盔、F/TAF和F/TDF通常耐受性良好酌铺,未發(fā)現(xiàn)新的安全問題。Lenacapavir組中2.8%(n=59)的受試者報告了嚴(yán)重不良事件(SAEs)酿乾,F(xiàn)/TAF組為4.0%(n=85)辕洗,F(xiàn)/TDF組為3.3%(n=35)。各隊列間的不良事件頻率相似渣蒙。
Lenacapavir(商品名Sunlenca)是一種“first-in-class”長效HIV衣殼抑制劑趋亡,可以干擾HIV病毒衣殼蛋白的組裝和拆卸,在HIV-1生命周期的多個階段發(fā)揮作用缔寒。Lenacapavir在2019年5月獲得美國FDA授予的突破性療法認(rèn)定挪其,用于聯(lián)合其他抗逆轉(zhuǎn)錄病毒藥物治療多重耐藥的重度經(jīng)治HIV-1感染者顿蝇。之前一項2/3期試驗表明,lenacapavir讓患者有望只需每隔6個月接受一次注射什猖,就可以維持它的效力票彪。
吉利德預(yù)計將在2024年底或2025年初公布PURPOSE計劃的另一關(guān)鍵性試驗PURPOSE 2的結(jié)果,該試驗評估每半年一次的lenacapavir用于具有不同性別取向的男女個體預(yù)防HIV感染的效果不狮。如果PURPOSE 1和PURPOSE 2的結(jié)果均為積極降铸,lenacapavir作為HIV PrEP療法的監(jiān)管申請將包括這兩個試驗的結(jié)果,以確保lenacapavir能夠獲批用于最需要額外HIV預(yù)防選擇的多種群體摇零。
PURPOSE 1試驗的結(jié)果將引發(fā)一系列科學(xué)問題推掸,包含新出現(xiàn)病毒是否會對lenacapavir耐藥?以及這些數(shù)據(jù)是否能潛在應(yīng)用于其他高危艾滋病毒感染群體當(dāng)中驻仅?此外谅畅,新聞稿指出,PURPOSE 1是首個包括孕婦和青少年在內(nèi)的成人HIV預(yù)防關(guān)鍵性試驗噪服。因此lenacapavir在妊娠期中的安全性將會是一個需要優(yōu)先評估的事項毡泻。雖然有許多問題仍待研究人員回答,然而lenacapavir在預(yù)防病毒感染出色的有效性著實是是艾滋病預(yù)防領(lǐng)域的一大進步芯咧,讓我們?yōu)閰⑴c藥物開發(fā)的科學(xué)家牙捉、醫(yī)護人員與受試者喝彩竹揍!
參考資料:
[1] Full Efficacy and Safety Results for Gilead Investigational Twice-Yearly Lenacapavir for HIV Prevention Presented at AIDS 2024. Retrieved July 24, 2024 from https://www.businesswire.com/news/home/20240724232867/en
[2] Bekker, Linda-Gail et al. “Twice-Yearly Lenacapavir or Daily F/TAF for HIV Prevention in Cisgender Women.” The New England journal of medicine, 10.1056/NEJMoa2407001. 24 Jul. 2024, DOI:10.1056/NEJMoa2407001
[3] Rochelle P. Walensky et al. “The Real PURPOSE of PrEP — Effectiveness, Not Efficacy” The New England journal of medicine, 24 Jul. 2024, DOI: 10.1056/NEJMe2408591

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 長風(fēng)藥業(yè)
長風(fēng)藥業(yè)  2024-11-27
2024-11-27
 24
24

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 賽柏藍(lán)
賽柏藍(lán)  2024-11-27
2024-11-27
 25
25

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 碧博生物
碧博生物  2024-11-27
2024-11-27
 26
26