
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 細(xì)胞治療前沿
細(xì)胞治療前沿  2024-07-26
2024-07-26
 333
333
7月22日芒炼,中國國家藥監(jiān)局藥品審評(píng)中心(CDE)官網(wǎng)最新公示,由廣東香雪精準(zhǔn)醫(yī)療技術(shù)有限公司申報(bào)的TAEST16001注射液擬納入突破性治療品種扇售,擬用于治療組織基因型為HLA-A*02:01,腫瘤抗原NY-ESO-1表達(dá)為陽性的軟組織肉瘤嚣艇。
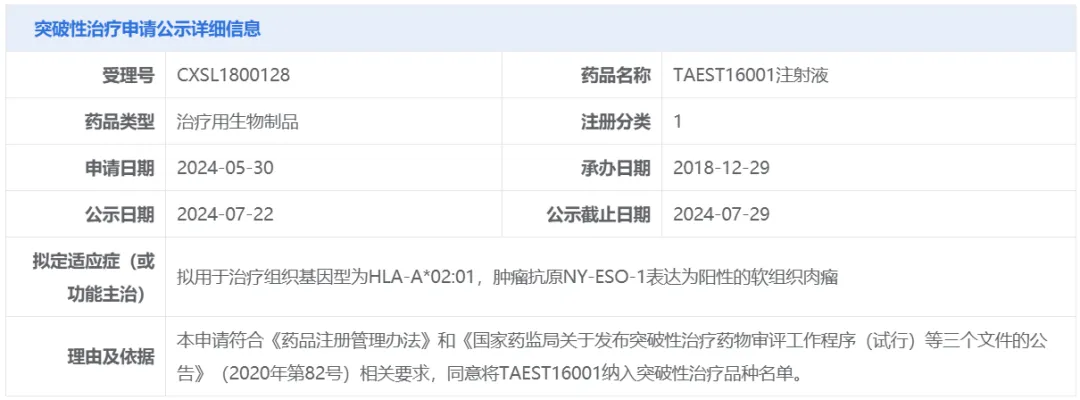
截圖來源:CDE官網(wǎng)
軟組織肉瘤是一種罕見癌癥承冰,可能出現(xiàn)在身體任何部位,有50多種類型食零。一些類型更易影響兒童困乒,另一些則主要影響成人。在中國贰谣,軟組織肉瘤的發(fā)病率約為2.91/10萬人每年娜搂,且呈上升趨勢。對(duì)于不可切除的局部晚期或轉(zhuǎn)移性軟組織肉瘤吱抚,盡管不同肉瘤亞型對(duì)化療藥物的敏感性不同百宇,局部晚期或轉(zhuǎn)移性軟組織肉瘤一線治療仍推薦以蒽環(huán)類藥物為主的姑息化療,臨床仍然存在較大的未被滿足臨床需求狱林。
TAEST16001注射液由香雪生命科學(xué)研發(fā)鹊尤,為靶向NY-ESO-1的親和力增強(qiáng)的TCR-T細(xì)胞免疫治療產(chǎn)品,首個(gè)開展臨床研究的適應(yīng)癥為HLA-A*02:01陽性且表達(dá)NY-ESO-1抗原的晚期軟組織肉瘤农泊。該產(chǎn)品治療晚期軟組織肉瘤患者的1期臨床試驗(yàn)結(jié)果在美國臨床腫瘤學(xué)會(huì)(ASCO)2022年會(huì)上進(jìn)行口頭匯報(bào),并于2023年8月刊登在國際期刊Cell Reports Medicine缘赋。 初步分析時(shí)碰蚂,12例患者中有5例的最佳緩解是部分緩解惊派,客觀緩解率(ORR)為41.7%。
2024年竣楼,TAEST16001針對(duì)晚期軟組織肉瘤2期臨床試驗(yàn)的階段性總結(jié)數(shù)據(jù)再次入選ASCO年會(huì)送服。其在2期臨床早期數(shù)據(jù)顯示出與之前的1期研究一致的可控的安全性和耐受性。根據(jù)RECIST1.1亲堂,由獨(dú)立影像評(píng)估委員會(huì)(IRC)評(píng)估的最佳緩解率為50%(4/8)炼杉。由獨(dú)立影像評(píng)估委員會(huì)和研究者評(píng)估的中位無進(jìn)展生存期(mPFS)均為5.9個(gè)月。目前大多數(shù)受試者仍在隨訪中假棉。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 長風(fēng)藥業(yè)
長風(fēng)藥業(yè)  2024-11-27
2024-11-27
 24
24

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 賽柏藍(lán)
賽柏藍(lán)  2024-11-27
2024-11-27
 25
25

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 碧博生物
碧博生物  2024-11-27
2024-11-27
 26
26
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽