
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 研發(fā)客
研發(fā)客  2024-07-29
2024-07-29
 348
348
? 楊建新透露庭匆,舒格利單抗4年隨訪數(shù)據(jù)優(yōu)于K藥。
? 基石管線升級(jí)2.0:自主研發(fā)為主,擁有全球權(quán)益赖舟、避開內(nèi)卷靶點(diǎn)。? 選擇合作伙伴時(shí),考慮能否最大化產(chǎn)品的商業(yè)價(jià)值。
7月26日竭贩,基石藥業(yè)的舒格利單抗獲批在歐洲上市,成為全球首個(gè)在歐洲上市用于一線治療鱗狀和非鱗狀非小細(xì)胞肺癌(NSCLC)的PD-L1單抗莺禁,也是首個(gè)成功“出毫袅浚”的國產(chǎn)PD-L1單抗。
為此哟冬,研發(fā)客第一時(shí)間專訪了基石藥業(yè)CEO楊建新博士楼熄,他與我們分享了舒格利單抗“出海”背后的細(xì)節(jié)浩峡,以及一個(gè)正在蛻變的基石可岂。
OS率對(duì)比K藥如何?
“雖然我們的臨床試驗(yàn)在中國開展村钧,但設(shè)計(jì)和執(zhí)行層面都嚴(yán)格對(duì)標(biāo)FDA的要求岗制。更重要的是,盡管GEMSTONE-302研究的主要終點(diǎn)是PFS诗差,基石在臨床試驗(yàn)設(shè)計(jì)中仍然預(yù)先設(shè)定了對(duì)OS進(jìn)行統(tǒng)計(jì)學(xué)檢測⌒潋”楊建新說搪狈。此次歐盟獲批的依據(jù)正是GEMSTONE-302這項(xiàng)多中心隨機(jī)雙盲的3期臨床研究。

基石CEO 楊建新
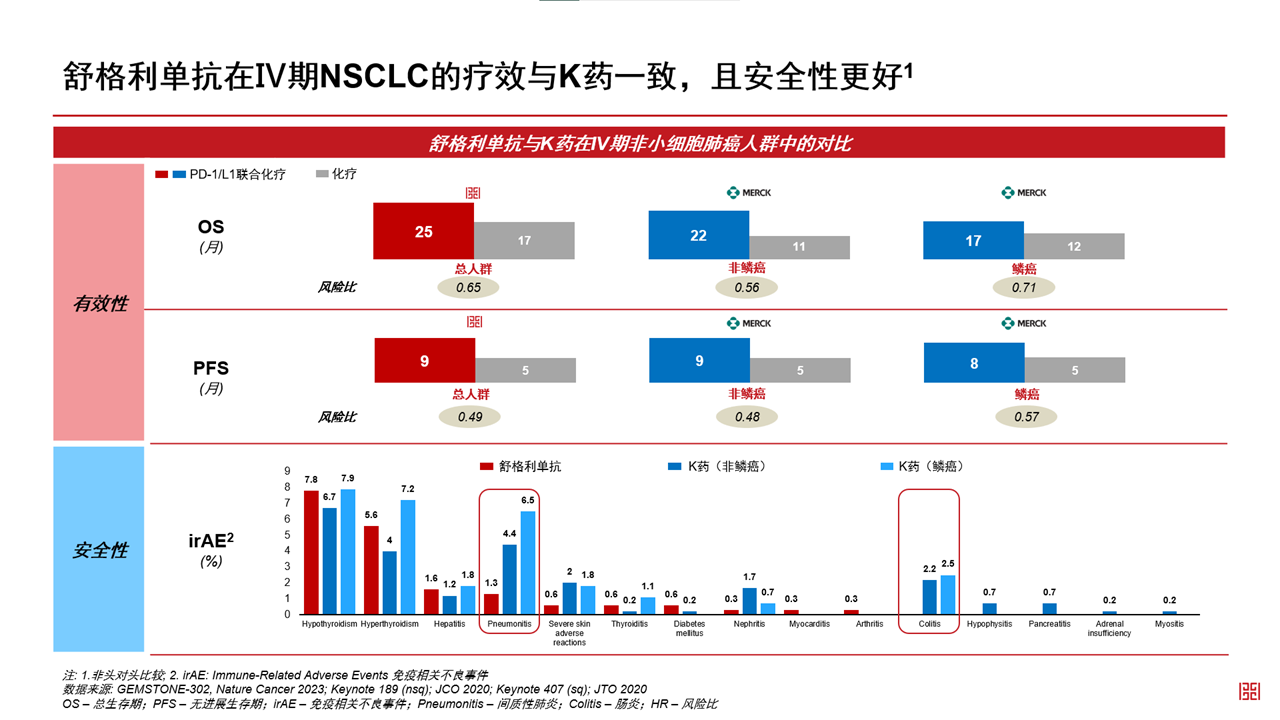
在舒格利單抗之前羊耸,針對(duì)NSCLC適應(yīng)癥延幻,僅有K藥作為全人群獲批的PD-1產(chǎn)品進(jìn)入歐盟市場。而GEMSTONE-302研究數(shù)據(jù)顯示葵伟,舒格利單抗在PFS和OS上的表現(xiàn)林品,絲毫不遜于K藥词惭。在包括非鱗NSCLC及鱗狀NSCLC在內(nèi)的全人群中,舒格利單抗的PFS風(fēng)險(xiǎn)比(HR)值為0.49增队,OS的HR值為0.65扣墩。
楊建新在采訪中表示,舒格利單抗是一款能與帕博利珠單抗(K藥)進(jìn)行全方位數(shù)據(jù)對(duì)比的腫瘤免疫治療藥物扛吞,也是國內(nèi)唯一具備長期隨訪OS數(shù)據(jù)的PD-L1單抗呻惕。
他認(rèn)為,很多產(chǎn)品在一項(xiàng)臨床試驗(yàn)的某一兩次分析中可以實(shí)現(xiàn)PFS滥比、OS數(shù)據(jù)一致亚脆,但是最終放大到長期跟蹤的數(shù)據(jù)仍能保持一致趨勢,這是頗為不易的盲泛,但舒格利單抗做到了濒持。
2022年的ESMO上,默沙東公布了K藥聯(lián)合化療一線治療非鱗NSCLC和鱗狀NSCLC的5年生存隨訪數(shù)據(jù):非鱗NSCLC的OS HR值為 0.60寺滚,4年OS率為23.6%柑营;鱗狀NSCLC的OS HR值 為0.71,4年OS率為21.9%玛迄。
“在我們的GEMSTONE-302中由境,經(jīng)過4年的隨訪,舒格利單抗表現(xiàn)出持續(xù)穩(wěn)定的生存獲益蓖议,從數(shù)據(jù)來看舒格利單抗的表現(xiàn)甚至更優(yōu)于K藥虏杰。具體細(xì)節(jié)請關(guān)注我們在今年9月ESMO上的數(shù)據(jù)發(fā)表』偌福”楊建新說撕擂。
除了療效,舒格利單抗還展現(xiàn)出PD-L1產(chǎn)品在安全性方面的優(yōu)勢陵租,尤其間質(zhì)性肺炎和免疫性結(jié)直腸炎兩項(xiàng)較為嚴(yán)重的毒副反應(yīng)的發(fā)生率更低泉蠢。
?
圖片來源|基石
亮眼的臨床數(shù)據(jù)固然是獲批的關(guān)鍵因素,注冊過程中與歐盟的溝通同樣重要育床。在遞交上市申請后不久诡语,基石即收到歐洲藥品管理局(EMA)發(fā)來的Day 120清單,包含194個(gè)待決問題松浆。團(tuán)隊(duì)在梳理海量數(shù)據(jù)后窑竖,在規(guī)定時(shí)限內(nèi)向EMA提交了詳盡的回復(fù),并且在Day 180時(shí)旧晴,將近90%的問題答復(fù)被EMA審評(píng)員一次性接受适固,剩余部分也在進(jìn)一步澄清后獲得審評(píng)員的認(rèn)可。
在審評(píng)期間遮尚,基石藥業(yè)還順利通過了EMA對(duì)生產(chǎn)廠的定期GMP核查誊涯,以及對(duì)兩家研究中心和CRO共為期3周的GCP核查挡毅。今年5月底,基石終于收到了EMA人用藥品委員會(huì)(CHMP)發(fā)布的推薦批準(zhǔn)的積極意見暴构。
目前跪呈,舒格利單抗是全球首個(gè)全人群獲批用于一線治療IV期NSCLC的PD-L1產(chǎn)品。據(jù)基石預(yù)計(jì)丹壕,在全球市場(除美國以外)將會(huì)達(dá)到5億美元的銷售峰值庆械。
今年5月,基石將舒格利單抗在中歐/東歐的商業(yè)化權(quán)利授權(quán)于Ewopharma菌赖,基石將最高獲得5130萬美元的首付款以及后續(xù)注冊及銷售里程碑款缭乘。此外,基石在西歐琉用、東南亞堕绩、中東、拉美等地區(qū)的商業(yè)化合作洽談也正在進(jìn)行中邑时。據(jù)楊建新透露奴紧,公司正計(jì)劃向歐盟遞交舒格利單抗治療3期NSCLC、一線治療胃癌晶丘、一線治療食管癌以及復(fù)發(fā)難治性結(jié)外NK/T細(xì)胞淋巴瘤適應(yīng)癥的上市申請冬蝶。
為了活下來,必須加快商業(yè)化閉環(huán)
除了舒格利單抗“出合筇澹”成功瘟气,研發(fā)客還留意到基石其他幾款成熟產(chǎn)品的交易。
今年7月档改,公司將阿伐替尼在中國大陸區(qū)域的獨(dú)家推廣權(quán)授予恒瑞醫(yī)藥断憨,并獲得3500萬元人民幣首付款。去年谅囚,RET抑制劑普拉替尼在中國大陸區(qū)域的獨(dú)家商業(yè)化推廣權(quán)授予艾力斯瑰保,基石同樣獲得了一筆可觀的首付款。此外雄防,基于優(yōu)化資源配置的策略考量柱阱,基石終止了與施維雅的許可協(xié)議,并將此前共同開發(fā)的艾伏尼布在大中華地區(qū)和新加坡的開發(fā)康局、生產(chǎn)和商業(yè)化獨(dú)家權(quán)利出售給施維雅擒欢,基石獲得5000萬美元的交易款項(xiàng)。
近年來嚼吞,嚴(yán)酷的資本市場環(huán)境讓不少本土Biotech陷入困境。行業(yè)寒冬之下蹬碧,每一家Biotech都經(jīng)受著生存考驗(yàn)舱禽,這也是楊建新接棒基石CEO之后必須直面的問題炒刁。
“我們的研發(fā)能力一直是一流水準(zhǔn),但是生產(chǎn)和銷售兩個(gè)環(huán)節(jié)確實(shí)相對(duì)薄弱誊稚。通過與CSO的合作來提高銷售效率翔始,加速完成商業(yè)化產(chǎn)品的閉環(huán)是活下來的第一步±锊”楊建新坦言城瞎。
至于如何選擇合作伙伴?他認(rèn)為疾瓮,需要考量對(duì)方公司產(chǎn)品與專長領(lǐng)域的契合度以及商業(yè)化團(tuán)隊(duì)能力脖镀,是否能最大化產(chǎn)品商業(yè)價(jià)值。艾力斯在肺癌產(chǎn)品銷售上的出色表現(xiàn)狼电,讓基石看到了它在這個(gè)領(lǐng)域的實(shí)力蜒灰。而阿伐替尼作為一款具有多項(xiàng)適應(yīng)癥潛力的產(chǎn)品,則需要一個(gè)能覆蓋多個(gè)領(lǐng)域的大型團(tuán)隊(duì)哥钉。恒瑞自然是最好的選擇蜗原。
除了商業(yè)授權(quán)之外,基石也在加速推進(jìn)藥品地產(chǎn)化生產(chǎn)峦铲。今年6月嗤锯,阿伐替尼轉(zhuǎn)移至境內(nèi)生產(chǎn)的上市申請已獲NMPA批準(zhǔn),預(yù)計(jì)將在2024年底或2025年初起逐步替代現(xiàn)有進(jìn)口產(chǎn)品筑轻,實(shí)現(xiàn)國產(chǎn)化供應(yīng)钉栈。此外,普拉替尼的地產(chǎn)化上市申請也在今年4月獲受理泳厌,正處于審評(píng)階段另焕。
在楊建新看來,地產(chǎn)化轉(zhuǎn)移需要完成人體生物等效性試驗(yàn)起驱、注冊申請等等惦鄙,還需要投入大量時(shí)間精力和資金成本,這些并不是所有企業(yè)都能做到的鹊获。而實(shí)現(xiàn)地產(chǎn)化之后喧久,藥品的生產(chǎn)成本顯著降低,這也將為Biotech帶來非成材耄可觀的利潤燥撞。
掌握產(chǎn)品全球權(quán)益
如何從容應(yīng)對(duì),走出低谷期迷帜?楊建新認(rèn)為既要求生存物舒,同時(shí)也要為下一個(gè)階段的發(fā)展播下種子。過去兩年戏锹,基石通過關(guān)閉工廠冠胯、產(chǎn)品銷售外包火诸,精簡團(tuán)隊(duì)來降低運(yùn)營成本,并對(duì)一些研發(fā)項(xiàng)目進(jìn)行了優(yōu)化或暫停荠察。而此次PD-L1產(chǎn)品成功出海以及一系列BD交易置蜀,則為公司帶來現(xiàn)金流。
如何贏得未來悉盆?基石策略性地布局了研發(fā)管線2.0盯荤。“自主研發(fā)為主焕盟、擁有全球權(quán)益秋秤、避開內(nèi)卷靶點(diǎn)“瓿担”楊建新概括了2.0管線的幾大特點(diǎn)唆逻。

圖片來源|基石
進(jìn)展最快的CS5001是一款ROR1抗體偶聯(lián)藥物(ADC),也是目前已知首個(gè)在實(shí)體瘤和淋巴瘤中均觀察到臨床療效的ROR1 ADC菠贡。2020年唇墅,基石藥業(yè)以1000萬美元從韓國公司LCB手中拿下了這款處于PCC階段的產(chǎn)品除韓國外的全球權(quán)益。
在今年的ASCO上睛至,基石以壁報(bào)形式公布了CS5001治療晚期實(shí)體瘤和淋巴瘤患者的1a/1b期特奇、全球多中心、首次人體研究的數(shù)據(jù)治部。公司預(yù)計(jì)2024年內(nèi)將啟動(dòng)注冊臨床研究剧么。
另一款三抗(PD-1/CTLA4/VEGFa)產(chǎn)品CS2009,正在進(jìn)行猴子GLP毒理實(shí)驗(yàn)沧蛉,預(yù)計(jì)在今年底進(jìn)入1期臨床試驗(yàn)苫治。此外,還有多個(gè)針對(duì)腫瘤的單抗與雙抗ADC產(chǎn)品蟀思,以及針對(duì)自身免疫型疾病的多抗產(chǎn)品處在早期研究階段零院。
楊建新透露,基石擁有以上產(chǎn)品的全球權(quán)益村刨,每款產(chǎn)品也都具備海外授權(quán)的潛力告抄。CS5001項(xiàng)目正在與多家跨國公司洽談中,有望在明年中期達(dá)成“出呵段”打洼。
今天的基石形成了典型的biotech公司的形態(tài):100多人的精銳隊(duì)伍,管理更為扁平化逆粹,對(duì)每個(gè)部門的負(fù)責(zé)人給予足夠的授權(quán)募疮;R&D出身的楊建新,以研發(fā)總裁的身份,每周與團(tuán)隊(duì)討論各個(gè)項(xiàng)目的進(jìn)展情況酝锅,提出問題和把握方向诡必。
“我們已走出ICU,正朝著正確的方向小步快跑搔扁,爭取早日能進(jìn)KTV!”楊建新風(fēng)趣地說蟋字。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 長風(fēng)藥業(yè)
長風(fēng)藥業(yè)  2024-11-27
2024-11-27
 21
21

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 賽柏藍(lán)
賽柏藍(lán)  2024-11-27
2024-11-27
 22
22

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 碧博生物
碧博生物  2024-11-27
2024-11-27
 23
23
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽