
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 識林
識林  2024-07-31
2024-07-31
 363
363
2024年7月26日,EMA發(fā)布了《活性物質的化學指南》(Guideline on the chemistry of active substances)草案甘耿,這是EMA在2022年發(fā)布概念文件以后书蚪,正式推出這份關鍵指南的草案露该,公開征集意見拗胜,這次征集意見在2025年1月底結束羽址。
這份指南主要涵蓋概述麦回、介紹/背景胚茴、范圍互墓、法規(guī)基礎、數(shù)據(jù)主體和參考文獻共6部分蒋搜。鑒于這份指南內(nèi)容豐富篡撵,下面選擇重點介紹。
概述
這份指南將替代《Note for guidance on chemistry of new active substances》和《Chemistry of active substances》豆挽。
介紹/背景
因為活性成分申報資料采用ICH CTD格式育谬,因此這份指南在技術信息部分的編號都注明和ICH CTD對應的編號體系券盅,這樣可以便于讀者理解這些技術信息在申報資料中的位置。
范圍
這份指南主要涵蓋的內(nèi)容:
適用于現(xiàn)存/新的活性物質膛檀。其中锰镀,現(xiàn)存活性物質指的是已經(jīng)在歐盟市場上市的制劑中使用的活性物質。
針對現(xiàn)存活性物質和新的活性物質咖刃,技術要求差異在各個段落進行了清晰描述泳炉。
新的活性物質定義和歐盟申報資料2A卷第一章附錄1的定義保持一致。
不適用于臨床階段活性物質的信息申報嚎杨。
適用于采用傳統(tǒng)方法研發(fā)的活性物質花鹅,也適用于采用加強方法研發(fā)的活性物質。
如果企業(yè)采用加強方法開發(fā)活性物質枫浙,并開發(fā)設計空間呐缸,信息在CTD的3.2.S.2.2 到3.2.S.2.6部分提交技術信息。
提供的技術要求適用于采用ASMF或者CEP途徑申報的活性物質暖经。
法規(guī)基礎
這份指南需要和Directive 2001/83/EC的附錄1的(4)部分祈痢,以及Directive 2001/82/EC附錄1的(2)部分結合起來閱讀。
數(shù)據(jù)主體
在這部分缕沟,指南基本按照ICH CTD的S部分,依次介紹對活性物質技術信息的要求校惧。由于內(nèi)容很多葛暇,因此會選擇一些重點內(nèi)容來介紹。
※命名法(Nomenclature)竣篷,EMA指南建議申請人提供INN名尼软、藥典名稱、藥典批準名稱(BAN, DCF, DCIT, JAN, USAN)傲丹、
實驗室編號便透、IUPAC、CAS酬俯。
※生產(chǎn)工藝和工藝控制部分
指南建議申請人應該在生產(chǎn)工藝部分描述替代工藝航厚、返工工藝的技術信息。還需要在申報資料中詳細描述對活性物質或者中間體質量屬性影響重要的步驟锰蓬。
※中間體包括分離中間體和非分離中間體幔睬;這份指南要求每種非分離中間體都應通過在括號中表示化學結構來識別。
※替代工藝
這份指南對替代工藝進行了額外細節(jié)要求:對替代工藝的解釋和描述應與主要工藝的詳細程度相同芹扭。工藝描述應充分定義合成方法麻顶。但是,如果提出了替代步驟或溶劑舱卡,則應提供足夠的證據(jù)證明辅肾,如果通過CEP和/或ASMF提交數(shù)據(jù)队萤,則所獲得的材料(即活性物質或分離的中間體)的最終質量保持不變。
對于新的活性物質矫钓,如果遇到雜質分布的差異浮禾,應使用經(jīng)過驗證的方法對其進行分析,并證明它們在毒理學上是可接受的份汗。
※返工工藝
這份指南要求更具體盈电,細節(jié)如下:對進行常規(guī)返工的情況,應予以查明并說明其合理性伤刑。支持這一理由的任何數(shù)據(jù)都應在3.2.S.2.5中引用或提供探快。應清楚地描述返工方法,并應提供決定何時可以進行返工的標準入撇。
※回收工藝
根據(jù) ICH Q7 或歐盟 GMP 第 II 部分榨狐,溶劑、反應物晤裆、中間體或活性物質的回收(例如從母液或濾液中)被認為是可接受的咱漱。應在反應方案、工藝描述和/或流程框圖中明確指出停间,其中回收的物料被引入工藝中温履。使用回收物料的影響應成為總體風險評估的一部分,并特別包括關于雜質的討論(重點放在可能引起關注的雜質上叙棚,例如致突變雜質)亥护。建議僅在相同的工藝中使用回收的材料,最好在同一步驟中使用粗排,除非另有說明绎彪,否則應避免在最終制造步驟(例如化學轉化/沉淀/洗滌)中使用回收物料。
※重新加工
根據(jù)目前法規(guī)要求兽赁,重新加工工藝不能涵蓋在申報資料中状答。因為重新加工是采用一種新工藝。
※起始物料(Starting Material刀崖,SM)
對于活性物質(AS)的SM這個重點管理話題惊科,這份指南也提供了詳細介紹:
-這份指南為了厘清這個復雜話題,提供了一個流程圖:
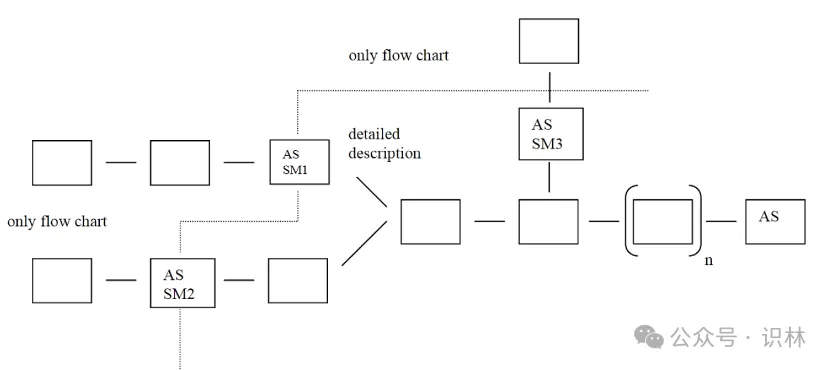
-對于亞硝胺這個熱點話題對SM的影響蒲跨,這份指南也提供了詳細介紹:應評估起始物料合成工藝中亞硝胺的形成和殘留風險(例如使用亞硝化劑译断、仲胺或叔胺等)。如果確定存在風險或悲,則應建立適當?shù)目刂撇呗裕ㄔ谄鹗嘉锪系臉藴手谢蛟诨钚晕镔|工藝的下游)孙咪,或者可以探索使用不同制造工藝的其他起始物料來源。
-對于動物源或者人源的起始物料巡语,如果在起始物料制造工藝中使用任何動物或人類來源的材料(例如由發(fā)酵翎蹈、酶淮菠、氨基酸等產(chǎn)生),則必須提供相關的病毒安全性和/或 TSE 數(shù)據(jù)荤堪。
-對于植物來源的起始物料合陵,根據(jù)隨后的合成步驟,關于地理來源办适、采集或培養(yǎng)地點玉唉、收獲和收獲后處理(例如使用的熏蒸劑)的信息可能是適當?shù)摹1匾獣r点溶,應考慮參考歐洲藥典關于草藥的通論1433婚拭。
※關鍵步驟管理
根據(jù)這份指南,如下步驟屬于關鍵步驟:
-多種成分的混合;
-相變和相分離步驟;
-溫度和 pH 值控制至關重要的步驟;
-引入基本分子結構元素或導致重大化學轉化的步驟;
-將大量雜質引入(或去除)活性物質的步驟比端。對于那些在活性物質中不受控制的雜質墅波,應在合理的范圍內(nèi)進行適當?shù)倪^程控制,并記錄在案;
-最后的純化步驟侵念。
※工藝研發(fā)
隨著QBD的理念推行帚棚,對于藥品申報資料中研發(fā)信息提交要求是越來越高。這份EMA指南也體現(xiàn)了這一趨勢捎虚。這里重點介紹對亞硝胺雜質的要求:應以EMA亞硝胺雜質問答文件為指導兆性,努力將工藝中形成亞硝胺的風險降至最低,其中列出了風險因素亮花,以及降低風險的措施和控制策略的原則副瀑。如果在合成工藝中不可避免地使用亞硝化劑,則應減少在適合亞硝胺形成的條件下與亞硝化化合物結合恋谭。如果形成亞硝胺的可能性是不可避免的,則應在適當?shù)目刂泣c實施控制策略挽鞠,并根據(jù)足夠的工藝知識疚颊,在必要時使用適當?shù)姆治龀绦騺碜C明其合理性。
※關于結構確證方面信认,這份EMA指南也更新了很多近幾年的技術要求材义。尤其對于多晶型,這份指南建議提供如下技術證據(jù)來展示是否存在多晶型:熔點(包括熱臺顯微鏡)嫁赏、固態(tài)紅外和近紅外光譜其掂、X射線粉末衍射、熱分析程序(如差示掃描量熱法 (DSC)潦蝇、熱重分析法 (TGA) 和差熱分析法 (DTA))款熬、 拉曼光譜、掃描電子顯微鏡攘乒、固體核磁共振波譜贤牛。
※分析方法驗證
這份EMA指南也要求針對亞硝胺雜質檢測方法驗證怀程,符合EMA亞硝胺問答的技術要求。
※活性物質的包材要求
EMA指南建議申請人涵蓋如下信息:應提供儲存容器密閉系統(tǒng)的簡要說明钝菲,包括規(guī)格和適當?shù)蔫b別測試遣备,以及建筑材料的詳情。如果儲存容器密閉系統(tǒng)對于確笔醭ィ活性物質的質量至關重要休贴,則應證明其適用性。根據(jù)活性物質的性質弓慨,可能需要證明的方面包括主要包裝材料的選擇钥陪、避光和/或防潮、與活性物質的相容性揣喻,包括對材料的吸附和浸出和/或任何安全方面你拗。對穩(wěn)定性數(shù)據(jù)的引用可以作為額外的支持信息,以證明擬議的集裝箱封閉系統(tǒng)的適用性汰畔。信息應涵蓋整個包裝括绣,包括內(nèi)包裝材料(例如聚乙烯袋)和次級包裝(例如纖維或金屬桶)。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 長風藥業(yè)
長風藥業(yè)  2024-11-27
2024-11-27
 15
15

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 賽柏藍
賽柏藍  2024-11-27
2024-11-27
 16
16

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 碧博生物
碧博生物  2024-11-27
2024-11-27
 18
18