
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 Insight數(shù)據(jù)庫
Insight數(shù)據(jù)庫  2024-07-31
2024-07-31
 503
503
7 月已經(jīng)接近尾聲。根據(jù) Insight 數(shù)據(jù)庫讥捧,截至發(fā)稿時圾篱,七月共有 11 款抗腫瘤新藥向 CDE 遞交上市申請。有 4 款新藥為首次申報上市搭肠,其中 3 款為 1 類新藥玫惧,它們均創(chuàng)造了某個細分領(lǐng)域的「首個」記錄。此外眯华,還有多款新藥遞交了新適應(yīng)癥的上市申請庞蠕。
精準生物:普基侖賽注射液作用機制:靶向 CD19 的 CAR-T
7 月 20 日,CDE 受理了精準生物的 1 類新藥普基侖賽注射液的首次新藥上市申請(受理號 CXSS2400075/6)拇掺,擬用于治療 3-21 歲患有 CD19 陽性復發(fā)/難治性急性淋巴細胞白血苍蚓(ALL)的患者。此前赚毫,該藥已被 CDE 納入突破性治療藥物品種和優(yōu)先審評品種踏靴。
普基侖賽注射液研究進度時光軸
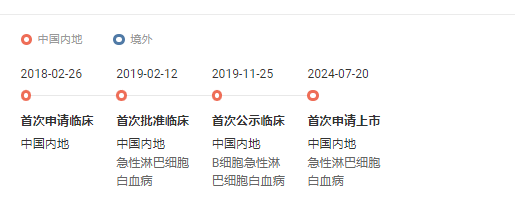
截圖來自:Insight 數(shù)據(jù)庫網(wǎng)頁版普基侖賽注射液(pCAR-19B)的 Ⅰ 期臨床試驗數(shù)據(jù)顯示,入組的 9 例患者均獲得完全緩解 (CR)筹柠,總體緩解率達 100%窜无,而且首次達到完全緩解的患者微小殘留病變(MRD)也均為陰性。此外适袜,臨床試驗中無劑量限制性毒性(DLT)以及治療相關(guān)死亡事件發(fā)生柄错,總體安全性和耐受性良好。
根據(jù) Insight 數(shù)據(jù)庫苦酱,目前國內(nèi)已有 3 款靶向 CD19 的 CAR-T 產(chǎn)品獲批上市售貌,分別為復星凱特的阿基侖賽、藥明巨諾的瑞基奧侖賽疫萤、合源生物的納基奧侖賽颂跨。此外,還有 2 款 CD19 靶向 CAR-T 已申報上市扯饶,分別為恒潤達生的潤達基奧侖賽和精準生物的普基侖賽注射液恒削。不過,從適應(yīng)癥來看帝际,精準生物的普基侖賽是國內(nèi)首款申報上市的治療兒童白血病的 CAR-T 產(chǎn)品蔓同。
正大天晴:庫莫西利膠囊作用機制:CDK2/4/6 抑制劑
7 月 19 日饶辙,CDE 受理了正大天晴 1 類新藥庫莫西利膠囊的首次新藥上市申請(受理號 CXHS2400055/6)蹲诀。該藥本次申報上市的適應(yīng)癥為:聯(lián)合氟維司群注射液用于既往內(nèi)分泌經(jīng)治的激素受體(HR)陽性斑粱、人表皮生長因子受體 2(HER2)陰性的局部晚期或轉(zhuǎn)移性乳腺癌患者。
庫莫西利膠囊研究進度時光軸

截圖來自:Insight 數(shù)據(jù)庫網(wǎng)頁版庫莫西利是一種 CDK2/4/6 抑制劑管员,它對 CDK2褂省、CDK4、CDK6 激酶有不同程度的抑制效果溅逃,并且對 CDK4 激酶具有較強的抑制能力葵稚。庫莫西利聯(lián)合氟維司群用于既往內(nèi)分泌經(jīng)治的 HR+/HER2- 局部晚期或轉(zhuǎn)移性乳腺癌的 III 期臨床試驗(NCT05375461)已完成期中分析。經(jīng)獨立數(shù)據(jù)監(jiān)查委員會(IDMC)審核少锭,該試驗已達到預設(shè)的主要終點洁席。
根據(jù) Insight 數(shù)據(jù)庫,正大天晴的庫莫西利是國內(nèi)首款谎躁、同時也是全球首款申報上市的 CDK2/4/6 抑制劑值唉。此外,還有多款 CDK2/4/6 抑制劑已在國內(nèi)進入臨床階段疮肿,包括同源康的 TY-0540港赂、石藥集團的 SYH2043、銳格醫(yī)藥的 RGT-419B家么、辰欣藥業(yè)的 WXWH-0240涉功、復星醫(yī)藥的 FN 1501。
和黃醫(yī)藥/Epizyme:氫溴酸他澤司他片作用機制:EZH2 甲基轉(zhuǎn)移酶抑制劑
7 月 4 日略吨,CDE 受理了和黃醫(yī)藥聯(lián)合申報的 5.1 類新藥氫溴酸他澤司他片的上市申請(JXHS2400046)集币,擬用于治療 EZH2 突變陽性且既往接受過至少兩種系統(tǒng)性治療的復發(fā)或難治性濾泡性淋巴瘤 (FL) 成人患者。該申請也已被 CDE 納入優(yōu)先審評翠忠。
他澤司他是由益普生旗下 Epizyme 公司開發(fā)的一款 EZH2 甲基轉(zhuǎn)移酶抑制劑惠猿。和黃醫(yī)藥通過戰(zhàn)略合作獲得了在中國內(nèi)地、香港负间、澳門和臺灣進行他澤司他的研究偶妖、開發(fā)、生產(chǎn)以及商業(yè)化的權(quán)益政溃。
氫溴酸他澤司他片研究進度時光軸
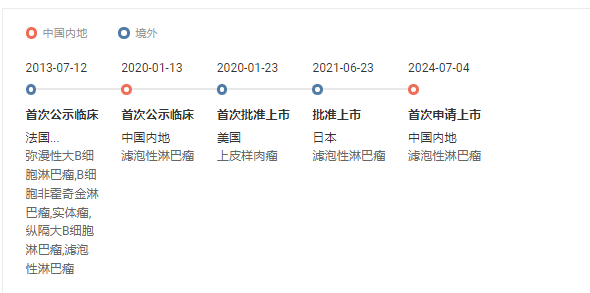
截圖來自:Insight 數(shù)據(jù)庫網(wǎng)頁版據(jù)悉本次在中國的上市申請得到了一項在中國開展的多中心趾访、開放標簽的 II 期橋接試驗,以及 Epizyme 在中國以外地區(qū)開展的臨床研究的支持董虱。其中扼鞋,在中國開展的 II 期橋接研究共納入 42 名患者,研究的主要目的是評估他澤司他用于治療伴有 EZH2 突變的復發(fā)/難治性 FL 患者的客觀緩解率 (ORR)愤诱。
根據(jù) Insight 數(shù)據(jù)庫云头,他澤司他是首個在國內(nèi)申報上市的 EZH2 抑制劑。此外,還有多款 EZH2 抑制劑已在國內(nèi)進入臨床锁澡,分別為恒瑞醫(yī)藥的 SHR2554埋吊、信諾維的 XNW 5004、海和藥物的 HH 2853神翁、中科拓苒的 TR 115愈苛、輝瑞的 Mevrometostat。
羅氏:阿替利珠單抗注射液(皮下注射)作用機制:PD-L1 抑制劑
7 月 27 日誓贝,CDE 受理了羅氏阿替利珠單抗注射液(皮下注射)的上市申請(受理號:JXSS2400063/4)伶门。全球范圍內(nèi),該藥已經(jīng)在去年 8 月剑瞻、今年 1 月陸續(xù)在英國棵擂、歐盟獲批上市。
阿替利珠單抗注射液(皮下注射)研究進度時光軸
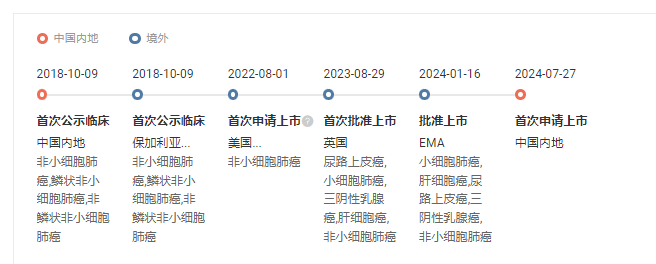
截圖來自:Insight 數(shù)據(jù)庫網(wǎng)頁版皮下(SC)注射劑的治療優(yōu)勢在于其給藥便捷性舅兑,羅氏的阿替利珠單抗皮下注射版僅需約 7 分鐘即可完成注射眨仪,而原本的靜脈(IV)輸注則需要 30 - 60 分鐘。其申報并獲批之后甜杰,適應(yīng)癥也將適用于此前靜脈制劑已獲批的所有適應(yīng)癥柑爸,涵蓋肺癌、膀胱癌盒音、乳腺癌和肝癌表鳍。
此前,阿替利珠單抗皮下注射劑在英國的獲批是基于 Ib/III 期臨床試驗 IMscin001(NCT03735121)的結(jié)果祥诽。這項研究旨在比較既往鉑類治療失敗的局部晚期或轉(zhuǎn)移性 NSCLC 患者中阿替利珠單抗皮下制劑與靜脈注射的藥代動力學譬圣、安全性和有效性。數(shù)據(jù)顯示雄坪,皮下注射和靜脈輸注組兩者的 ORR(11.8% vs 9.7%)及中位 PFS(2.8 個月 vs 2.9 個月)相當厘熟,且在安全性方面也呈現(xiàn)一致性。
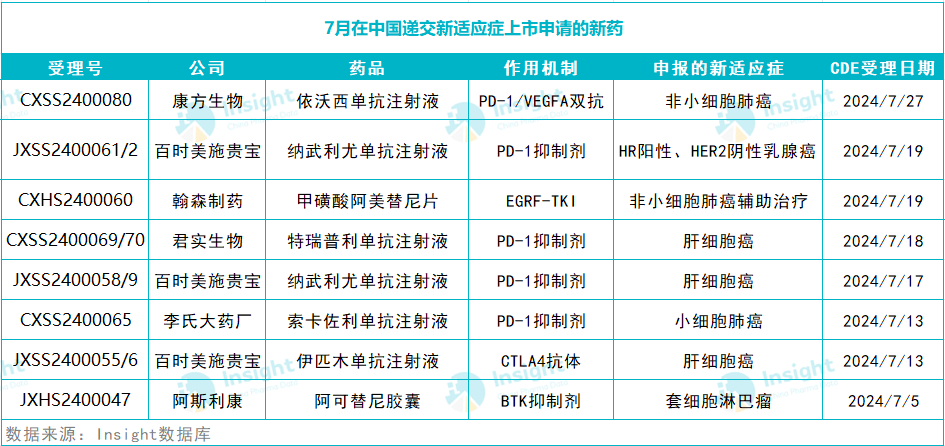
除了上述首次申報上市的新藥维哈,7 月還有多款新藥遞交了新適應(yīng)癥上市申請(詳見下表)绳姨。限于篇幅,本文不再一一介紹阔挠。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 長風藥業(yè)
長風藥業(yè)  2024-11-27
2024-11-27
 16
16

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 賽柏藍
賽柏藍  2024-11-27
2024-11-27
 17
17

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 碧博生物
碧博生物  2024-11-27
2024-11-27
 18
18