
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 細(xì)胞治療前沿
細(xì)胞治療前沿  2024-08-02
2024-08-02
 445
445
當(dāng)?shù)貢r間7月31日蔓嚷,Umoja Biopharma宣布美國FDA已批準(zhǔn)其在研CD19靶向原位生成(in-situ generated)CAR-T細(xì)胞療法UB-VV111的IND申請徽探,用以治療血液惡性腫瘤。Umoja預(yù)計(jì)將在2024年底前啟動1期試驗(yàn)并進(jìn)行首位患者給藥悦昵。根據(jù)新聞稿歧斟,UB-VV111可能是血液學(xué)人體試驗(yàn)中首個原位生成CD19靶向CAR-T細(xì)胞療法纯丸。
Umoja基于其專有的第三代慢病毒載體技術(shù),制造了VivoVec基因遞送產(chǎn)品静袖。VivoVec引入身體后觉鼻,患者能夠制造自己的抗癌CAR-T細(xì)胞俊扭。這些細(xì)胞通過RACR / CAR系統(tǒng)進(jìn)行基因重組,使臨床醫(yī)生能夠控制其功能坠陈。
這種現(xiàn)成的技術(shù)避免了體外細(xì)胞治療的復(fù)雜性和延遲性贝泞,降低了治療費(fèi)用,同時在更適合傳統(tǒng)CAR-T體外療法的環(huán)境中提供體外適用性蘸错。
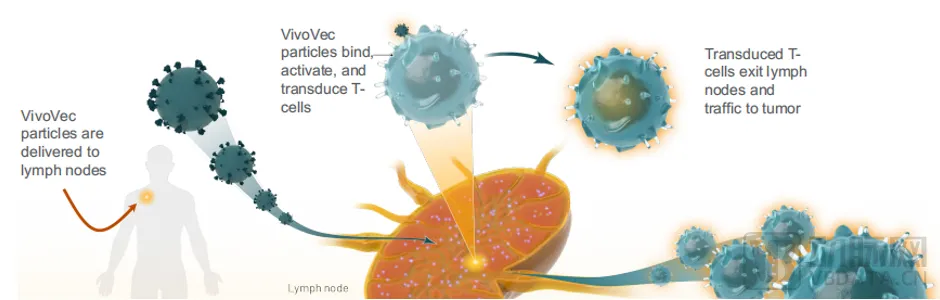
▲ VivoVec平臺運(yùn)作過程牡罚,圖源Umoja
UB-VV111是一款通過VivoVec平臺開發(fā)的體內(nèi)CAR-T細(xì)胞療法。UB-VV111包含一個表面經(jīng)過工程化的病毒包膜苇恤,以及編碼CD19靶向CAR和雷帕霉素激活細(xì)胞因子受體(RACRTM)的轉(zhuǎn)基因淡碟,旨在于患者體內(nèi)擴(kuò)增UB-VV111工程化CAR-T細(xì)胞。該療法是VivoVec基因遞送平臺進(jìn)入臨床的首個管線供窝。
UB-VV111的1期研究是一項(xiàng)劑量遞增和驗(yàn)證研究一步,旨在評估UB-VV111的安全性、耐受性和臨床抗腫瘤活性百涕。該研究將招募復(fù)發(fā)/難治性大B細(xì)胞淋巴瘤(LBCL)和慢性淋巴細(xì)胞白血猜事(CLL)患者,包括CAR-T初治患者和經(jīng)治患者斩角。
2024年1月夷呐,Umoja和艾伯維(AbbVie)達(dá)成兩項(xiàng)總額潛在超過14億美元的獨(dú)家選擇權(quán)和許可協(xié)議,利用Umoja專有的VivoVec平臺伶丐,在腫瘤學(xué)領(lǐng)域(以及潛在免疫學(xué)領(lǐng)域)開發(fā)多種原位生成的CAR-T細(xì)胞療法候選藥物悼做。
目前有許多醫(yī)藥公司正在進(jìn)行體內(nèi)細(xì)胞療法的開發(fā),包括Moderna哗魂、Capstan Therapeutics肛走、Myeloid Therapeutics和Interius BioTherapeutics,其中Interius本月初已獲得在澳大利亞啟動人體試驗(yàn)的批準(zhǔn)录别。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 長風(fēng)藥業(yè)
長風(fēng)藥業(yè)  2024-11-27
2024-11-27
 14
14

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 賽柏藍(lán)
賽柏藍(lán)  2024-11-27
2024-11-27
 15
15

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 碧博生物
碧博生物  2024-11-27
2024-11-27
 16
16
 熱門資訊
熱門資訊