
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 求實(shí)藥社
求實(shí)藥社  2024-08-07
2024-08-07
 343
343
7月30日晚間焚惰,香雪制藥公告稱居然,公司子公司香雪生命科學(xué)申報的TAEST16001注射液被國家藥品監(jiān)督管理局藥品審評中心納入突破性治療品種名單轩丁。
這是中國首個獲得新藥研究(IND)許可并進(jìn)入臨床試驗(yàn)的TCR-T細(xì)胞療法新藥详恼。
受此利好影響他嚷,香雪制藥5個交易日內(nèi)錄得3個漲停默刚,累計漲幅為110.95%甥郑,累計換手率為94.13%。
截至今日11:14荤西,該股今日成交量1.38億股澜搅,成交金額8.72億元,換手率20.98%饲肪。最新A股總市值達(dá)47.15億元屋犯,A股流通市值46.87億元。
根據(jù)公開信息塔苦,香雪生命科學(xué)致力于TCR領(lǐng)域的細(xì)胞免疫治療產(chǎn)品與技術(shù)的研究滑期,并集中力量開發(fā)新一代特異性T細(xì)胞的過繼性免疫治療腫瘤藥物,成為TCR-T細(xì)胞免疫療法領(lǐng)域的領(lǐng)軍企業(yè)医窖。
TCR-T細(xì)胞免疫療法
細(xì)胞免疫療法是生物醫(yī)藥產(chǎn)業(yè)中一個重要的千億級分支账阳。T細(xì)胞受體嵌合型T細(xì)胞(TCR-T),是一種細(xì)胞免疫療法蔽树,也是過繼細(xì)胞轉(zhuǎn)移療法(ACT)的一種狡氏。它通過篩選和鑒定能特異性結(jié)合靶抗原的TCR序列,利用基因工程改造來自患者外周血的T細(xì)胞绷坠,然后將改造后的T細(xì)胞回輸至患者體內(nèi)洛惹。這樣唯乃,T細(xì)胞就能特異性識別并殺傷表達(dá)抗原的腫瘤細(xì)胞泥天,從而達(dá)到治療腫瘤的目的。
隨著醫(yī)學(xué)科技的飛速發(fā)展和腫瘤治療需求的日益增長壳影,TCR-T(T細(xì)胞受體基因修飾的T細(xì)胞)治療領(lǐng)域的競爭日益激烈拱层。這一領(lǐng)域吸引了眾多科研機(jī)構(gòu)、生物醫(yī)藥公司以及投資者的目光宴咧,成為了生物醫(yī)藥產(chǎn)業(yè)新的熱點(diǎn)和前沿陣地根灯。
據(jù)不完全統(tǒng)計,國內(nèi)布局TCR-T細(xì)胞療法的企業(yè)有17家掺栅,其中大部分都已經(jīng)進(jìn)入臨床研究階段烙肺。
國內(nèi)布局TCR-T療法的企業(yè)及其管線進(jìn)展
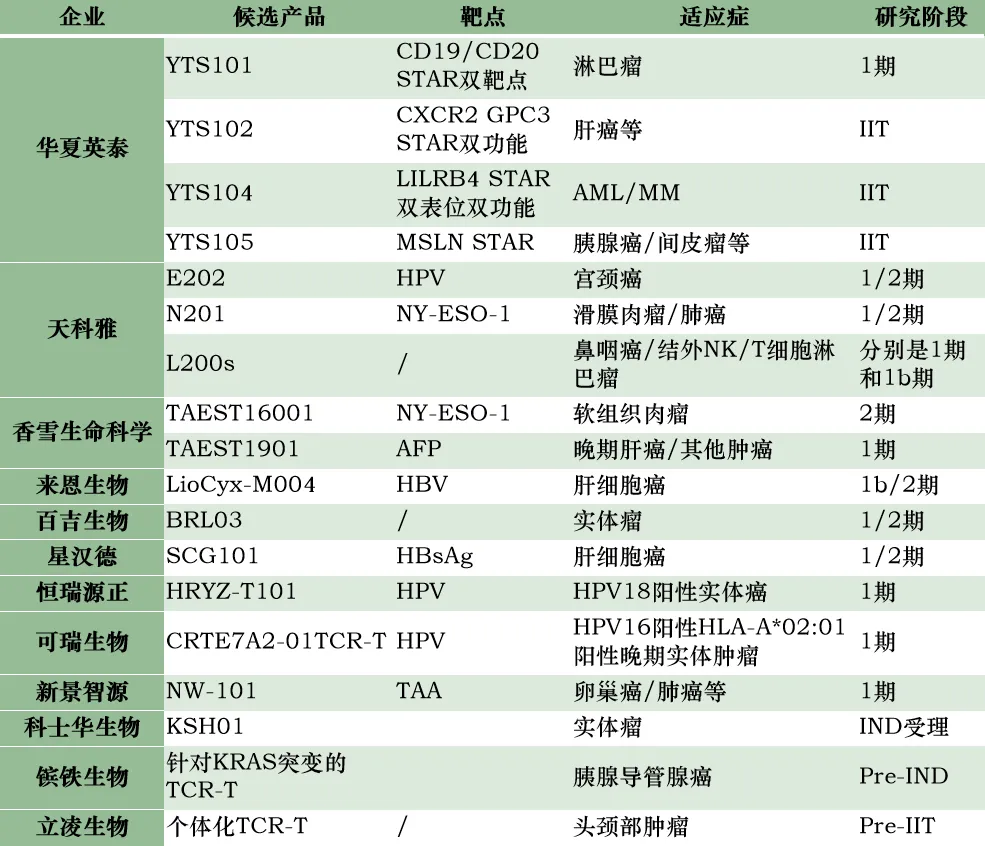
TCR-T技術(shù)以其高靶向性和低免疫原性在細(xì)胞免疫治療領(lǐng)域具有獨(dú)特的優(yōu)勢。隨著技術(shù)的不斷進(jìn)步和創(chuàng)新,TCR-T療法有望在未來成為腫瘤治療的重要手段之一桃笙,為更多患者帶來希望和治愈的可能氏堤。
盡管目前尚未有TCR-T產(chǎn)品在全球市場上市,但預(yù)計未來三年將是TCR-T產(chǎn)品推出市場的關(guān)鍵時期搏明。
國內(nèi)首個TCR-T細(xì)胞治療新藥
香雪生命科學(xué)此次申報的TAEST16001注射液是基于其TCR-T細(xì)胞產(chǎn)品開發(fā)和生產(chǎn)體系研發(fā)的首個TCR-T細(xì)胞治療藥物鼠锈。這不僅是該公司,也是中國首個獲得新藥研究(IND)批準(zhǔn)并進(jìn)入臨床試驗(yàn)階段的TCR-T細(xì)胞產(chǎn)品星著。
該藥品的首個適應(yīng)癥是針對攜帶HLA-A*02:01且表達(dá)NY-ESO-1抗原的晚期軟組織肉瘤患者购笆。臨床試驗(yàn)數(shù)據(jù)顯示,TAEST16001注射液對于目前缺乏有效治療方案的軟組織肉瘤患者顯示出了突出的臨床治療效果良稽。
到目前為止挥挚,TAEST16001注射液已經(jīng)完成了I期和II期臨床試驗(yàn)的第一階段,其安全性和有效性的臨床研究結(jié)果與國際知名制藥企業(yè)針對相同靶點(diǎn)產(chǎn)品的臨床結(jié)果相似商麻,獲得了國際同行的認(rèn)可以及國際頂尖學(xué)術(shù)會議的認(rèn)證筝贮。
中國國家藥監(jiān)局藥品審評中心此次同意將TAEST16001列為具有突破性和顛覆性創(chuàng)新的藥物,這一決定將加速其關(guān)鍵性臨床試驗(yàn)和有條件批準(zhǔn)上市的進(jìn)程苗隔,有望使其成為中國首個獲批的TCR-T細(xì)胞治療創(chuàng)新藥物芙棚。
香雪制藥近日發(fā)布公告,介紹了其TCR-T主要產(chǎn)品TAEST16001注射液的開發(fā)情況溺六。
臨床研究進(jìn)展方面:
TAEST16001是中國首個獲得IND批件并開展臨床研究的TCR-T細(xì)胞產(chǎn)品数芝。
首個適應(yīng)癥為HLA-A*02:01陽性且表達(dá)NY-ESO-1抗原的晚期軟組織肉瘤。
已完成I期和II期臨床試驗(yàn)第一階段伪给,觀察到顯著臨床意義的療效和可控的安全性改宅。
其治療方式是患者在環(huán)磷酰胺(15 mg/kg/day × 3 days)聯(lián)合氟達(dá)拉濱(20 mg/m2/day × 3 days)降低淋巴細(xì)胞清除劑量后接受TAEST16001細(xì)胞輸注,并且在過繼轉(zhuǎn)移后用低劑量的白介素-2注射維持TCR-T細(xì)胞盲如。用氟達(dá)拉濱和環(huán)磷酰胺進(jìn)行劑量減少的淋巴清除和使用低劑量的IL-2可以在不降低療效的情況下將毒性降至最低姓迅。
學(xué)術(shù)認(rèn)可度方面:
I期臨床試驗(yàn)結(jié)果在2022年ASCO年會上進(jìn)行口頭專題匯報。
臨床試驗(yàn)數(shù)據(jù)顯示腫瘤客觀緩解率達(dá)到41.7%俊马。
2023年8月丁存,I期臨床試驗(yàn)結(jié)果發(fā)表在Cell Reports Medicine期刊上。
2024年6月柴我,II期臨床試驗(yàn)階段性總結(jié)數(shù)據(jù)再次入選ASCO年會解寝。
中成藥業(yè)務(wù)增勢強(qiáng)勁 營收同比增長
香雪制藥4月底發(fā)布的2023年年報顯示,公司實(shí)現(xiàn)營業(yè)收入22.99億元艘儒,同比增長5.13%聋伦;歸屬于上市公司股東的凈利潤-3.89億元,虧損同比顯著收窄界睁。其中觉增,醫(yī)藥制造業(yè)務(wù)板塊實(shí)現(xiàn)營業(yè)收入8.25億元,同比增長114.63%;中藥材業(yè)務(wù)營業(yè)收入7.45億元逾礁,同比下降19.43%卵佛。
2023年度,公司通過優(yōu)化內(nèi)部管理议乐、大力拓展省外市場等方式努力降低市場環(huán)境對公司的影響奥憎,在原子公司湖北天濟(jì)藥業(yè)有限公司營業(yè)收入未納入合并報表范圍的情形下,公司合并營業(yè)收入總體保持了穩(wěn)定忙坡,其中核心業(yè)務(wù)中成藥板塊營業(yè)收入增長超100%眉藤。同時,雖然公司總體凈利潤仍處于虧損狀態(tài)邪笆,但已呈現(xiàn)逐步收窄態(tài)勢琴邻。
2023年,公司中成藥業(yè)務(wù)實(shí)現(xiàn)營業(yè)收入7.92億元熏尉,同比增長125.99%赂燎。
未來中成藥事業(yè)部在繼續(xù)深耕、鞏固現(xiàn)有市場的同時潜路,推動公司的其他品牌中藥產(chǎn)品繼續(xù)放量增長向膏。為實(shí)現(xiàn)上述目標(biāo),中成藥事業(yè)部一方面將深耕學(xué)術(shù)研究罚午,加強(qiáng)醫(yī)療機(jī)構(gòu)的合作逞迟,開展現(xiàn)有產(chǎn)品深度研究及二次開發(fā)工作,并挖掘潛力產(chǎn)品恕沫,為未來發(fā)展提供全新增長點(diǎn)监憎;另一方面,還將聯(lián)動上游原料供應(yīng)及生產(chǎn)制造部門婶溯,實(shí)現(xiàn)產(chǎn)供銷協(xié)同發(fā)展鲸阔。
年報顯示,公司短期及長期借款財務(wù)費(fèi)用2.41億元迄委,亟待現(xiàn)金流緩解償債壓力褐筛。根據(jù)政府公開信息,香雪制藥云埔廠區(qū)已列入2024年廣州市黃埔區(qū)政府投資收儲和基本建設(shè)項(xiàng)目投資計劃跑筝,收回國有土地60569㎡死讹,計劃總投資10億元瞒滴。香雪制藥內(nèi)部人士表示曲梗,該項(xiàng)目有望大幅化解公司債務(wù)風(fēng)險。
結(jié) 語
從行業(yè)政策角度來看妓忍,國家近年來對生物醫(yī)藥行業(yè)的關(guān)注和支持不斷增強(qiáng)虏两,國產(chǎn)創(chuàng)新藥物正面臨著前所未有的發(fā)展機(jī)會。
對香雪生命科學(xué)來說,隨著TAEST16001注射液研發(fā)進(jìn)展的深入充贿,該產(chǎn)品一旦獲批上市锥桐,不僅有望為公司帶來新的增長機(jī)遇,也將為中國乃至全球的腫瘤患者提供新的治療方案差炮。
華鑫證券在其行業(yè)周報中指出鳄砸,2024年將是醫(yī)藥行業(yè)實(shí)現(xiàn)驅(qū)動力轉(zhuǎn)換、依靠新技術(shù)的應(yīng)用戴砍,逐步擺脫供給端的“內(nèi)卷”現(xiàn)象的關(guān)鍵時期惧圆,并維持對醫(yī)藥行業(yè)的“推薦”評級。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 長風(fēng)藥業(yè)
長風(fēng)藥業(yè)  2024-11-27
2024-11-27
 7
7

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 賽柏藍(lán)
賽柏藍(lán)  2024-11-27
2024-11-27
 6
6

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 碧博生物
碧博生物  2024-11-27
2024-11-27
 8
8
 熱門資訊
熱門資訊