
 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2021-11-22
2021-11-22
 2183
2183
今日许蓖,默沙東(MSD)宣布,美國FDA已經(jīng)批準(zhǔn)其重磅PD-1抑制劑Keytruda作為輔助療法芬阀,在手術(shù)治療之后稼掏,治療早期腎細(xì)胞癌患者熊倡。這些患者具有中高度或高度疾病復(fù)發(fā)風(fēng)險搅谆。新聞稿指出,這是首款獲得FDA批準(zhǔn)輔助治療腎細(xì)胞癌的免疫療法讳帆,有望改變這些患者的標(biāo)準(zhǔn)治療模式阀温。

腎細(xì)胞癌是最常見的腎癌類型,據(jù)估計置狠,在2020年全球有超過43萬例新確診病例啡笑,超過17萬人因此去世。多達(dá)40%的局部腎細(xì)胞癌初次手術(shù)治療后會發(fā)生轉(zhuǎn)移黄鳍。轉(zhuǎn)移性疾病患者的預(yù)后較差推姻,5年生存率約為13%。
這一批準(zhǔn)是基于一項(xiàng)關(guān)鍵性3期臨床試驗(yàn)的結(jié)果框沟。試驗(yàn)結(jié)果顯示藏古,Keytruda與安慰劑相比,將患者的疾病復(fù)發(fā)或死亡風(fēng)險降低32%(HR=0.68 [95% CI忍燥,0.53-0.87]拧晕;p=0.0010)。兩組的中位無進(jìn)展生存期均尚未達(dá)到梅垄。
此外厂捞,在今年ESMO大會上公布的數(shù)據(jù)顯示,Keytruda在降低患者死亡風(fēng)險方面也表現(xiàn)出良好的趨勢队丝,與安慰劑相比降低患者死亡風(fēng)險46%靡馁。這一試驗(yàn)將繼續(xù)評估患者的總生存期。
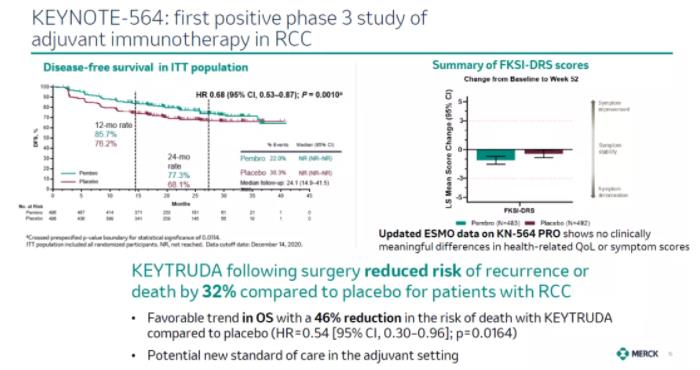
▲Keytruda在關(guān)鍵性3期臨床試驗(yàn)中的結(jié)果(圖片來源:默沙東官網(wǎng))
“早期腎細(xì)胞癌的輔助治療選擇有限机久,Keytruda的獲批為復(fù)發(fā)風(fēng)險較高的患者提供了一個新治療選擇臭墨。”哈佛大學(xué)醫(yī)學(xué)院的醫(yī)學(xué)教授Toni K. Choueiri博士說蕴莉,“它有潛力成為輔助治療合適患者的新標(biāo)準(zhǔn)治療翰蛔。”
使用免疫療法治療早期癌癥患者仓突,減少疾病復(fù)發(fā),提高癌癥治愈率焦赋,是多家醫(yī)藥公司的研究方向绊削。默沙東公司就有超過120項(xiàng)臨床試驗(yàn)在檢驗(yàn)Keytruda作為輔助療法,或手術(shù)前的新輔助療法鲁磺,治療多種癌癥類型的效果制棉。在2021年之前,免疫療法只獲得FDA批準(zhǔn)用于治療早期黑色素瘤患者跋园。然而在今年诸晃,多款免疫療法得到FDA的批準(zhǔn)狼憋,在治療早期三陰性乳腺癌、尿路上皮癌益命、食管癌和胃食管連接部癌奖瞳、和非小細(xì)胞肺癌方面取得了突破。
我們期待免疫療法在早期癌癥方面的應(yīng)用與更為有效的癌癥早篩手段相結(jié)合箕慧,讓更多患者能夠更早獲得診斷服球,更早獲得有效治療,走上治愈之路颠焦。

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 0
0

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 2
2

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-11-25
2024-11-25
 2
2
 熱門資訊
熱門資訊