
 產業(yè)資訊
產業(yè)資訊
 醫(yī)藥魔方
醫(yī)藥魔方  2024-08-09
2024-08-09
 254
254
8月7日型肥,諾和諾德在公布2024年H1業(yè)績時透露,口服司美格魯肽Rybelsus(25mg)的減重III期OASIS 4研究已成功完成蝠咆。

該研究共納入了307例體重指數(BMI)≥27kg/m2且伴有至少一種體重相關并發(fā)癥(高血壓踊东、血脂異常、阻塞性睡眠呼吸暫透詹伲或心血管疾舱⒊帷)或BMI≥30kg/m2的超重或肥胖成人受試者,評估了口服司美格魯肽(25mg菊霜,每日1次)與安慰劑的減重效果和安全性坚冀。研究持續(xù)72周,包括1周篩選期鉴逞、64周治療期和7周隨訪期记某。
口服司美格魯肽組受試者在64周內按照劑量遞增的方式接受治療,其中第0-4周服用3mg劑量构捡,第5-8服用7mg劑量液南,第9-12周服用14mg劑量壳猜,第13-64周服用25mg劑量。研究的主要終點為治療期內受試者的體重相對于基線的百分比變化和體重下降至少5%的受試者數量滑凉。
受試者的體重基線為105.9kg忿震。結果顯示,口服司美格魯肽組受試者的體重下降了13.6%贤丐,而安慰劑組這一比例為2.2%狠楞。如果所有受試者均堅持完成了治療,則口服司美格魯肽組的體重降幅為16.6%辙求,安慰劑組降幅為2.7%。
此外怔赤,在研究中弟诲,口服司美格魯肽顯示出了良好的安全性和耐受性。此前分较,口服司美格魯肽已有一項減重III期研究達到主要終點徘伯。2023年5月,口服司美格魯肽50mg的減重III期OASIS 1研究順利完成南垦。結果顯示就考,治療68周后,司美格魯肽組患者的體重下降了17.4%跛鸵,分別有89.2%贯卦、74.7%、58.5%和37.2%的患者體重至少下降5%焙贷、10%撵割、15%和20%。
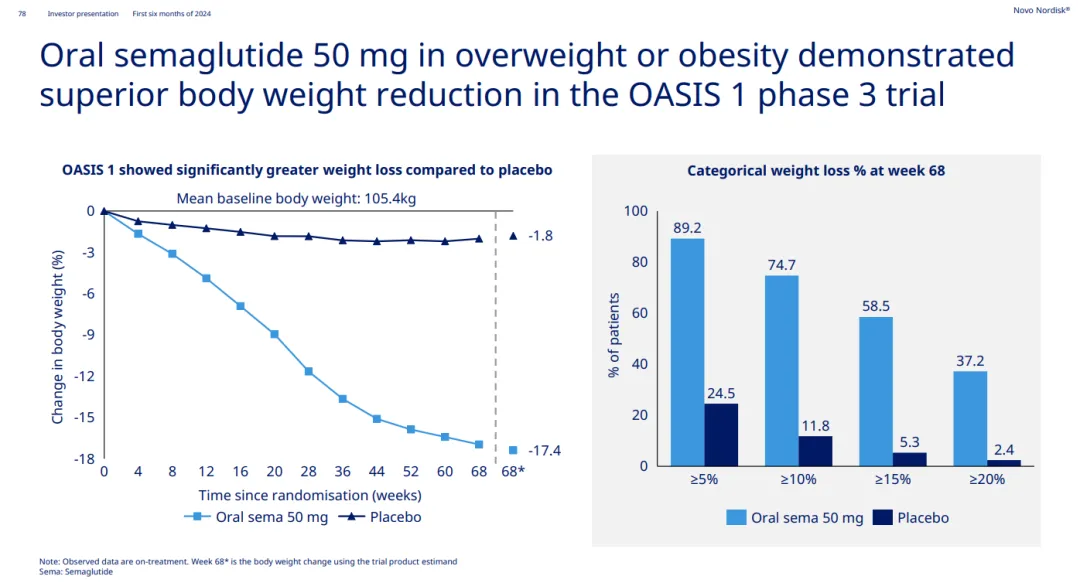
OASIS 1研究主要終點數據(來源:諾和諾德2024H1 PPT)
口服司美格魯肽(7mg和14mg)于2019年9月在美國獲批上市辙芍,用于作為飲食和運動的輔助手段啡彬,幫助改善成人2型糖尿病患者的血糖控制。截至目前故硅,口服司美格魯肽已完成13項PIONEER系列研究(1-12庶灿,PLUS)和兩項OASIS系列研究(1和4)。
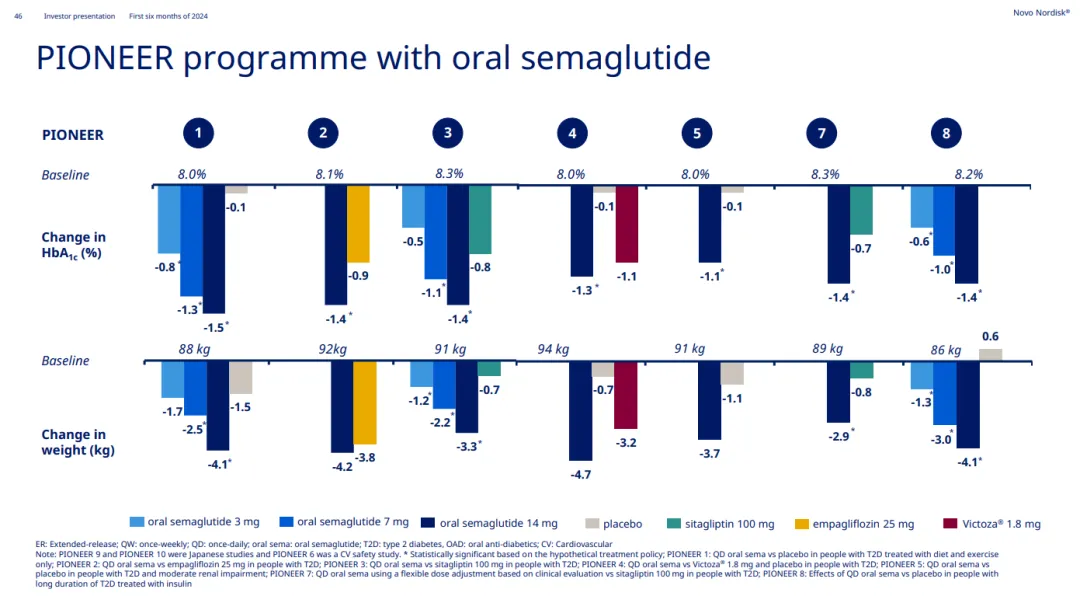
PIONEER 1-8研究數據(來源:諾和諾德2024H1 PPT)
其中吃衅,PIONEER PLUS研究評估了口服司美格魯肽14/25/50mg的降糖效果往踢。今年7月,基于PIONEER PLUS研究的積極結果捐晶,口服司美格魯肽(25/50mg)的上市申請已獲歐洲藥品管理局(EMA)人用藥品委員會(CHMP)推薦批準菲语。諾和諾德預計歐盟委員會(EC)將在兩個月內做出批準決定。
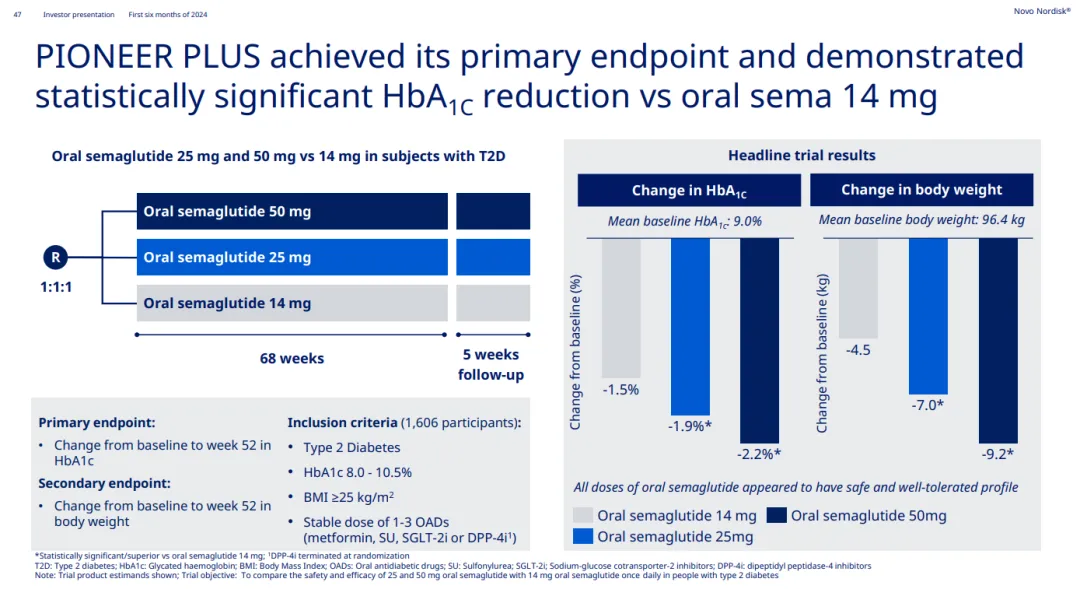
PIONEER PLUS研究數據(來源:諾和諾德2024H1 PPT)除了OASIS 4研究的積極結果外惑灵,諾和諾德也在財報中透露了接下來司美格魯肽的一些關鍵節(jié)點:
2024Q3在中國遞交司美格魯肽1mg治療慢性腎采缴稀(CKD)的新適應癥上市申請伟蕾;
2024Q3公布司美格魯肽1mg治療外周動脈疾病(PAD)的III期STRIDE研究結果畦肉;
2024Q4在中國和歐盟遞交IcoSema(Icodec+司美格魯肽)的上市申請配昼;
2024Q4公布口服司美格魯肽14mg改善心血管結局(CVOT)的III期SOUL研究結果;
2024Q4公布司美格魯肽7.2mg治療肥胖的III期STEP UP研究結果礁姿;
2024Q4公布CagriSema(Cagrilintide+司美格魯肽)的首個III期研究結果如癌;
2024Q4公布司美格魯肽2.4mg治療代謝功能障礙相關脂肪性肝炎(MASH)的III期ESSENCE研究結果。

 產業(yè)資訊
產業(yè)資訊
 凱萊英藥聞
凱萊英藥聞  2024-11-22
2024-11-22
 107
107

 產業(yè)資訊
產業(yè)資訊
 動脈網
動脈網  2024-11-22
2024-11-22
 103
103

 產業(yè)資訊
產業(yè)資訊
 藥明康德
藥明康德  2024-11-22
2024-11-22
 116
116