
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 凱萊英藥聞
凱萊英藥聞  2024-08-30
2024-08-30
 316
316
近日景顷,嘉和生物發(fā)布2024年上半年業(yè)績(jī):報(bào)告期內(nèi)趟章,總收益約為人民幣14.5百萬(wàn)元嘱杆,主要?dú)w因于為付費(fèi)服務(wù)合約項(xiàng)下的客戶提供研究及制造服務(wù)泽谨;研發(fā)開(kāi)支約為人民幣109.7百萬(wàn)元碧囊,同比較少51.2%倡鲸,主要由于員工福利及新藥研發(fā)費(fèi)及臨床試驗(yàn)開(kāi)支減少供嚎;報(bào)告期內(nèi),全面虧損總額約為人民幣132.3百萬(wàn)元峭状,同比減少52.1%克滴。
截至2024年6月底,結(jié)余10.27億人民幣現(xiàn)金优床,足夠支持公司未來(lái)5年的穩(wěn)定運(yùn)營(yíng)劝赔。
公司簡(jiǎn)介
嘉和生物藥業(yè)成立于2007年,是一家創(chuàng)新驅(qū)動(dòng)型生物制藥公司胆敞;目前已擁有強(qiáng)大的產(chǎn)品管線诸痢,涵蓋全球前三大腫瘤(乳腺癌、肺癌酝梧、胃腸道腫瘤)以及血液腫瘤斜回。目前簇寻,公司成功搭建全球同類首創(chuàng)(FIC)/差異化T細(xì)胞接合器(T-cell Engager)免疫腫瘤雙/多特異抗體及雙抗體偶聯(lián)藥物(雙抗ADC)研發(fā)平臺(tái)。
嘉和著力打造一個(gè)具備藥物創(chuàng)新研發(fā)凳贰、臨床前研究市通、臨床開(kāi)發(fā)、注冊(cè)以及CMC開(kāi)發(fā)的創(chuàng)新性哗励、平臺(tái)型苫瘾、一體化公司,能夠早在開(kāi)發(fā)過(guò)程就發(fā)現(xiàn)并解決潛在的臨床界橱、制造與商業(yè)化及臨床壁壘問(wèn)題湃彻,從而專注于最有臨床活性、效率及具商業(yè)可行性藥物的分子研究骆喉。
交易合作
本月初诚凰,嘉和生物宣布與TRC 2004達(dá)成許可及股權(quán)協(xié)議,將GB261除大中華區(qū)(中國(guó)大陸哀澈、香港牌借、澳門及臺(tái)灣)外全球權(quán)益授權(quán)給TRC 2004。根據(jù)協(xié)議條款割按,嘉和生物將獲得:(1)數(shù)量可觀的股權(quán)膨报;(2)數(shù)千萬(wàn)美元的首付款;(3)高達(dá)4.43億美元的里程碑付款适荣;(4)凈銷售額個(gè)位數(shù)到雙位數(shù)百分比的分層特許權(quán)使用費(fèi)现柠。
嘉和通過(guò)在海外成立新公司的BD模式,被稱為New Company(“NewCo”)弛矛;即將公司核心產(chǎn)品的海外權(quán)利授權(quán)給海外成立的新公司够吩,同時(shí)引入海外基金,搭建國(guó)際化管理團(tuán)隊(duì)丈氓,以公司海外上市或被并購(gòu)實(shí)現(xiàn)退出周循。此前,國(guó)內(nèi)還有幾家藥企已成功采用這一模式出海万俗,其中包括恒瑞醫(yī)藥將GLP-1類創(chuàng)新藥HRS-7535湾笛、HRS9531、HRS-4729在除大中華區(qū)以外的全球范圍內(nèi)開(kāi)發(fā)辆泄、生產(chǎn)和商業(yè)化的獨(dú)家權(quán)利有償許可給美國(guó)Hercules公司蟋真;作為回報(bào),獲得Hercules約19.9%股權(quán)和最高超60億美元的相關(guān)付款等铐坠】崴康諾亞將兩款雙抗新藥CM512、CM536的大中華區(qū)外全球權(quán)益授權(quán)給Belenos Biosciences遂涛;作為回報(bào)掺胖,康諾亞獲1500萬(wàn)美元的首付款和近期付款冲雾,而一橋香港(康諾亞全資附屬公司)將獲得Belenos約30.01%的股權(quán)。
嘉和生物近年來(lái)的交易情況

重點(diǎn)藥物介紹
截至2024年6月30日盾叭,嘉和生物已完成5個(gè)PCC分子開(kāi)發(fā)奥怪,均為全球首創(chuàng)/同類最佳的雙/多特異性抗體項(xiàng)目;在成功實(shí)現(xiàn)企業(yè)的輕資產(chǎn)模式轉(zhuǎn)型后肄高,公司將持續(xù)加速臨床推進(jìn)及多樣化市場(chǎng)拓展盘瞧。
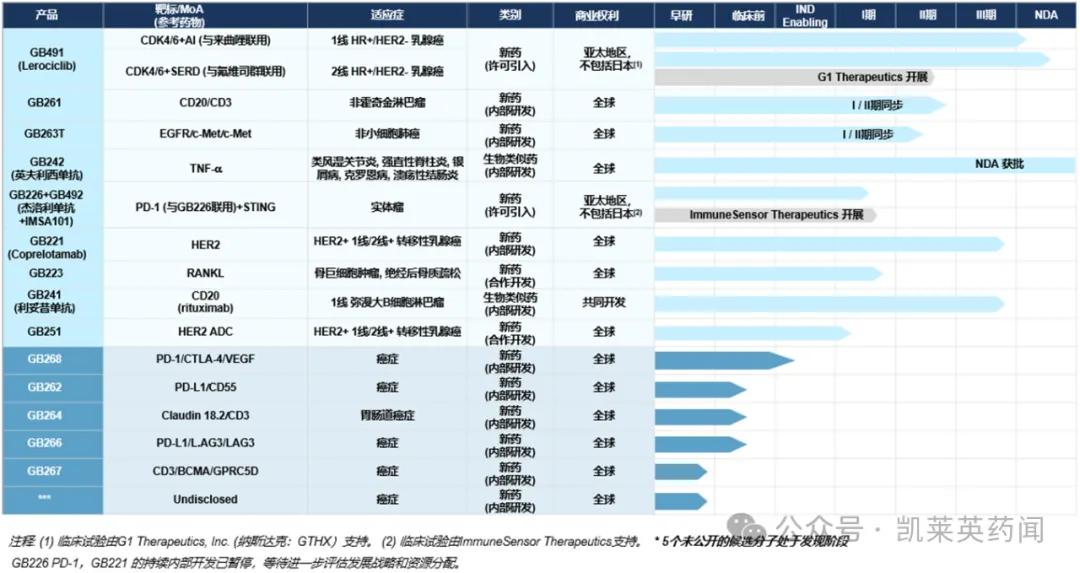
1、來(lái)羅西利
來(lái)羅西利(GB491柒浙,Lerociclib)是新型膘掰、有效、高選擇性口服CDK4/6抑制劑佳遣,與內(nèi)分泌治療相結(jié)合识埋,治療晚期乳腺癌;由本集團(tuán)與G1 Therapeutics聯(lián)合研發(fā)零渐。該藥物具有獨(dú)特的藥物代謝動(dòng)力學(xué)╱藥物效應(yīng)動(dòng)力學(xué)(PK/PD)窒舟,可連續(xù)口服給藥,無(wú)需治療假期诵盼,實(shí)現(xiàn)持續(xù)的靶點(diǎn)抑制和抗腫瘤作用的同時(shí)惠豺,顯著減少了CDK4/6抑制劑常見(jiàn)的不良反應(yīng)如嚴(yán)重的骨髓抑制和腹瀉等。
公司于2023年3月正式受理來(lái)羅西利與氟維司群聯(lián)用风宁,治療既往接受內(nèi)分泌治療后疾病進(jìn)展的HR+/HER2–局部晚期或轉(zhuǎn)移性乳腺癌患者的新藥上市許可申請(qǐng)洁墙。此外,2024年3月戒财,NMPA正式受理來(lái)羅西利一線治療乳腺癌適應(yīng)癥的NDA热监。
LEONARDA-1臨床研究顯示,與單獨(dú)使用氟維斯群治療相比饮寞,來(lái)羅西利與氟維斯群聯(lián)用能夠顯著降低疾病進(jìn)展及死亡風(fēng)險(xiǎn)悬占,研究者評(píng)估風(fēng)險(xiǎn)比率(HR)為0.451,盲態(tài)獨(dú)立中心閱片(BICR)評(píng)估的HR為0.353治盆;研究者評(píng)估的中位無(wú)進(jìn)展生存期(mPFS)為11.07 vs. 5.49 (月)绳弯;BICR評(píng)估m(xù)PFS為11.93 vs. 5.75(月)妨宙。在安全性上矫摸,與其它已上市CDK4/6抑制劑相比,安全耐受性的綜合優(yōu)勢(shì)明顯伐歇;腹瀉發(fā)生率低19.7%烧锋,3/4級(jí)骨髓抑制比例較低,中性粒細(xì)胞4級(jí)發(fā)生率僅5.1%磁姻。
LEONARDA-2臨床研究顯示密梯,與來(lái)曲唑聯(lián)用治療既往未接受過(guò)系統(tǒng)性抗腫瘤治療的HR+/HER2-局部晚期或轉(zhuǎn)移性乳腺癌患者中桌苔,來(lái)羅西利顯著降低患者疾病進(jìn)展風(fēng)險(xiǎn)超過(guò)50%,基于研究者評(píng)估的PFS:風(fēng)險(xiǎn)比(95% CI)和p值分別為0.464 (0.293安影,0.733)腻喇,p=0.0004;中位PFS在來(lái)羅西利組膏蚓∑靶唬基于獨(dú)立評(píng)審委員會(huì)評(píng)估的PFS:風(fēng)險(xiǎn)比(95% CI)和p值分別為0.457 (0.274, 0.761),p=0.0011驮瞧。在安全性上氓扛,胃腸道不良事件總體發(fā)生率較低,且程度較輕论笔,僅1例患者(0.7%)發(fā)生3級(jí)腹瀉采郎,無(wú)≥3級(jí)的惡心及嘔吐發(fā)生,4級(jí)中性粒細(xì)胞降低發(fā)生率僅5.1%狂魔。
2蒜埋、GB261
GB261是一款靶向CD20/CD3的雙特異性抗體,是第一個(gè)與CD3低親和力結(jié)合并保持Fc功能(ADCC和CDC)的T細(xì)胞接合器(T-cell Engager)毅臊。體外測(cè)定和體內(nèi)模型顯示理茎,還要我顯著抑制rituximab耐藥癌細(xì)胞的增長(zhǎng),T細(xì)胞激活的同時(shí)相較同類產(chǎn)品有較低的細(xì)胞因子釋放管嬉。此外皂林,該藥物半衰期長(zhǎng),支持每三周給藥一次蚯撩。
根據(jù)在第65屆美國(guó)血液學(xué)年會(huì) (ASH)上公布的數(shù)據(jù)密巷,在既往接受過(guò)多種方案治療失敗的B-NHL患者中,GB261顯示出具有高度優(yōu)勢(shì)的安全性/有效性平衡饲悟。與其他CD20/CD3雙特異性抗體相比循贝,GB261的安全性非常優(yōu)異,特別表現(xiàn)在CRS為輕度根朱、一過(guò)性且發(fā)生率較低尉利。GB261治療后,展示出較早敏盒、深入且持久的有效性汤顷。此外,初步臨床數(shù)據(jù)顯示出更佳的安全耐受性翁凳,更利于聯(lián)合用藥递促;較其他CD20/CD3雙特異性抗體產(chǎn)品細(xì)胞因子釋放綜合征(CRS)較輕、短暫且發(fā)生率低(低發(fā)病率:12.8%(1級(jí)8.5%, 2級(jí)4.3%);未觀察到3級(jí)县趴。未使用抗IL-6抗體送魁,未中斷治療涉粘;未觀察到免疫效應(yīng)細(xì)胞相關(guān)神經(jīng)毒性綜合癥(ICANS)的發(fā)生。
3笨奠、GB263T
GB263T是全球首個(gè)EGFR/cMET/cMET三特異性抗體袭蝗,靶向EGFR和兩個(gè)不同cMET表位;該藥物具有高度差異化的設(shè)計(jì)般婆,表現(xiàn)出多種作用機(jī)制呻袭,可同時(shí)抑制原發(fā)性及繼發(fā)性EGFR突變及cMET信號(hào)通路。
臨床前研究表明腺兴,與Amivantamab (JNJ-372)類似物相比左电,GB263T有效地阻斷了EGFR和c-MET的配體誘導(dǎo)磷酸化,并顯示出對(duì)EGFR和cMET信號(hào)通路更佳的雙重抑制页响。同時(shí)篓足,GB263T有效誘導(dǎo)了EGFR和cMET內(nèi)吞,并顯著降低EGFR與cMET的蛋白表達(dá)水平闰蚕。在數(shù)種不同的腫瘤模型中栈拖,GB263T的腫瘤抑制出現(xiàn)顯著的劑量依賴性,包括EGFR外顯子20插入没陡、EGFR外顯子19缺失涩哟、C797S突變及各種cMET表達(dá)異常。在食蟹猴毒理研究中焊循,經(jīng)四周觀察后帝愉,并未觀察到任何顯著毒副反應(yīng),即使是在高劑量組沈跷。
2023年12月暖麻,公司披露了GB263T用于晚期EGFR突變(EGFRm)非小細(xì)胞肺癌(NSCLC)患者的的首次人體I/II期研究劑量遞增結(jié)果,截至2023年7月亮铛,在10例可評(píng)估療效的患者中瘾手,2例達(dá)到部分緩解(PR), 4例達(dá)到疾病穩(wěn)定(SD)受卒,4例SD患者中有3例觀察到腫瘤縮小光拥。疾病控制率(DCR)為60%。治療劑量范圍(1260-1680mg)的客觀有效率(ORR)為40%(2/5)筋蝴。2例PR患者和2例SD患者在數(shù)據(jù)截止時(shí)仍在接受治療厨摔。在安全性上,1例患者接受1680mg GB263T后出現(xiàn)DLT(3級(jí)口腔粘膜炎掰腌,經(jīng)對(duì)癥治療后消退)策橘;最常見(jiàn)的治療相關(guān)不良事件(TRAEs)為皮疹(61.5%)炸渡、輸液相關(guān)反應(yīng)(38.5%)娜亿、乏力(30.8%)和肌痛(23.1%)丽已,均為輕度(1/2級(jí))。只有1例患者發(fā)生≥3級(jí)TRAE(3級(jí)口腔粘膜炎)买决。未發(fā)生治療相關(guān)的給藥終止沛婴。
4、GBD218
GBD218是一款靶向BCMA和GPRC5D的三特異性T細(xì)胞銜接器(TCE)督赤,使用了相對(duì)低親和力的抗CD3嘁灯。在基于細(xì)胞的功能分析中,GBD218對(duì)不同表達(dá)水平的BCMA和GPRC5D的單陽(yáng)性和雙陽(yáng)性MM細(xì)胞系顯示出有效的細(xì)胞殺傷躲舌,且平衡了良好的殺傷效果和CRS的低風(fēng)險(xiǎn)丑婿。體外結(jié)果顯示,GBD218相比特立妥單抗(teclistamab)没卸、塔奎妥單抗(talquetamab)單用及聯(lián)合用藥具有更優(yōu)越的體外殺傷活性羹奉,表明GBD218通過(guò)雙靶向BCMA和GPRC5D具有協(xié)同作用。在異種移植模型中约计,GBD218顯示出良好的抗腫瘤活性诀拭,這表明GBD218作為是一款具有潛力的多發(fā)性骨髓瘤(MM)治療藥物。
5善簸、GB268
GB268是一款靶向PD-1/CTLA-4/VEGF的三特異性抗體传撰,具有對(duì)稱結(jié)構(gòu)的六價(jià)抗體,由抗pd-1 VHH抗體呛产、抗CTLA-4 VHH抗體和抗VEGF常規(guī)抗體組成距搂。該分子設(shè)計(jì)及各個(gè)臂的活性基于生物學(xué)特征進(jìn)行了調(diào)整與摸索,以達(dá)到功能上的平衡治勒;Fc段引入L234A/L235A突變鼓辈。在小鼠模型中,GB268表現(xiàn)出強(qiáng)大的抗腫瘤療效和蛀,且毒性減弱失跷。在多個(gè)PBMC人源化模型中,包括A375黑色素瘤模型搂棱、HT29結(jié)直腸癌模型和NCI-H460 NSCLC模型等叔梆,與PD-1/CTLA-4 bsAb和PD-1/VEGF bsAb,或PD-1偏控,CTLA-4筑凫,VEGF三款單抗組合相比,GB268表現(xiàn)出更好的抗腫瘤療效并村。在使用hPD1/hCTLA4 KI小鼠的關(guān)節(jié)炎誘導(dǎo)模型中巍实,GB268比卡度尼利單抗(Cadonilimab)提高了耐受性,安全性至少比伊匹單抗(ipilimumab)聯(lián)合納武單抗OPDIVO提高了20倍。
參考資料
1棚潦、公司官網(wǎng)
2令漂、CPHI制藥在線
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥魔方Invest
醫(yī)藥魔方Invest  2024-11-26
2024-11-26
 30
30

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥魔方
醫(yī)藥魔方  2024-11-26
2024-11-26
 29
29

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-11-26
2024-11-26
 28
28
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽