
 產業(yè)資訊
產業(yè)資訊
 Insight數據庫
Insight數據庫  2024-09-03
2024-09-03
 230
230
據 Insight 數據庫統(tǒng)計冲驶,上周(8 月 25 日—8 月 31 日)全球共有 76 款創(chuàng)新藥(含改良新)研發(fā)進度推進到了新階段介牙,其中 3 款獲批上市审腺,4 款申報上市丰嘉,5 款進入 III 期臨床履羞,8 款獲批臨床,13 款申報臨床茂契。
下文蝶桶,Insight 將分別摘取國內外部分重點項目做介紹。
境外創(chuàng)新藥進展
境外部分掉冶,上周共有 28 款創(chuàng)新藥(含改良新)研發(fā)進度推進到了新階段真竖,其中 3 款獲批上市,2 款申報上市厌小,9 款首次啟動臨床恢共,4 款獲批臨床战秋。除此之外,在新適應癥拓展柴炉、醫(yī)藥交易辟堡、臨床結果也各有看點。
獲批上市
上周較多新藥/新適應癥在歐盟區(qū)域獲批上市青竹,涉及強生途陵、羅氏、再生元茂钠、GSK 等企業(yè)。
本周歐盟首批新藥/新適應癥

截圖來自:Insight 數據庫網頁版
1房贮、再生元:全球首批径塔!再生元首款雙抗,靶點 CD3/CD20
8 月 27 日殊蜓,再生元宣布凰番,其 CD3/CD20 雙特異性抗體 Ordspono(odronextamab)已獲歐盟委員會批準上市,用于治療既往接受過兩線及以上全身性治療的復發(fā)或難治性濾泡性淋巴瘤(FL)或彌散性大 B 細胞淋巴瘤(DLBCL)寂贱。
據 Insight 數據庫顯示褒堆,這是再生元首款獲批上市的雙抗類藥物;同時滋饲,本次批準也是 odronextamab 的全球首批厉碟。

截圖來自:再生元
本次批準是基于臨床 1 期研究 ELM-1 和關鍵 2 期研究 ELM-2 的積極結果。前者旨在研究該藥在既往接受過 CD20 靶向療法的 CD20+ B 細胞惡性腫瘤患者中的安全性屠缭;后者則在 DLBCL箍鼓、FL、套細胞淋巴瘤(MCL)呵曹、邊緣區(qū)淋巴瘤(MZL)和其他 B 細胞非霍奇金淋巴瘤(B-NHL)亞型隊列中研究了 odronextamab 的療效和安全性款咖,以 ORR 為主要終點。
結果顯示奄喂,在 ELM-2 研究中铐殃,odronextamab 在 FL 患者(n=128)中實現了高達 80% 的 ORR, CR 率為 73%跨新,CR 患者的 mDoR 為 25 個月(95%CI: 20 - NE)富腊;在 DLBCL 患者(n=127)中的 ORR 則為 52%,且對 CAR-T 療法耐藥的患者也展現出療效玻蝌。
2蟹肘、羅氏:可伐利單抗在歐盟獲批上市
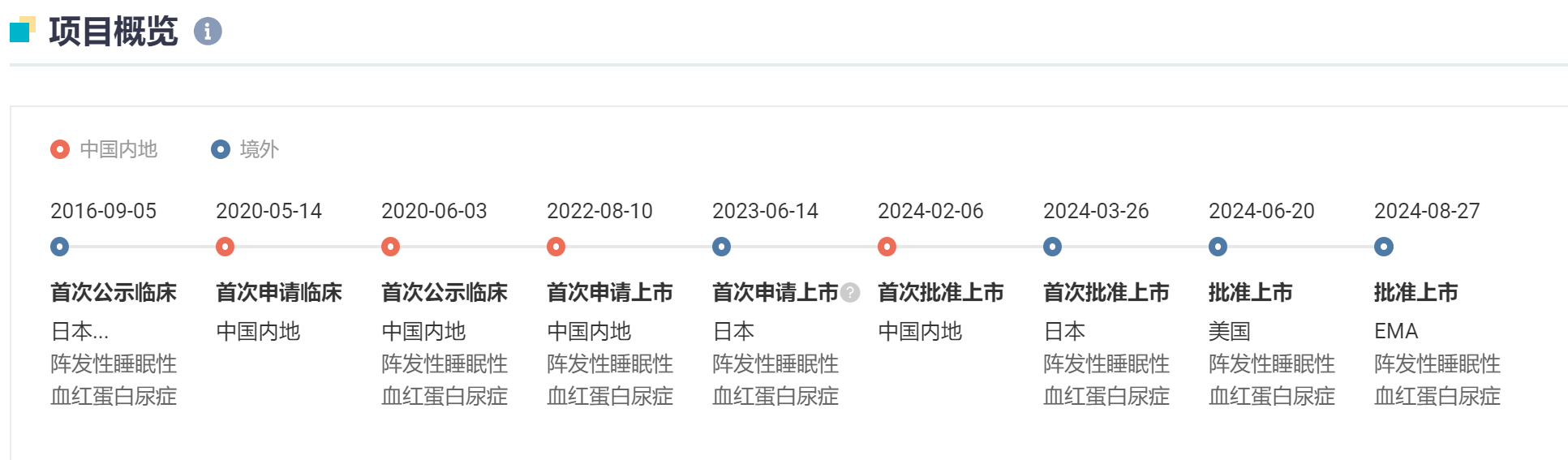
8 月 28 日,羅氏宣布其長效 C5 補體抑制劑「可伐利單抗」(crovalimab)已獲歐盟委員會批準上市摇致,用于治療陣發(fā)性睡眠型血紅蛋白尿癥(PNH)谅儡。

截圖來自:羅氏制藥
可伐利單抗是一款每月一次的皮下注射療法秫丐。皮下注射劑的給藥方式大大提升了依從性,患者可以在家自行給藥妈扁。它與依庫珠單抗同為補體 C5 抑制劑竹俱,但針對的 C5 表位不同,因此可覆蓋到依庫珠單抗所覆蓋不到的 C5 多態(tài)性的患者粘胧。
值得一提的是摊房,阿斯利康的同類藥物依庫珠單抗(Soliris)和瑞利珠單抗(Ultomiris)在 2023 年分別實現 31.45 億美元、29.65 億美元年銷售額诅潮,且前者早在 2007 年就獲批上市昨哑,常年盤踞在藥品銷售額 TOP 榜單上,引得 AZ 以 390 億美元收購 Alexion胜全,可伐利單抗獲批后的廣闊市場也是可想而知域毡。
可伐利單抗針對 PNH 共開展了 3 項關鍵注冊性 III 期臨床研究,其中 COMMODORE 1 研究支持了 PNH 患者從依庫珠單抗轉換為珂羅利單抗治療的安全性琅功,COMMODORE 2 研究則支持了珂羅利單抗對比依庫珠單抗的療效和安全性考余,COMMODORE 3 為中國人群數據,這也支持了該藥在中國實現了全球首發(fā)轧苫。而在歐盟的獲批是基于 3 期臨床試驗 COMMODORE 2 的積極結果楚堤。
申報上市
1、強生:FcRn 單抗在美國申報上市
8 月 30 日含懊,強生宣布已向 FDA 遞交 FcRn 靶向抗體尼卡利單抗(nipocalimab)用于全身性重癥肌無力(gMG)的 BLA 申請身冬,這是該藥在全球范圍內的首個監(jiān)管申請。

截圖來自:PR Newswire
本次 BLA 的遞交是基于 III 期臨床試驗 Vivacity-MG3 的結果绢要。在今年 6 月強生宣布該項臨床試驗取得了成功吏恭,相較于安慰劑聯合 SOC,接受 nipocalimab 治療的患者在 MG-ADL 評分上實現了平均 4.70 分的改善重罪,顯著高于安慰劑組的 3.25 分(P=0.002)樱哼。
據 Insight 數據庫顯示,尼卡利單抗來源于強生在 2020 年 8 月對 Momenta 公司的 65 億美元收購剿配。當前除強生外搅幅,已有 2 款 FcRn 單抗類藥物獲批上市,即優(yōu)時比的羅澤利昔珠單抗(Rozanolixizumab)和再鼎/Argenx 的艾加莫德呼胚;石藥集團/和鉑醫(yī)藥合作的巴托利單抗也已經申報上市茄唐。
臨床試驗
1、拜耳:小分子新藥啟動 III 期臨床膳庵,針對 HER2 突變 NSCLC
8 月 29 日辐芍,拜耳宣布小分子酪氨酸激酶抑制劑 BAY 2927088 的 III 期 SOHO-02 試驗已完成首例患者入組。這是一項開放標簽描休、隨機掷戚、多中心臨床試驗令久,旨在評估 BAY 2927088 在攜帶 HER2 激活突變的晚期非小細胞肺癌(NSCLC)患者中作為一線治療的有效性和安全性。
拜耳表示猫郎,目前 I/II 期 SOHO-01 試驗數據已入選世界肺癌大會的主席研討會沧唧,將于 2024 年 9 月 9 日發(fā)表。除 SOHO-02 試驗以外矩修,在此前接受過系統(tǒng)性治療的攜帶 HER2(ERBB2)激活突變的不可切除或轉移性 NSCLC 成人患者中叫砚,也在評估研究藥物 BAY 2927088 作為二線治療的潛力。
肺癌是全球癌癥相關死亡的主要原因厅揍。目前铡涣,對于攜帶 HER2 激活突變的 NSCLC 患者,尚沒有批準的靶向一線療法弹惦。
BAY 2927088 用于二線治療于 2024 年 2 月獲得美國 FDA 的突破性療法認定蟆蔫。2024 年 6 月京思,中國 CDE 也授予其突破性治療品種認定腊敲。
醫(yī)藥交易
上周瀑晒,據 Insight 數據庫顯示算墨,全球共發(fā)生 13 起醫(yī)藥交易事件宵荒。
1、拜耳 & NextRNA:最高 5.47 億美元净嘀!針對 lncRNA 靶點
8 月 29 日报咳,拜耳和 NextRNA Therapeutics 共同宣布,雙方已達成合作挖藏,共同開發(fā)腫瘤領域針對長鏈非編碼 RNA(lncRNA)的小分子療法暑刃。
lncRNA 代表了一類廣泛的治療靶點,通過招募 RNA 結合蛋白(RBPs)膜眠,驅動跨疾病領域的病理過程岩臣。這類新型治療藥物的創(chuàng)新之處在于破壞 lncRNA-RBP 與小分子的相互作用。
拜耳和 NextRNA 將共同推進兩項針對腫瘤領域具有高度未滿足需求適應癥的療法宵膨。第一個項目是 lncRNA 靶向小分子項目庇启,目前 NextRNA 正處于早期臨床前開發(fā)階段。對于第二個項目兔憨,NextRNA 將持續(xù)研究其平臺已經確定的 lncRNA 靶點盛媚,拜耳可以選擇其中一個靶點進行聯合開發(fā)。
根據協議扶楣,NextRNA 基于上述兩個項目將獲得最高 5.47 億美元撤忆,包括預付款和近期里程碑付款、研究經費睬毒、開發(fā)和商業(yè)里程碑付款矿钩,以及依據凈銷售額分層的銷售提成劫丧;而拜耳則獲得了 NextRNA 的差異化方法,通過破壞 lncRNAs 和 RBPs 與小分子之間的相互作用父绿,抑制 lncRNAs 的功能尿旅。NextRNA 的專有平臺將其計算引擎 NextMap? 與深厚的 lncRNA 生物學專長以及多樣化的生物化學、生物物理學和化學功能相結合畅廷。
2捕阅、加科思、艾力斯:KRAS G12C麸塞、SHP2 項目授權
8 月 30 日秃臣,加科思宣布將 KRAS G12C 抑制劑戈來雷塞和 SHP2 抑制劑 JAB-3312 的中國(包括中國大陸、香港哪工、澳門和臺灣地區(qū))(包括中國大陸奥此、香港、澳門和臺灣地區(qū))權益授權授予艾力斯雁比。
根據協議條款稚虎,加科思近期將收到約 2 億元款項,其中包括 1.5 億元首付款偎捎,以及約 5000 萬元研發(fā)費用補償和其他付款蠢终,此外將收到最高 7 億元開發(fā)及銷售里程碑付款,以及分級兩位數比例的銷售提成茴她,其中 JAB-3312 凈銷售提成最高至 20%寻拂,上述金額為含增值稅金額。這標志著加科思正式進入商業(yè)化階段丈牢,同時 SHP2 的研發(fā)也迎來了新的里程碑祭钉。
戈來雷塞單藥用于 KRAS G12C 突變二線非小細胞肺癌的新藥上市申請(NDA)已于 2024 年 5 月 21 日獲得優(yōu)先審評。2024 年 4 月已箫,加科思在 ASCO Plenary Series 公布的戈來雷塞二期注冊性臨床試驗數據顯示危晕,單藥二線非小細胞肺癌患者中,確認客觀緩解率(cORR)為 47.9%(56/117)蕴节,其中包括 4 例患者實現完全緩解(CR)恭隧,36 例患者腫瘤縮小超過 50%,疾病控制率為 86.3%漩跋。中位無進展生存期(mPFS)為 8.2 個月啃极,中位總生存期(mOS)為 13.6 個月。
戈來雷塞與 SHP2 抑制劑 JAB-3312 聯合用藥用于 KRAS G12C 突變的一線非小細胞肺癌(NSCLC)對照標準療法(化療和 PD-1 抗體聯合治療)的注冊性三期臨床試驗已于 2024 年 8 月完成首例患者給藥阁檀。2024 年 6 月粘榕,加科思在 ASCO 年會上已經發(fā)布 I/IIa 期積極臨床數據,初現潛力。
除此之外伴零,戈來雷塞單藥用于 KRAS G12C 突變的二線及以上胰腺癌千覆,單藥及與西妥昔單抗聯合治療用于 KRAS G12C 突變的結直腸癌的二期注冊性臨床試驗也正在開展中,并基于胰腺癌適應癥獲得美國 FDA 的孤兒藥認定和國內 NMPA 的突破性療法認定感桌。
艾力斯已經在伏美替尼上大獲成功姑裂,然而在臨床管線上仍需補充,以打破單一商業(yè)化產品的現狀男旗,真正邁入正向循環(huán)舶斧。本次兩款交易產品正是針對艾力斯已有積累的肺癌領域,有望借助該公司之前建立的商業(yè)化能力組合發(fā)力察皇、實現快速拓展茴厉。
資格認定
1、百濟神州:BTK PROTAC 獲 FDA 快速通道認定
8 月 27 日什荣,百濟神州宣布美國 FDA 授予 BGB-16673 快速通道認定矾缓,用于治療既往接受過至少兩線治療(包括 BTK 抑制劑和 BCL2 抑制劑)的 R/R CLL/SLL 成年患者。BGB-16673 是一種口服稻爬、靶向 BTK 的在研嵌合式降解激活化合物(CDAC)嗜闻。
這一快速通道認定的申請主要基于 BGB-16673 用于解決發(fā)生疾病進展的 CLL/SLL 患者尚未滿足的醫(yī)療需求的潛力。在今年 6 月舉行的 2024 年歐洲血液學協會年會上桅锄,百濟公布了正在進行的 1/2 期首次人體試驗(NCT05006716)數據泞辐,突顯出該藥物用于治療既往接受過多線治療的 R/R CLL/SLL 患者具有可耐受的安全性和良好的有效性。迄今為止竞滓,BGB-16673 全球臨床開發(fā)項目已在 15 個國家/地區(qū)治療了超過 300 例患者。
鑒于 BTK 通路對于 CLL/SLL 治療的核心意義要茴,接受 BTK 抑制劑治療的患者一旦發(fā)生疾病進展瞧佃,則需要使用不同作用機制的靶向 BTK 的藥物。百濟的 BTK CDAC(BGB-16673)進行 BTK 蛋白降解將有望解決這項尚未滿足的臨床需求携侮,鞏固其在血液學領域的領先地位袭甲,并與血液學核心產品百悅澤?(澤布替尼)形成優(yōu)勢互補。
國內創(chuàng)新藥進展
本周國內共有 54 款創(chuàng)新藥(含改良新)研發(fā)進度推進到了新階段姚继,其中 4 款申報上市赊蚁,8 款啟動 III 期臨床,7 款新藥獲批臨床几馁,13 款申報臨床某尘。
本周國內首次獲批臨床的 11 款創(chuàng)新藥(含改良新)

來自:Insight 數據庫網頁版(下文如無特殊標注,為同一來源)
獲批上市
1钙阐、傳奇生物:CAR-T 療法「西達基奧侖塞」獲批上市
8 月 27 日厦鸠,NMPA 官網顯示,傳奇生物遞交的西達基奧侖賽注射液上市申請已獲得批準(受理號:CXSS2200094)颁吭,用于治療既往接受過一種蛋白酶抑制劑和一種免疫調節(jié)劑治療后復發(fā)或難治性多發(fā)性骨髓瘤塘坛,成為第 6 款在國內獲批的 CAR-T 療法苗膝。更值得一提的是,西達基奧侖賽早早就獲強生青睞達成全球合作植旧,是全球首個且唯一獲批用于多發(fā)性骨髓瘤患者二線治療的 BCMA 靶向療法辱揭,2022 年 2 月就已經在美國獲批上市,且是上市后漲速最快的同類藥物病附。據強生預期问窃,2024 年這款療法有望躋身「十億美元分子」之列,中國市場同樣是該藥商業(yè)化的重要陣地胖喳。


截圖來源:NMPA 官網
本次獲批是基于一項在中國開展的單臂泡躯、非隨機化的 Ⅱ 期開放性研究(登記號:CTR20181007)CARTIFAN-1。該研究旨在評估西達基奧侖賽的安全性和有效性丽焊。主要研究終點是根據國際骨髓瘤工作組(IMWG)的療效標準評估 ORR较剃。
2022 年 12 月在 ASH 上,研究人員曾公布了 CARTIFAN-1 中位隨訪 26.4 個月的最新結果技健。在 48 例患者中写穴,ORR 達到了 87.5%,且反應繼續(xù)加深雌贱,79.2% 的患者達到 sCR星肤,中位 DoR 未到達。在 41 例 MRD 可評估的患者中爸桨,40 例患者(97.6%)為 MRD 陰性溢牡。隨訪 26.4 個月,中位 PFS 和 OS 均未到達评梁,24 個月 PFS 和 OS 率分別為 52.6% 和 74.2%粉怯。研究認為在中位 26.4 個月的隨訪中,接受西達基奧侖賽治療的患者隨著時間的推移顯示出對西達基奧侖賽持續(xù)和深度的緩解责肯,中位 PFS 和 OS 均未到達险朴,與美國同期注冊的臨床研究 CARTITUDE-1 中觀察到的結果相一致。據強生 2024 年 H1 財報顯示诬翩,今年上半年使宽,西達基奧侖賽凈銷售額為 3.43 億美元,較去年同期大增 81.5%贫巴。若今年下半年增勢不減厦嘹,全年銷售額還是非常有希望可以達到甚至突破 10 億美元的。本次在國內獲批上市炕婶,又添一重助力谍椅。目前,西達基奧侖賽仍在向一線治療多發(fā)性骨髓瘤的目標推進,尤其是兩項 III 期臨床試驗 CARTITUDE-5 和 CARTITUDE-6 的開展雏吭,它們分別探索了西達基奧侖賽與一線藥物治療锁施、與骨髓移植對照,在不適合/無意愿進行移植治療的新診斷多發(fā)性骨髓瘤(NDMM)患者中的療效杖们。如果兩研究取得成功悉抵,西達基奧侖賽的市場潛力將進一步放大。2摘完、恒瑞姥饰、智翔金泰:同日兩款 IL-17A 單抗獲批上市
8 月 27 日,NMPA 官網顯示孝治,恒瑞醫(yī)藥 IL-17A 單抗夫那奇珠單抗的上市申請(CXSS2300026)已獲得批準列粪,用于治療成人中重度斑塊型銀屑病。也正是在這一日谈飒,智翔金泰的同類藥物賽立奇單抗也獲批上市岂座,成為國內首款。


截圖來源:NMPA 官網
夫那奇珠單抗(SHR-1314)是恒瑞醫(yī)藥自主研發(fā)的一款人源化 IgG1 抗 IL-17A 單克隆抗體藥物隅昌,它可與 IL-17A 結合后抑制下游細胞因子拉诲,阻斷炎癥信號傳導。
夫那奇珠單抗治療中重度斑塊型銀屑病適應癥的獲批是基于一項多中心琼护、隨機威卑、雙盲、平行菌熬、安慰劑對照的 Ⅲ 期臨床試驗(SHR-1314-301)您凸。該研究結果顯示:
夫那奇珠單抗起效迅速,第 2 周時平均 PASI 降低>50%炊撕,PASI 75 中位應答時間僅 4.3 周(注:PASI為銀屑病面積和嚴重程度指數)宠宗。
在皮損清除方面,夫那奇珠單抗同樣表現優(yōu)異渐位,第 12 周時, PASI 75 應答率達 93.6%赏庙, PASI 90 達 76.8%栋昙,PASI 100 達 36.6%。第 28-52 周時鸯乃, PASI 下降可維持在 97% 以上鲸阻。
在安全性方面,夫那奇珠單抗安全性缨睡、耐受性良好鸟悴。
此外,恒瑞也在 2024 年 2 月遞交了夫那奇珠單抗的第 2 個適應癥上市申請(CXSS2400017/8/9),用于治療成人活動性強直性脊柱炎细诸。Insight 數據庫預測該申請有望于 2025 年第二季度獲批沛贪。
而賽立奇單抗獲批上市則是基于北京大學人民醫(yī)院皮膚科張建中教授牽頭開展的一項隨機、雙盲震贵、安慰劑對照利赋、多中心 Ⅲ 期臨床研究(ChiCTR2100043223)。研究表明猩系,賽立奇單抗注射液對中媚送、重度斑塊狀銀屑病表現出優(yōu)異的療效以及良好的安全性和耐受性。此項研究結果于 2024 年 2 月 15 日發(fā)表于國際皮膚病學權威期刊 British Journal of Dermatology(BJD)寇甸。
申報上市
1塘偎、諾和諾德:「司美格魯肽」新適應癥國內報上市
8 月 26 日,CDE 官網顯示稀渊,諾和諾德遞交了司美格魯肽注射液的新適應癥上市申請战凿,并獲得受理。
司美格魯肽此前已在國內獲批 2 型糖尿病和長期體重管理適應癥粉越。根據司美格魯肽正在開展的臨床研究职涛,Insight 數據庫預測,該藥本次申請的新適應癥可能為:成人 2 型糖尿病合并慢性腎臟疾病薄罕。
截圖來自:CDE 官網
慢性腎臟病 (CKD) 是 2 型糖尿病的常見并發(fā)癥揖们,約 40% 的 2 型糖尿病患者會患上 CKD,為該類患者帶來相當大的長期健康風險妆崇。諾和諾德在各大糖尿病相關代謝疾病上廣泛探索了司美格魯肽的療效獲益捣潭,3 期臨床試驗 FLOW 的結果公布于 2024 年 6 月舉行的美國糖尿病協會第 84 屆科學會議上。
FLOW 是一項隨機猜休、雙盲军霸、平行、安慰劑對照的國際多中心臨床試驗(CTR20192594)飞灰,旨在探索司美格魯肽作為標準治療的輔助手段對 2 型糖尿病和 CKD 患者腎功能損害進展風險和腎臟及心血管死亡風險的影響幻彪。該試驗在包含中國在內的 28 個國家的約 400 個研究中心進行,共招募了 3533 人卵渴,1:1 分配于司美格魯肽組和安慰劑組慧域。
試驗數據顯示,該研究達到了其主要終點浪读。與安慰劑相比昔榴,1 毫克司美格魯肽組患者的腎臟疾病進展風險和心血管及腎臟死亡風險降低了 24%(331 例 vs. 410 例事件;風險比:0.76)碘橘。 此外互订,在所有評估的次要研究結果中吱肌,司美格魯肽 1 毫克均優(yōu)于安慰劑,包括平均年腎小球濾過率 (eGFR) 斜率仰禽、重大心血管事件風險氮墨、因任何原因死亡的風險。安全性方面坟瓢,司美格魯肽組報告的嚴重不良事件數量也少于安慰劑組勇边。
司美格魯肽是諾和諾德的主要收入來源。根據諾和諾德 2024 年 H1 財報折联,司美格魯肽總計銷售額達 129.6 億美元畴垃,占到諾和諾德總營收的約 2/3,是一款有望問鼎藥王寶座的超級重磅炸彈疟弹。2鲫畸、萬泰生物:首款國產九價 HPV 疫苗報上市
8 月 26 日,CDE 官網顯示福晋,萬泰生物九價 HPV 疫苗(大腸埃希菌)上市申請獲受理霜宙,為首款國產九價 HPV 疫苗。
截圖來源:CDE 官網
根據萬泰生物此前新聞稿逼税,本次申報上市基于一項多中心堕武、隨機、雙盲惜选、二價 HPV 疫苗對照的 III 期臨床試驗夫泛,主要分析數據集中已累積到方案預定的 12 月持續(xù)性感染終點事件數,初步分析結果顯示主要結果符合預期且仔。本次九價 HPV 疫苗 III 期臨床試驗揭盲獲得的數據僅為截至 V8 訪視的部分主要結果伸畅,后續(xù)還需根據方案及統(tǒng)計分析計劃的規(guī)定開展全面深入分析。
此前(8 月 12 日)凹蜂,該品種上市申請已經被擬納入優(yōu)先審評馍驯。萬泰生物九價 HPV 疫苗覆蓋 HPV16/18/31/33/45/52/58 七種高危型和 HPV6/11 兩種低危型,可預防人乳頭瘤病毒 HPV6 和 HPV11 感染及因此引發(fā)的尖銳濕疣等疾病和人乳頭瘤病毒 HPV16玛痊、HPV18汰瘫、HPV31、HPV33擂煞、HPV45混弥、HPV52、HPV58 感染及因此引發(fā)的宮頸癌等疾病颈娜。
據 Insight 數據庫顯示剑逃,目前國內已上市的 HPV 疫苗共有 5 款浙宜,其中九價官辽、四價均來自默沙東蛹磺,二價 HPV 疫苗除了來自葛蘭素史克進口疫苗外已經有 2 款國產產品上市,分別來自沃森生物和萬泰生物同仆。
值得注意的是萤捆,北京生物制品研究所的四價 HPV 疫苗也于今年 7 月 4 日在國內報上市,如果順利的話俗批,四價 HPV 疫苗也會很快實現國產替代长笋。另外,若此次萬泰生物九價順利獲批式亥,萬泰生物將同時擁有國產九價和二價 HPV 疫苗枷此。
HPV 疫苗常常一針難求,同時由于需求群體廣纸藕,市場十分龐大臣锣。不過,目前還有 4 款國產九價 HPV 疫苗已經進入 III 期臨床階段冗炊,競爭可想而知蔬设,不過萬泰搶得首發(fā)優(yōu)勢有望助力占據更多市場份額。
3知援、通化金馬:國產阿爾茨海默病 1 類新藥報上市
8 月 29 日次瓣,CDE 官網顯示,通化金馬研發(fā)的 1 類新藥「琥珀八氫氨吖啶片」上市申請獲受理星自,用于治療輕憾擒、中度阿爾茨海默病。
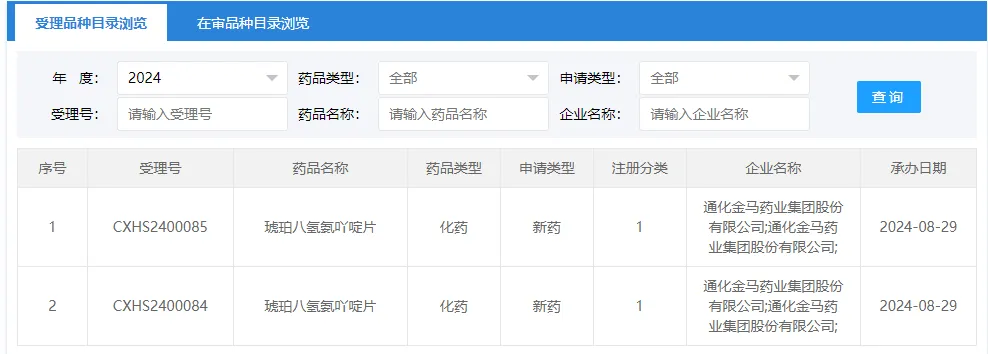
截圖來源:CDE 官網
琥珀八氫氨吖啶片是一種口服固體制劑忆某,主要用于治療輕点待、中度阿爾茨海默病,是一種新的乙酰膽堿酯酶抑制劑弃舒,具有雙重膽堿酯酶抑制功能癞埠,可以同時抑制乙酰膽堿酯酶和丁酰膽堿酯酶。本次報上市是基于一項琥珀八氫氨吖啶片治療輕聋呢、中度阿爾茨海默病的雙盲苗踪、雙模擬、隨機削锰、安慰劑/陽性平行對照 Ⅲ 期臨床試驗通铲,于 2015 年 8 月獲得 NMPA 的 III 期臨床批件,2021 年 8 月全部完成入組器贩。
臨床結果顯示颅夺,琥珀八氫氨吖啶片 III 期臨床試驗達到主要臨床試驗終點,試驗呈陽性結果蛹稍,認為試驗藥物對 ADAS-cog 的改善具有明顯的臨床意義吧黄;在安全性上部服,試驗藥物的不良事件及不良反應的發(fā)生率均低于兩個對照組。與安慰劑組比較竖沦,結果具有顯著的統(tǒng)計學意義胎融,P<0.001。4舍屠、賽諾菲:CD3 單抗中國報上市美怪,針對 1 型糖尿病
8 月 28 日,CDE 官網顯示胸牲,賽諾菲的 CD3 單抗替利珠單抗注射液在中國申報上市蒸咏,適用于成人和 8 歲及以上兒童 1 型糖尿病 2 期患者,以延緩 3 期 1 型糖尿病發(fā)病蝉蛙。
替利珠單抗已被納入第四批鼓勵研發(fā)申報兒童藥品清單呐相,并于今年 7 月率先在海南博鰲樂城國際醫(yī)療旅游先行區(qū)落地,且在本次受理前已經被 CDE 納入擬優(yōu)先審評名單硼屁。根據賽諾菲公開資料汞小,替利珠單抗可延緩發(fā)病近 3 年,使患者減少 3 年累計高達 4380 次的胰島素注射赠懊。

截圖來源:CDE 官網
不同于大眾熟知的 2 型糖尿病蛛挚,1 型糖尿病是一種慢性自身免疫性疾病,由于產生胰島素的胰島 β 細胞遭受自身免疫系統(tǒng)破壞囚企,導致胰島素「匱乏」丈咐,影響人體自身調節(jié)血糖水平的能力。1 型糖尿病高發(fā)于 10-14 歲龙宏,且呈明顯低年齡化趨勢棵逊。有研究顯示,1 型糖尿病約占兒童期各型糖尿病總數的 90%银酗。
1 型糖尿病的進展有 3 個分期辆影,1 期、2 期尚未出現明顯癥狀黍特,3 期階段蛙讥,人體大部分胰島 β 細胞受免疫破壞,血糖水平升高達到臨床糖尿病診斷標準灭衷。
替利珠單抗是一種 CD3 靶向的單克隆抗體次慢,它能從病因上實現對胰島 β 細胞的保護。2022 年 11 月翔曲,替利珠單抗獲美國 FDA 批準上市迫像,是 FDA 批準的全球首個且唯一延緩 1 型糖尿病發(fā)病的創(chuàng)新靶向療法。
TN-10 研究顯示误即,與安慰劑組相比薇兆,持續(xù) 14 天使用替利珠單抗治療衷谋,能將 1 型糖尿病的發(fā)病時間平均延緩近 3 年。2023 年 10 月纺闷,三期臨床試驗研究 PROTECT (NCT03875729)也達到主要終點,數據顯示胧含,替利珠單抗有潛力延緩新診斷的 3 期 1 型糖尿病兒童和青少年的疾病進展需复。
臨床 III 期
1、康方生物:「依沃西」開啟第 4 項頭對頭 III 期研究费控,挑戰(zhàn)阿斯利康 PD-L1拓郑!
8 月 25 日,CDE 官網顯示咸培,康方生物 PD-1/VEGFA 雙抗啟動一項 3 期臨床节霸,探索 AK112 聯合化療對比度伐利尤單抗聯合化療一線治療晚期膽道癌。
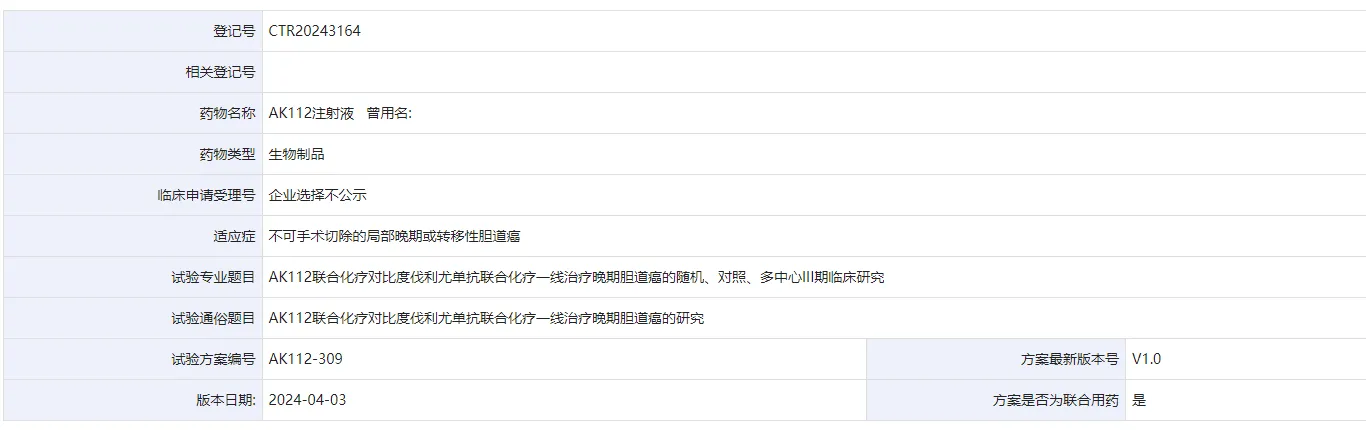
截圖來源:CDE 官網
值得一提的是疑跑,這是依沃西單抗繼頭對頭擊敗 K 藥怒医、頭對頭替雷利珠單抗之后,開展的針對第 3 款 PD-1/L1 藥物的頭對頭 III 期臨床研究奢讨≈商荆康方迄今開展了 4 款頭對頭 III 期臨床研究,分別為:
AK112 對比帕博利珠單抗一線治療 PD-L1 陽性的局部晚期或轉移性非小細胞肺癌的隨機拿诸、對照扒袖、多中心 III 期臨床研究(CTR20222137)
AK112 聯合化療對比 PD-1 抑制劑(替雷利珠單抗)聯合化療一線治療局部晚期或轉移性鱗狀非小細胞肺癌的隨機、對照亩码、多中心 III 期臨床研究(CTR20231272)
一項 Ivonescimab 聯合化療對比帕博利珠單抗聯合化療一線治療轉移性鱗狀非小細胞肺癌的隨機季率、 對照、 多地區(qū) III 期研究(HARMONi-3描沟,CTR20232457)
AK112 聯合化療對比度伐利尤單抗聯合化療一線治療晚期膽道癌的隨機飒泻、對照、多中心 III 期臨床研究(CTR20243164)
其中吏廉,頭對頭 K 藥 1L 治療 PD-L1 陽性 NSCLC 的 III 期臨床 HARMONi-2 已經達到主要終點蠢络,顯示出積極結果。2迟蜜、邁威生物:Nectin-4 ADC 啟動 III 期臨床刹孔,用于宮頸癌
8 月 27 日,CDE 官網顯示略匕,邁威生物啟動了一項 9MW2821 的關鍵 III 期臨床研究缓贤,治療含鉑化療失敗的復發(fā)或轉移性宮頸癌。這也是全球首款在宮頸癌適應癥進入 III 期臨床研究的 Nectin-4 ADC熟督。
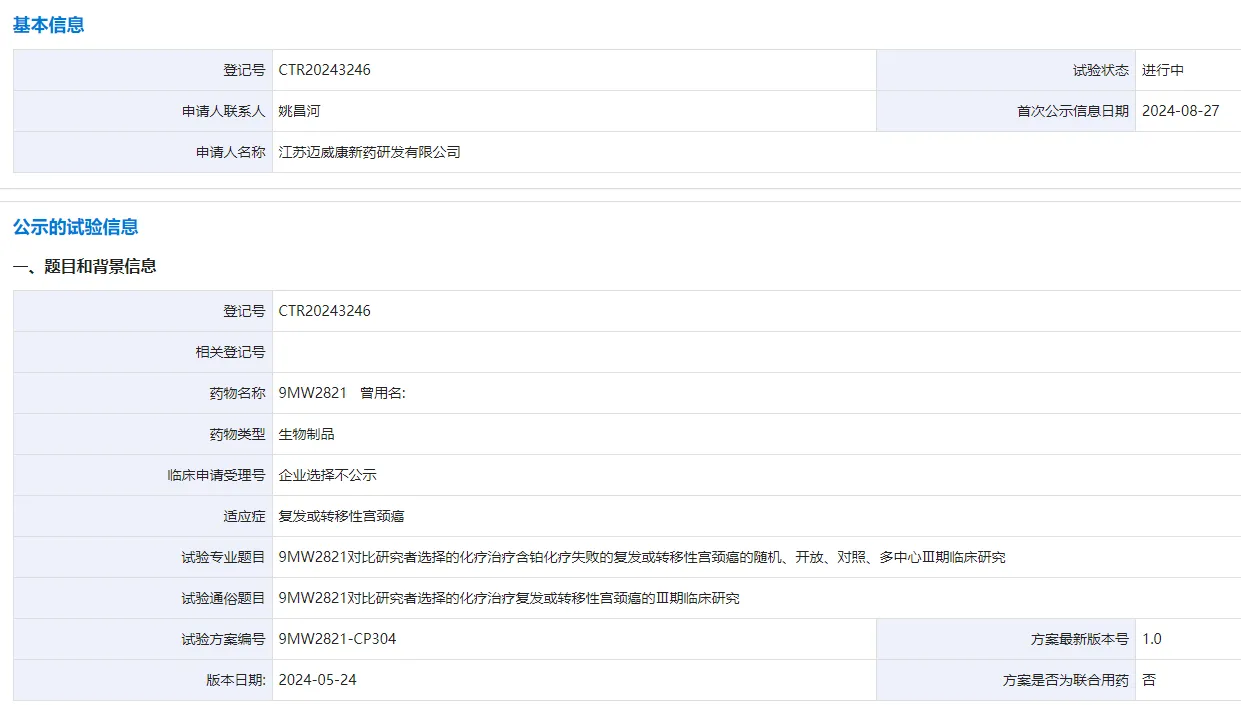
截圖來源:CDE 官網
9MW2821 是邁威生物自主研發(fā)的靶向 Nectin-4 ADC 創(chuàng)新藥卿黍,通過具有自主知識產權的偶聯技術連接子及優(yōu)化的 ADC 偶聯工藝军笑,實現抗體的定點修飾,DAR 值為 4见拴。相比隨機偶聯技術擅暴,邁威的定點偶聯技術偶聯產物更加均一,藥效更強馒毙,且體內穩(wěn)定性更高项栈,脫靶毒性更弱,耐受性也更好疫壕。
在 2024 年 ASCO 大會上映检,邁威生物公布了 9MW2821 在多種晚期實體腫瘤患者中初步抗腫瘤活性。這是一項 I/II 期臨床研究秸谢,其中在宮頸癌隊列中凛澎,Nectin-4 陽性表達的檢出率為 91.87%,Nectin-4 3+ 檢出率為 73.98%估蹄。53 名可評估療效的患者中塑煎,受試者既往均接受過含鉑雙藥化療,51% 受試者既往接受過貝伐珠單抗治療臭蚁,58% 受試者既往接受過免疫檢查點抑制劑治療轧叽。
ORR 和 DCR 分別為 35.8% 和 81.1% ,中位 PFS 為 3.9 個月刊棕、中位 DOR 為 7.2 個月炭晒,總生存期(OS)尚未達到,12 個月的 OS 率為 74.6%甥角。在 Nectin-4 3+ 的患者中网严,ORR 為 43.6%。上述研究結果表明嗤无,9MW2821 在宮頸癌患者中具有積極的治療效果震束。除了宮頸癌適應癥外,9MW2821 還有兩項 III 期臨床正在開展中咸婿,分別為尿路上皮癌三線療法和一線療法姚转。
目前,全球僅獲批一款 Nectin-4 ADC棒嚼,來自安斯泰來的維恩妥尤單抗们敢,該藥近期(2024-8-19)剛在國內獲批上市,用于治療既往接受過 PD-1/PD-L1 抑制劑和含鉑化療治療的局部晚期或轉移性尿路上皮癌患者啃掠。
不過慷训,在宮頸癌上,邁威已經跑在最前。3蝉橘、諾誠健華:TYK2 抑制劑啟動 III 期臨床苔眼,全球最快
8 月 27 日,CDE 官網顯示润邑,諾誠健華登記了一項 TYK2 抑制劑的 III 期研究稽星,用于中度至重度特應性皮炎(AD)患者。目前全球范圍內尚無 TYK2 抑制劑獲批治療 AD哄谆,ICP-332 是高選擇性 TYK2 抑制劑在特應性皮炎這一適應癥上進展最快的新藥褥民。

圖片來源:CDE 官網
ICP-332 是高效、高選擇性的新型口服 TYK2 抑制劑烙常,通過特異性結合 TYK2 JH1 結構域,阻斷 IL-23鹤盒、IL-12 和 I 型干擾素等炎性細胞因子的信號轉導蚕脏,從而抑制自身免疫性疾病和炎癥性疾病的病理過程。
3 月 11 日侦锯,ICP-332 治療中重度特應性皮炎的 II 期臨床研究結果在年美國皮膚病學會年會(2024 AAD)以口頭報告形式發(fā)布驼鞭。
這是一項為期四周的多中心、隨機尺碰、雙盲挣棕、安慰劑對照的 II 期臨床研究,旨在評估 ICP-332 在治療中重度特應性皮炎患者中的安全性和有效性亲桥。75 名患者隨機分成三組:每一天一次(QD)80 mg 組洛心、120 mg 組 QD 和安慰劑組。
ICP-332 展示了卓越的療效和安全性题篷,達到多個有效性終點:
80 mg 和 120 mg 兩個治療組 EASI 評分較基線改善的百分比變化分別為 78.2% 和 72.5%词身,與安慰劑組的 16.7% 相比,具備顯著的統(tǒng)計學差異木砾;
兩個治療組 EASI 75 應答率均為 64.0%农灯,較安慰劑組(8.0%)改善了 56.0%,優(yōu)于多種獲批創(chuàng)新藥物單藥治療 12 周或 16 周的療效(非頭對頭比較)瘸劳。
此外品扯,ICP-332 80 mg 組 EASI 90 和 IGA 0/1 且較基線改善≥2 分的應答率分別為 44.0% 和 36.0%,顯著優(yōu)于安慰劑組(4.0% 和 4.0%)妖恨,具有顯著統(tǒng)計學意義捻钢。
ICP-332 展示了良好的安全性和耐受性,與安慰劑組相當足沥。
諾誠健華研發(fā)管線聚焦在腫瘤和自免領域稀销,在自免領域,除了 ICP-332,還在 B 細胞和 T 細胞通路打造了一系列差異化的自身免疫性疾病管線栗绝,包括奧布替尼(BTK 抑制劑)甚岩、ICP-488(TYK2-JH2 抑制劑)、ICP-923(IL-17 口服小分子抑制劑)等涕瘸。除了開發(fā)小分子藥物外涡相,未來還會開發(fā)單抗、雙抗剩蟀、ADC 等新藥物形式用于治療自身免疫性疾病催蝗。 多說一點
上周是國內藥企年中財報密集發(fā)布的時期,翰森育特、康方丙号、迪哲等企業(yè)業(yè)績看點不少,Insight 在此做簡單匯總分享:
1缰冤、翰森制藥
8 月 27 日犬缨,翰森制藥發(fā)布 2024 年中期業(yè)績。報告期內棉浸,公司實現營業(yè)收入約 65.06 億元怀薛,同比增長約 44.2%;實現凈利潤約 27.26 億元迷郑,同比增長約 111.5%枝恋。其中創(chuàng)新藥與合作產品收入約 50.32 億元,占收入的 77.4%嗡害。值得一提的是焚碌,翰森制藥抗腫瘤業(yè)務收入 44.75 億元,占到總收入的 68.8%卑竹。
2的讯、康方生物
8 月 28 日,康方生物發(fā)布 2024 半年度報告收黔。上半年某现,康方生物產品收入為 9.394 億元,比去年同期(7.579 億元)增長 23.96%颊嘱。其中宋睦,PD-1/CTLA-4 雙抗卡度尼利單抗持續(xù)放量,銷售額約 7.057 億元腊拍,同比增長 16.5%琐侣。今年 5 月底剛獲批的 PD-1/VEGF 雙抗依沃西單抗,在上市 30 多天的時間里實現了超 1 億元的收入呆淑』憔叮康方目前擁有 50 多個在研創(chuàng)新項目,涵蓋腫瘤、自身免疫史隆、代謝性疾病等多個領域魂务,10 款已處于商業(yè)化或注冊性 III 期臨床試驗階段。
3泌射、迪哲醫(yī)藥
2024 年 8 月 29 日粘姜,迪哲醫(yī)藥公布 2024 年中報,在核心產品舒沃替尼的迅猛放量下熔酷,上半年共實現營收 2.04 億元孤紧,歸屬于母公司股東凈虧損連續(xù)三個季度下降,2024 年上半年較去年同期下降 33%拒秘。
 產業(yè)資訊
產業(yè)資訊
 醫(yī)藥魔方Invest
醫(yī)藥魔方Invest  2024-11-26
2024-11-26
 27
27

 產業(yè)資訊
產業(yè)資訊
 醫(yī)藥魔方
醫(yī)藥魔方  2024-11-26
2024-11-26
 27
27

 產業(yè)資訊
產業(yè)資訊
 藥融圈
藥融圈  2024-11-26
2024-11-26
 26
26