
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 Insight數(shù)據(jù)庫
Insight數(shù)據(jù)庫  2024-09-04
2024-09-04
 404
404
8 月已經(jīng)結(jié)束樱溉。根據(jù) Insight 數(shù)據(jù)庫屹请,總計(jì)有 25 款新藥在八月向 CDE 遞交了上市申請扛芽,包括 9 款新藥的首個(gè) 上市申請和 16 款新藥的新適應(yīng)癥申請泉疆。從治療領(lǐng)域來看蛔乖,其中有 11 個(gè)為抗腫瘤新藥何大,占到了總數(shù)的近 44%拭奖。值得一提的是,11 款抗腫瘤新藥中摇蝗,10 款申報(bào)的是新適應(yīng)癥萧状,涉及肺癌、白血病裆蛆、腎細(xì)胞癌等多個(gè)瘤種捣兄。本文將對這些抗腫瘤新藥做簡要介紹,僅供讀者參閱啼术。
非小細(xì)胞肺癌領(lǐng)域:三款產(chǎn)品報(bào)新適應(yīng)癥
1稍浆、翰森制藥「阿美替尼」
8 月 20 日,CDE 受理了阿美替尼的第 4 項(xiàng)新適應(yīng)癥上市申請猜嘱,并將其納入優(yōu)先審評衅枫,用于治療含鉑根治性放化療后未出現(xiàn)疾病進(jìn)展的不可切除的局部晚期 EGFR 外顯子 19 缺失或外顯子 21(L858R)置換突變的 NSCLC 患者。該申請是基于Ⅲ 期研究 HS-10296-304 的數(shù)據(jù)朗伶,具體研究數(shù)據(jù)尚未披露弦撩。Insight 數(shù)據(jù)庫預(yù)測,該申請有望于 2025 年第二季度獲批腕让。

截圖來源:CDE 官網(wǎng)
阿美替尼是第三代 EGFR-TKI孤钦,此前已在國內(nèi)獲批兩項(xiàng)適應(yīng)癥,分別為:1)用于二線治療既往經(jīng) EGFR-TKI 治療進(jìn)展纯丸,且 T790M 突變陽性的局部晚期或轉(zhuǎn)移性 NSCLC 患者偏形;2)一線治療具有 EGFR 外顯子 19 缺失或外顯子 21(L858R)置換突變陽性的局部晚期或轉(zhuǎn)移性 NSCLC 成人患者。
今年 7 月 19 日觉鼻,CDE 還受理了阿美替尼的第 3 項(xiàng)適應(yīng)癥上市申請俊扭,用于具有 EGFR 外顯子 19 缺失或外顯子 21(L858R)置換突變陽性的 NSCLC 成人患者腫瘤切除術(shù)后的輔助治療。Insight 數(shù)據(jù)庫預(yù)測坠陈,這項(xiàng)申請也有望于 2025 年第二季度獲批贝泞。
2、科倫博泰「蘆康沙妥珠單抗」
8 月 20 日蘸错,CDE 受理科倫博泰 TROP2 ADC 蘆康沙妥珠單抗的第 2 項(xiàng) 上市申請牡罚,用于治療經(jīng) EGFR-TKI 和含鉑化療治療失敗的局部晚期或轉(zhuǎn)移性 EGFR 突變 NSCLC俯炮。該申請已被 CDE 納入優(yōu)先審評,Insight 數(shù)據(jù)庫預(yù)測該申請有望于明年第三季度獲批缰伶。

截圖來源:CDE 官網(wǎng)
本次上市申請是基于一項(xiàng)多中心敦浅、隨機(jī)、關(guān)鍵臨床研究 OptiTROP-Lung03壮煎,該試驗(yàn)評估了蘆康沙妥珠單抗每兩周(Q2W)5 mg/kg 靜脈注射對比多西他賽治療接受 EGFR-TKI 療法和含鉑化療治療失敗的局部晚期或轉(zhuǎn)移性 EGFR 突變 NSCLC 患者的結(jié)果赛琢。在預(yù)設(shè)的分析中,與多西他賽相比触迄,蘆康沙妥珠單抗在 ORR 和 PFS 方面均顯示出顯著統(tǒng)計(jì)學(xué)意義和臨床意義的改善悴碳。
蘆康沙妥珠單抗的首個(gè)上市申請 已于 2023 年 12 月獲 CDE 受理,用于既往至少接受過 2 種系統(tǒng)治療的局部晚期或轉(zhuǎn)移性三陰性乳腺癌惦参,Insight 數(shù)據(jù)庫預(yù)測該申請有望于今年第四季度獲批灾囊。
3、奧賽康藥業(yè)「利厄替尼」
8 月 23 日腥刹,CDE 受理了奧賽康藥業(yè)三代 EGFR-TKI 利厄替尼的第 2 個(gè) NDA疯特,用于具有 EGFR 外顯子 19 缺失(19DEL)或外顯子 21 置換突變(L858R)的局部晚期或轉(zhuǎn)移性 NSCLC 成人患者的一線治療。Insight 數(shù)據(jù)庫預(yù)測該申請有望于 2026 年第三季度獲批肛走。

截圖來源:CDE 官網(wǎng)
該上市申請是基于一項(xiàng)多中心漓雅、隨機(jī)、雙盲朽色、陽性對照 III 期臨床試驗(yàn)(CTR20191523)邻吞,該研究旨在評估 ASK120067 片對照吉非替尼一線治療 EGFR 敏感突變的局部晚期或轉(zhuǎn)移性 NSCLC 患者的有效性和安全性。目前葫男,該 III 期臨床試驗(yàn)已達(dá)到主要研究終點(diǎn)抱冷,具體數(shù)據(jù)尚未披露。
利厄替尼的首個(gè) NDA 于 2021 年 11 月獲 CDE 受理梢褐,用于既往經(jīng) EGFR-TKI 治療時(shí)或治療后出現(xiàn)疾病進(jìn)展旺遮,并且經(jīng)檢測確認(rèn)存在 EGFR T790M 突變陽性,或原發(fā)性 EGFR T790M 突變陽性的局部晚期或轉(zhuǎn)移性 NSCLC 成人患者的二線治療盈咳,Insight 數(shù)據(jù)庫預(yù)測該申請有望于明年一季度獲批耿眉。
兩款 BTK 抑制劑報(bào)新適應(yīng)癥,治療白血病
1淳某、諾誠健華「奧布替尼」
8 月 21 日溅鞠,CDE 受理了諾誠健華 BTK 抑制劑奧布替尼片的新適應(yīng)癥上市申請。根據(jù)奧布替尼正在開展的臨床研究進(jìn)度馍上,推測其本次申報(bào)的新適應(yīng)癥可能為:初治的慢性淋巴細(xì)胞白血病/小淋巴細(xì)胞淋巴瘤仙茴。Insight 數(shù)據(jù)庫預(yù)測該申請有望于明年二季度獲批。

截圖來源:CDE 官網(wǎng)
此前哑暮,奧布替尼已在國內(nèi)獲批 3 項(xiàng)適應(yīng)癥签梭,包括:用于既往至少接受過一種治療的成人慢性淋巴細(xì)胞白血驳缂狻(CLL)/小淋巴細(xì)胞淋巴瘤(SLL)患者以及成人套細(xì)胞淋巴瘤(MCL)患者;以及用于治療復(fù)發(fā)/難治性邊緣區(qū)淋巴瘤(MZL)患者稻悴。
根據(jù)諾誠健華 2024 年中期業(yè)績報(bào)告顯示丛幌,奧布替尼今年二季度銷售額為 2.53 億元,去年同期為 1.70 億元抢纹,同比增長 49%。隨著新適應(yīng)癥的拓展葱妒,該藥的銷售額有望得到進(jìn)一步增長谚剿。
2、阿斯利康「阿可替尼片」
8 月 28 日连锯,CDE 受理了阿斯利康 BTK 抑制劑阿可替尼片的新適應(yīng)癥上市申請归苍。此前,阿可替尼膠囊已在國內(nèi)獲批治療套細(xì)胞淋巴瘤?运怖、單藥適用于既往至少接受過一種治療的成人慢性淋巴細(xì)胞白血财雌(CLL)/小淋巴細(xì)胞淋巴瘤(SLL)患者。根據(jù)該藥的臨床研究進(jìn)度摇展,推測阿可替尼片本次申請適應(yīng)癥可能為用于一線治療慢性淋巴細(xì)胞白血病患者吻氧。Insight 數(shù)據(jù)庫預(yù)測該申請有望于明年二季度獲批。

截圖來源:CDE 官網(wǎng)
阿斯利康曾在今年 4 月宣布咏连,在一項(xiàng)由中國牽頭的隨機(jī)盯孙、多中心、開放標(biāo)簽 III 期臨床試驗(yàn) ChangE 中祟滴,阿可替尼達(dá)到了主要終點(diǎn)振惰。試驗(yàn)數(shù)據(jù)顯示,與苯丁酸氮芥和利妥昔單抗聯(lián)合方案相比垄懂,在所有預(yù)先指定的亞組中均顯示出統(tǒng)計(jì)學(xué)上顯著且臨床上有意義的 PFS 改善骑晶。與苯丁酸氮芥和利妥昔單抗聯(lián)合治療相比,阿可替尼組 OS 益處有改善趨勢秋衡。
腎細(xì)胞癌領(lǐng)域:三款藥物申報(bào)新適應(yīng)癥
1梁促、正大天晴貝「莫蘇拜單抗」+「安羅替尼」
8 月 1 日,CDE 受理了正大天晴貝莫蘇拜單抗注射液聯(lián)合鹽酸安羅替尼膠囊的新適應(yīng)癥上市申請挑卫,用于一線治療晚期不可切除或轉(zhuǎn)移性腎細(xì)胞癌(RCC)榔况,Insight 數(shù)據(jù)庫預(yù)測該申請有望于明年第二季度獲批。


截圖來源:CDE 官網(wǎng)
貝莫蘇拜單抗是 PD-L1 單抗勃拢,此前已在國內(nèi)獲批小細(xì)胞肺癌一線治療钩榄,并于今年 2 月申報(bào)了子宮內(nèi)膜癌的新適應(yīng)癥 NDA。安羅替尼是一種多靶點(diǎn)酪氨酸激酶抑制劑后涛,此前已在國內(nèi)獲批治療非小細(xì)胞肺癌武也、軟組織肉瘤依播、小細(xì)胞肺癌、甲狀腺髓樣癌耿逐、甲狀腺分化癌娱必,本次是其在國內(nèi)申報(bào)上市的第八個(gè)適應(yīng)癥。
本次的新適應(yīng)癥 NDA 是基于 ETER100 研究(NCT04523272)醇舶。這是一項(xiàng)隨機(jī)姻蚓、開放、陽性藥物平行對照匣沼、多中心 III 期臨床研究狰挡,旨在評估貝莫蘇拜單抗聯(lián)合安羅替尼和對照組一線治療晚期不可切除或轉(zhuǎn)移性 RCC 的有效性和安全性。研究顯示释涛,與對照組相比加叁,貝莫蘇拜單抗聯(lián)合安羅替尼一線治療晚期 RCC 可顯著降低患者的疾病進(jìn)展或死亡風(fēng)險(xiǎn),同時(shí)可改善 ORR唇撬、OS 等次要終點(diǎn)它匕。該研究已入選 2024 年 ESMO 大會的 LBA 摘要,正大天晴屆時(shí)將會公布研究的具體數(shù)據(jù)窖认。
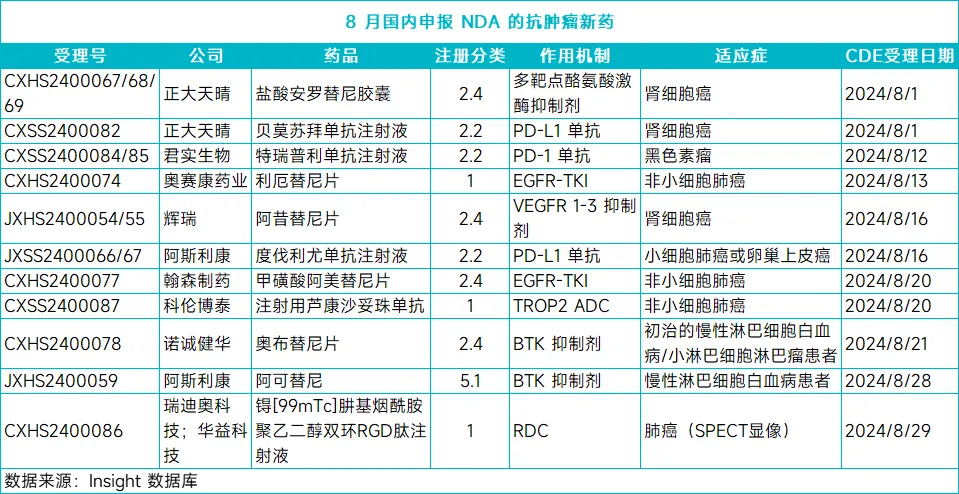
2豫柬、輝瑞「阿昔替尼」
8 月 16 日,CDE 受理了輝瑞阿昔替尼的新適應(yīng)癥上市申請扑浸。阿昔替尼是一種作用于血管內(nèi)皮生長因子受體(VEGFR)1轮傍、2 和 3 的高選擇性酪氨酸激酶抑制劑,此前已于 2015 年在國內(nèi)獲批用于晚期腎細(xì)胞癌成人患者的二線治療首装。根據(jù)阿昔替尼正在開展的臨床研究進(jìn)度抱典, Insight 數(shù)據(jù)庫推測其本次申報(bào)的新適應(yīng)癥可能為:用于一線治療轉(zhuǎn)移性腎細(xì)胞癌患者。
截圖來源:CDE 官網(wǎng)
在一項(xiàng)在美國赊偿、中國绵另、印度等國家和地區(qū)開展的國際多中心 Ⅱ/Ⅲ 期臨床試驗(yàn)(CTR20132930)中,研究人員已比較了接受阿昔替尼和索拉非尼治療的初始腎細(xì)胞癌患者的效果绅鉴。試驗(yàn)數(shù)據(jù)顯示:阿昔替尼組的 mPFS 為 10.1 個(gè)月姨莽,而索拉非尼組為 6.5 個(gè)月; ORR 方面,阿昔替尼組為 35.4%既蛙,也高于索拉非尼組的 16.7%仲侈;OS 方面,阿昔替尼組為 31.5 個(gè)月 蓖社,索拉非尼組為 23.3 個(gè)月秆惑。
其它抗腫瘤新藥
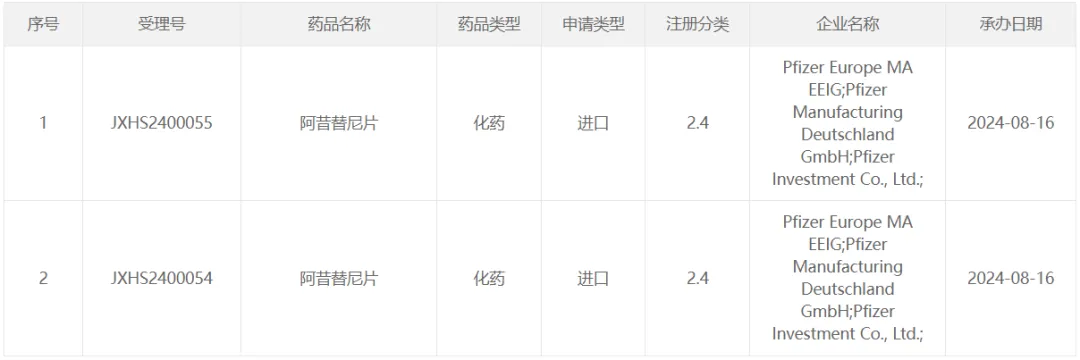
1、君實(shí)生物「特瑞普利單抗」
8 月 12 日,CDE 受理君實(shí)生物 PD-1 抑制劑特瑞普利單抗注射液的新適應(yīng)癥上市申請哗蛋,用于不可切除或轉(zhuǎn)移性黑色素瘤一線治療词祝。如果獲批,其將有望成為國內(nèi)首個(gè)晚期黑色素瘤一線免疫療法届谈。
截圖來源:CDE 官網(wǎng)
本次新適應(yīng)癥的 NDA 主要基于一項(xiàng)多中心枯夜、隨機(jī)、開放艰山、陽性藥對照的Ⅲ期臨床研究 MELATORCH(NCT03430297)湖雹,該試驗(yàn)旨在比較特瑞普利單抗對比達(dá)卡巴嗪在既往未接受系統(tǒng)抗腫瘤治療的不可切除或轉(zhuǎn)移性黑色素瘤患者中的有效性和安全性。研究結(jié)果表明曙搬,與達(dá)卡巴嗪相比摔吏,特瑞普利單抗可顯著延長患者的 PFS。
特瑞普利單抗此前已在國內(nèi)獲批 10 項(xiàng)適應(yīng)癥织鲸。君實(shí)財(cái)報(bào)顯示,上半年溪胶,特瑞普利單抗實(shí)現(xiàn)國內(nèi)市場銷售收入人民幣 6.71 億元搂擦,同比增長約 50%。此外哗脖,特瑞普利單抗還有兩項(xiàng) sNDA 已獲得 NMPA 受理瀑踢,分別針對肝細(xì)胞癌和黑色素瘤。
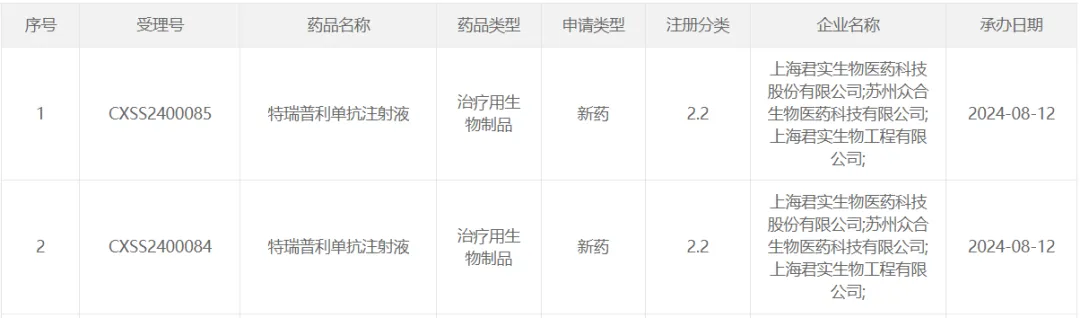
2才避、阿斯利康「度伐利尤單抗」
8 月 16 日咱茂,CDE 受理了阿斯利康 PD-L1 抑制劑度伐利尤單抗注射液的新適應(yīng)癥上市申請。此前度伐利尤單抗已在國內(nèi)獲批 3 項(xiàng)適應(yīng)癥棕优,分別用于治療 III 期非小細(xì)胞肺癌缴碉、廣泛期小細(xì)胞肺癌、局部晚期或轉(zhuǎn)移性膽道癌患者佣虑。
截圖來源:CDE 官網(wǎng)
根據(jù)度伐利尤單抗正在開展的臨床研究進(jìn)度叁乍, Insight 數(shù)據(jù)庫推測其本次申報(bào)的新適應(yīng)癥可能為:1)聯(lián)合奧拉帕利、貝伐珠單抗和鉑類化療用于治療新診斷晚期高級別上皮性卵巢癌(無腫瘤 BRCA 突變)患者弧定;或者 2)用于接受鉑類同步放化療后病情未進(jìn)展的局限期小細(xì)胞肺癌患者的鞏固治療则沃。
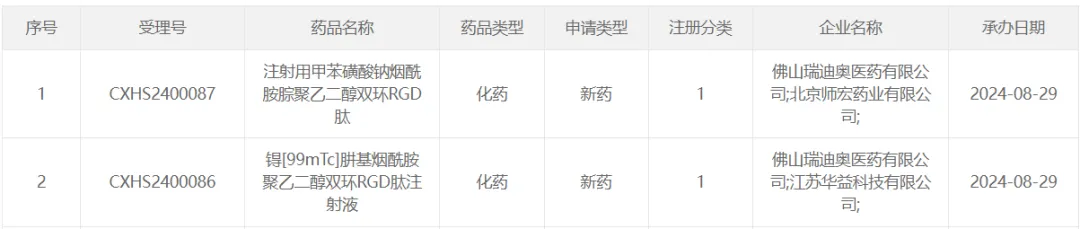
3、瑞迪奧科技「99mTc-3PRGD2」
8 月 29 日锡跺,CDE 受理了瑞迪奧科技和華益科技聯(lián)合申報(bào)的锝 [99mTc] 肼基煙酰胺聚乙二醇雙環(huán) RGD 肽注射液(99mTc-3PRGD2)的上市申請章迎。99mTc-3PRGD2 是一款以整合素為靶點(diǎn)的 RDC 藥物, Insight 數(shù)據(jù)庫推測該藥本次申報(bào)上市擬用于肺部腫瘤良惡診斷及淋巴結(jié)轉(zhuǎn)移診斷渴甜。
截圖來源:CDE 官網(wǎng)
8月申報(bào)上市的非腫瘤新藥
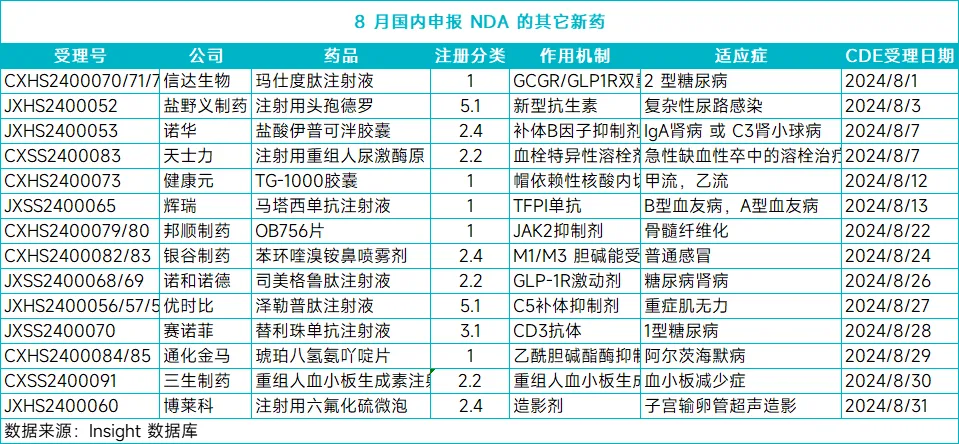
除了上述的抗腫瘤新藥焚寂,8月還有許多其它治療領(lǐng)域的新藥也在中國申報(bào)上市或提交了新適應(yīng)癥NDA(見下表),適應(yīng)癥包括阿爾茨海默病、1型糖尿病粉臊、重癥肌無力草添、骨髓纖維化、血友病扼仲、糖尿病腎病等等远寸,限于篇幅,此處不再一一介紹屠凶。
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥魔方Invest
醫(yī)藥魔方Invest  2024-11-26
2024-11-26
 24
24

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥魔方
醫(yī)藥魔方  2024-11-26
2024-11-26
 24
24

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-11-26
2024-11-26
 24
24
 熱門資訊
熱門資訊