
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 獵藥人俱樂部
獵藥人俱樂部  2024-09-06
2024-09-06
 400
400
根據(jù)醫(yī)藥魔方數(shù)據(jù)庫,2024年1-8月傀缩,國內(nèi)藥企共發(fā)生了57筆創(chuàng)新藥license in交易殖熟,披露的交易總金額達24.7億美元略水,其中轉(zhuǎn)讓方是中國企業(yè)的交易占比達65%为猩。
本文按總金額和首付款整理了今年1-8月份中國創(chuàng)新藥license in交易TOP10链快,并將按照首付款榜單簡單介紹相關(guān)交易凉危,供參考秩菩。
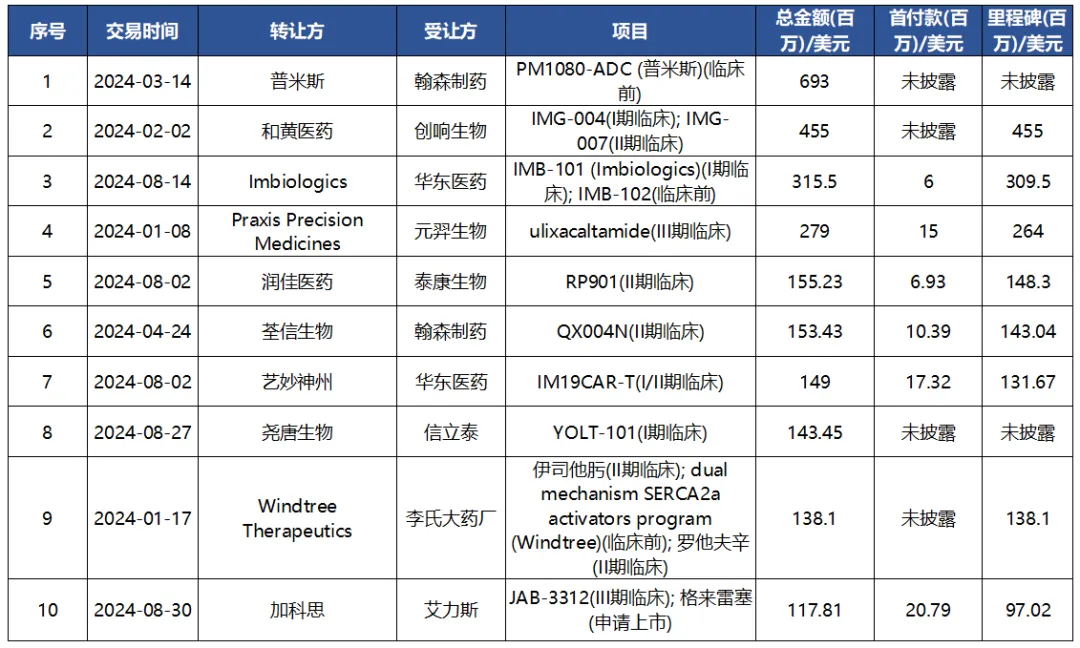
2024年(1-8月)中國創(chuàng)新藥license in交易TOP10(按總金額計)
2024年(1-8月)中國創(chuàng)新藥license-in交易TOP10(按首付款計)
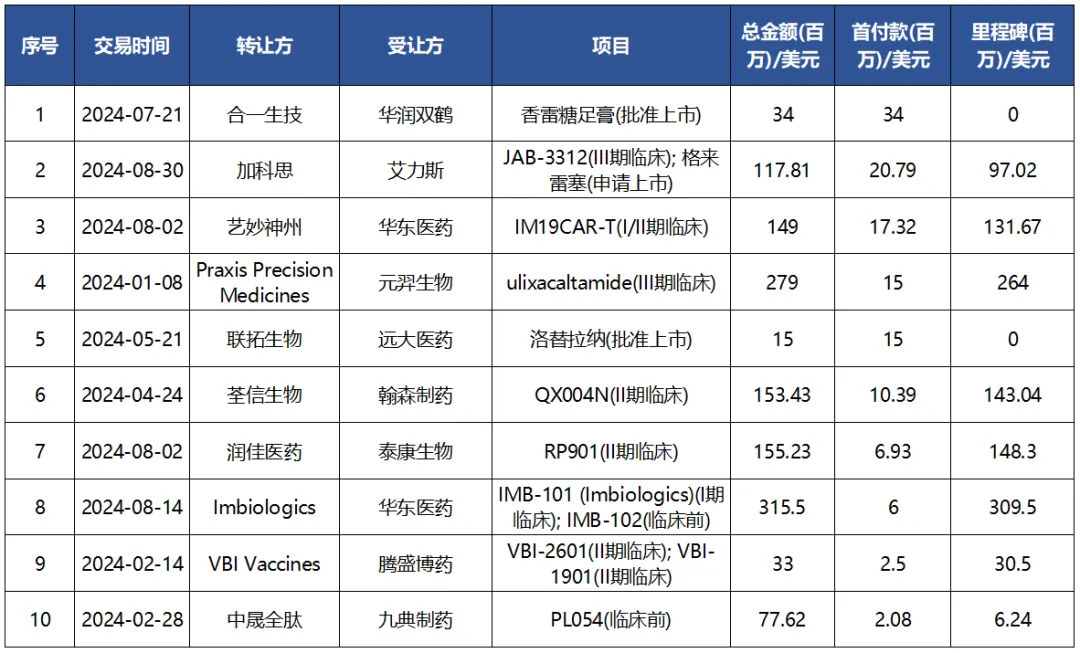
(注:數(shù)據(jù)截至發(fā)稿日期,本文統(tǒng)計數(shù)據(jù)包括國內(nèi)企業(yè)之間的授權(quán)許可引進和跨境授權(quán)許可引進域曼;此外首付款僅根據(jù)已披露數(shù)據(jù)排名)
NO.1 華潤雙鶴獲得新藥“速必一”中國大陸地區(qū)20年獨家代理權(quán)
7月19日下午浪顽,華潤雙鶴藥業(yè)股份有限公司與中天(上海)生物科技有限公司、合一生技股份有限公司簽訂獨家銷售代理合約俱篡,獲得香雷糖足膏(速必一)中國大陸地區(qū)20年獨家代理權(quán)东悔,將極大提高“速必一”藥物可及性,惠及更多糖尿病患者祷安,為兩岸新藥聯(lián)手研發(fā)注入新的活力姥芥。依據(jù)合約兔乞,華潤雙鶴將先支付中天上海簽約金最高達約3,400萬美元(約新臺幣11.2億元) 汇鞭,其中約680萬美元將視醫(yī)保結(jié)果而定。
“速必一”于2023年11月通過中國第一個1.1類天然藥物新藥許可庸追,也是糖尿病足潰瘍中國大陸第一個專項新藥霍骄。國際糖尿病聯(lián)盟 (IDF) 2021年數(shù)據(jù)顯示,我國成人糖尿病患者數(shù)達1.41億人淡溯,我國50歲以上的糖尿病患者读整,糖尿病足的發(fā)病率高達8.1%,總截肢率19.03%咱娶,是一個重大未滿足的醫(yī)療迫切需求米间。
作為我國第一個天然藥物1.1類新藥、治療糖尿病足潰瘍第一個專項新藥膘侮,“速必一”的研發(fā)歷程長達15年屈糊,其創(chuàng)新藥物作用機制在于重塑創(chuàng)面微環(huán)境的榛,平衡M1/M2巨噬細胞,促進糖尿病足潰瘍轉(zhuǎn)化為正常創(chuàng)面潦故,加速愈合過程仔同。這一突破性療法得到了國際社會的廣泛認可,包括美國FDA的“快速通道”認定庐穴,以及在中國大陸圃靖、中國臺灣、新加坡和馬來西亞等地的藥證注冊蝇硅。與傳統(tǒng)治療方式相比榛蜻,“速必一”方便使用,具有明顯的經(jīng)濟優(yōu)勢蛮昭。此外藥物安全性高峰礁,為患者提供了更為安全舒適的治療體驗。
NO.2 加科思KRAS G12C腋积、SHP2授權(quán)給艾力斯
8月30日鞠洪,加科思宣布將KRAS G12C抑制劑Glecirasib、SHP2抑制劑JAB-3312的大中華區(qū)權(quán)益授權(quán)給艾力斯平敏,加科思保留大中華區(qū)外全球權(quán)益乏唤。根據(jù)協(xié)議,艾力斯生物支付1.5億元預(yù)付款愤惰,5000萬元研發(fā)開支補償及其他款項苇经,7億元開發(fā)及銷售里程碑金額,以及兩位數(shù)比例的銷售分成宦言,其中JAB-3312的銷售分成最高為20%扇单。
戈來雷塞(Glecirasib,JAB-21822)是加科思自主研發(fā)的KRAS G12C抑制劑奠旺,主要用于 KRAS G12C 突變的晚期實體瘤患者的治療蜘澜。戈來雷塞用于KRAS G12C突變二線非小細胞肺癌的新藥上市申請(NDA)已于2024年5月21日獲得優(yōu)先審評。2022年12月响疚,戈來雷塞被國家藥品監(jiān)督管理局藥品評審中心授予用于KRAS G12C突變的晚期或轉(zhuǎn)移性非小細胞肺癌患 者二線及以上治療的突破性治療藥物認定鄙信。2024年4月,加科思在ASCO Plenary Series公布的戈來雷塞二期注冊性臨床試驗數(shù)據(jù)顯示忿晕,在二線非小細胞肺癌患者中装诡,確認客觀緩解率(cORR)為47.9%(56/117),其中包括4例患者實現(xiàn)完全緩解(CR)践盼,36例患者腫瘤縮小超過50%鸦采,疾病控制率(DCR)為86.3%。中位無進展生存期(mPFS)為8.2個月,中位總生存期(mOS)為13.6個月蜗南。
JAB-3312 是RAS信號通路關(guān)鍵節(jié)點SHP2的選擇性變構(gòu)抑制劑澄俘,是全球唯一進入三期試驗的SHP2抑制劑,獲美國FDA食道癌(包括食管鱗癌)的孤兒藥認定堤麻。
NO.3 華東醫(yī)藥與藝妙神州就CAR-T產(chǎn)品達成合作
8月2日酸儿,華東醫(yī)藥與藝妙神州宣布,雙方就后者靶向CD19的自體CAR-T候選產(chǎn)品IM19嵌合抗原受體T細胞注射液(以下簡稱“IM19注射液”)紧甫,達成在中國大陸地區(qū)的商業(yè)化合作昵鳍。根據(jù)協(xié)議條款,藝妙神州將獲得1.25億元人民幣首付款匀洪,并有權(quán)獲得最高不超過9.5億人民幣的注冊及銷售里程碑付款难宋。藝妙神州將繼續(xù)負責(zé)IM19注射液在中國大陸地區(qū)的開發(fā)、注冊和生產(chǎn)厕扼。
此次標(biāo)的產(chǎn)品——IM19嵌合抗原受體T細胞注射液乙闰,是藝妙神州自主研發(fā)的第一款CAR-T細胞治療產(chǎn)品,先后獲得國家藥品監(jiān)督管理局三個適應(yīng)癥的藥物臨床試驗批準(zhǔn)通知書胚茴,分別為復(fù)發(fā)難治彌漫大B細胞淋巴瘤互墓、急性B淋巴細胞白血病和套細胞淋巴瘤,并已全部進入注冊臨床研究階段蒋搜。
其中篡撵,針對彌漫大B細胞淋巴瘤末線治療的研究,即將完成II期臨床試驗(確證性臨床試驗)豆挽,臨床療效和安全性數(shù)據(jù)良好育谬。針對急性B淋巴細胞白血病和套細胞淋巴瘤的研究,均已完成I期所有受試者回輸帮哈,即將進入II期臨床試驗膛檀。未來,藝妙神州還計劃開展針對彌漫大B細胞淋巴瘤二線治療的臨床試驗娘侍。此次合作咖刃,授權(quán)范圍為所有B細胞血液腫瘤的治療,包括復(fù)發(fā)或難治的彌漫大B細胞淋巴瘤私蕾、急性B淋巴細胞白血病和套細胞淋巴瘤等僵缺。
IM19 CAR-T細胞注射液有望于2024年四季度遞交上市申請胡桃,上市后有望躋身國產(chǎn)CAR-T細胞治療藥物第一梯隊踩叭,有效填補國產(chǎn)自主CAR-T產(chǎn)品在淋巴瘤適應(yīng)癥的市場空白,為中國數(shù)十萬淋巴瘤患者帶來新的希望昵裁。
NO.4 元羿生物引進一款神經(jīng)系統(tǒng)小分子藥物
1月8日锋辩,元羿生物宣布與Praxis Precision Medicines(以下簡稱Praxis公司)達成獨家合作和許可協(xié)議,元羿生物將在大中華地區(qū)開發(fā)并商業(yè)化治療原發(fā)性震顫的ulixacaltamide祈痢。作為合作協(xié)議的一部分叽燃,Praxis公司將獲得1500萬美元的首付款缕沟,其中包括500萬美元現(xiàn)金和1000萬美元的普通股投資。此外校惧,Praxis公司預(yù)計將獲得2.64億美元的開發(fā)葛暇、監(jiān)管和商業(yè)化里程碑付款,以及大中華地區(qū)凈銷售額的分級特許權(quán)使用費竣篷。
Ulixacaltamide是一種分化的高選擇性T型鈣通道小分子抑制劑尼软,旨在阻斷與震顫活動相關(guān)的小腦-丘腦-皮質(zhì)(CTC)環(huán)路中的異常神經(jīng)元爆發(fā)放電。該產(chǎn)品正在美國開展用于治療原發(fā)性震顫的3期臨床研究傲丹。在此前的2期臨床研究中便透,研究人員已經(jīng)觀察到服用普萘洛爾的原發(fā)性震顫患者在添加ulixacaltamide時獲得了額外的益處。
4月17日酬俯,中國國家藥監(jiān)局藥品審評中心(CDE)官網(wǎng)公示航厚,由Praxis公司申報的1類新藥ulixacaltamide緩釋片獲得臨床試驗?zāi)驹S可,擬開發(fā)治療原發(fā)性震顫(ET)锰蓬。
NO.5 遠大醫(yī)藥布局創(chuàng)新治療蠕形螨瞼緣炎及蠕形螨導(dǎo)致的瞼板腺功能障礙產(chǎn)品
5月21日幔睬,遠大醫(yī)藥(0512.HK)與聯(lián)拓生物科技有限公司(聯(lián)拓生物)和Tarsus Pharmaceuticals, Inc. (Tarsus)達成產(chǎn)品引進戰(zhàn)略合作協(xié)議。在相關(guān)條件獲得滿足后芹扭,遠大醫(yī)藥將以1,500萬美元的首付款及一定金額的注冊里程碑費用為代價取得用于治療蠕形螨瞼緣炎及蠕形螨導(dǎo)致的瞼板腺功能障礙的全球創(chuàng)新眼用制劑TP-03在大中華區(qū)(中國大陸溪窒、中國香港、中國澳門冯勉、中國臺灣)的獨家開發(fā)澈蚌、生產(chǎn)及商業(yè)化權(quán)益。
TP-03是一款對γ-氨基丁酸門控氯離子通道(GABA-Cl)具有選擇性的非競爭性拮抗劑灼狰,其通過選擇性抑制蠕形螨體內(nèi)的GABA-Cl宛瞄,使蟲體麻痹和死亡,進而徹底治愈蠕形螨瞼緣炎交胚。此外份汗,TP-03具有高度親脂性,可促進其在螨蟲棲息的睫毛毛囊油脂中的吸收蝴簇。
TP-03已在美國完成了兩項關(guān)鍵性臨床研究伤刑,共入組800余名蠕形螨瞼緣炎患者,根據(jù)臨床結(jié)果顯示鹤曼,兩項研究均達到了主要終點和所有次要終點入撇,具有統(tǒng)計學(xué)意義,且未發(fā)生與治療相關(guān)的嚴重不良事件暇创。該產(chǎn)品已于2023年7月獲得美國食品藥品監(jiān)督管理局(FDA)批準(zhǔn)上市晤裆,是目前FDA批準(zhǔn)的首款也是唯一一款針對蠕形螨瞼緣炎的藥物。此外,TP-03在美國開展的用于治療蠕形螨導(dǎo)致的瞼板腺功能障礙的II期臨床研究也顯示出了陽性的頂線結(jié)果停间。
中國注冊方面温履,TP-03已完成了III期臨床研究,根據(jù)研究結(jié)果顯示叙棚,與對照組相比亥护,TP-03治療蠕形螨瞼緣炎患者的蠕形螨感染根除率具有統(tǒng)計學(xué)顯著性(p<0.001),眼瞼袖套狀分泌物治愈率也呈現(xiàn)出陽性但無統(tǒng)計學(xué)意義的趨勢(p=0.15)粗排。此外疙岂,TP-03耐受性良好,其安全性特征與其它大規(guī)模臨床試驗中觀察到的結(jié)果相似彬呻,無治療相關(guān)的停藥情況衣陶。本次交易完成后,遠大醫(yī)藥將大力推進TP-03在中國的注冊落地工作闸氮,盡早惠及廣大蠕形螨瞼緣炎患者剪况。
NO.6 翰森制藥引進荃信生物一款單抗新藥
4月25日,翰森制藥發(fā)布公告稱與荃信生物簽訂許可協(xié)議蒲跨。翰森制藥將獲得荃信生物的獨家許可译断,以在中國(包括中國香港、澳門及臺灣地區(qū))開發(fā)及商業(yè)化QX004N單抗或悲。
根據(jù)協(xié)議孙咪,翰森制藥將負責(zé)QX004N所有可開發(fā)劑型和適應(yīng)癥于中國的研發(fā)、生產(chǎn)及商業(yè)化巡语,并將支付7500萬元人民幣首付款及不超過10.32億元人民幣的研發(fā)翎蹈、監(jiān)管及基于銷售的商業(yè)化里程碑潛在付款,以及基于未來產(chǎn)品銷售的分級特許權(quán)使用費男公。
QX004N注射液是一款特異性結(jié)合人IL-23的重組人源化IgG1單克隆抗體荤堪,屬于治療用生物制品1類創(chuàng)新藥,目前正在開展針對銀屑病的Ⅱ期臨床試驗和針對克羅恩病的Ⅰa期臨床試驗码完。QX004N通過特異性結(jié)合人IL-23的p19亞基办适,阻斷細胞外IL-23與細胞表面IL-23受體的結(jié)合,抑制IL-23介導(dǎo)的促炎細胞因子和趨化因子的釋放银悄,從而達到治療效果点溶。
NO.7 邁威生物與潤佳醫(yī)藥簽訂許可協(xié)議,拓展骨健康領(lǐng)域布局
8月2日淫雾,邁威生物宣布其 泰康生物與潤佳醫(yī)藥就在研品種RP901項目簽署許可協(xié)議比端。根據(jù)協(xié)議,潤佳醫(yī)藥許可泰康生物在大中華區(qū)域(包括中國大陸厢卖、香港擎津、澳門和臺灣)內(nèi)研究、開發(fā)(包括通過合同研究組織研究或開發(fā))啊嘁、注冊朵聪、商業(yè)化以及銷售 RP901 項目及伴隨診斷(僅為使用許可產(chǎn)品之目的開發(fā))的權(quán)益。
RP901 是一款骨關(guān)節(jié)炎(osteoarthritis干际,OA)治療領(lǐng)域潛在 First-in-class 的小分子藥物亮花,擬開發(fā)為用于骨關(guān)節(jié)炎口服治療的 1 類新藥。它經(jīng)口服進入人體之后弓熏,可富集于關(guān)節(jié)腔內(nèi)恋谭,通過提高關(guān)節(jié)軟骨合成代謝及降低關(guān)節(jié)軟骨分解代謝改善骨關(guān)節(jié)炎患者的軟骨破壞,從而發(fā)揮對骨關(guān)節(jié)炎的治療作用挽鞠。臨床前藥效研究結(jié)果表明其具有明確的骨保護和骨關(guān)節(jié)炎改善作用疚颊;臨床前藥代動力學(xué)研究結(jié)果表明 RP901 在大鼠和猴中具有較高的口服生物利用度,采用同位素標(biāo)記手段研究表明RP901 在骨關(guān)節(jié)靶器官有良好分布信认;臨床前安全性及 I 期臨床實驗結(jié)果表明 RP901 具有良好的安全性材义。RP901 片治療膝骨關(guān)節(jié)炎的 II 期臨床研究正在國內(nèi)開展。邁威生物已有兩款骨科領(lǐng)域藥物上市嫁赏,即邁衛(wèi)健?(骨腫瘤領(lǐng)域)和邁利舒?(骨質(zhì)疏松領(lǐng)域)其掂。本次合作將進一步拓展邁威生物在骨健康領(lǐng)域的產(chǎn)品布局。
NO.8 華東醫(yī)藥與IMBiologics就創(chuàng)新自身免疫產(chǎn)品達成獨家戰(zhàn)略合作
8月14日潦蝇,華東醫(yī)藥全資子公司杭州中美華東制藥有限公司與IMBiologics(一家專注于為自身免疫性疾病和癌癥開發(fā)創(chuàng)新產(chǎn)品的韓國生物技術(shù)公司)款熬,宣布就IMB-101和IMB-102(以下簡稱“許可產(chǎn)品”)在包含中國在內(nèi)的37個亞洲國家(不含日本、韓國和朝鮮)(以下簡稱“許可區(qū)域”)的開發(fā)攘乒、注冊贤牛、生產(chǎn)和商業(yè)化達成獨家戰(zhàn)略合作協(xié)議。
根據(jù)協(xié)議條款袁挟,IMBiologics將獲得600萬美元的首付款径瘪,200萬美元技術(shù)轉(zhuǎn)移里程碑付款,最高不超過30,750萬美元的開發(fā)冕店、注冊及銷售里程碑付款患敢,以及分級最高達兩位數(shù)的凈銷售額提成費。
華東醫(yī)藥將負責(zé)許可產(chǎn)品在許可區(qū)域的開發(fā)嘁压、注冊邦孽、生產(chǎn)和商業(yè)化。IMBiologics將繼續(xù)負責(zé)IMB-101和IMB-102在其他地區(qū)的開發(fā)和商業(yè)化爆踱。此交易自協(xié)議簽署之日起生效揣喻。
IMB-101是靶向 OX40L和 TNFα的雙特異性抗體,參與調(diào)節(jié)炎癥細胞因子,促進T細胞和漿細胞分化变抡,以及自身抗體產(chǎn)生汰畔,維持免疫穩(wěn)態(tài)平衡括绣。2023年,IMBiologics向美國食品藥品監(jiān)督管理局(FDA)遞交IMB-101的IND申請并獲得批準(zhǔn)捂滓。該藥物目前正在美國進行Ⅰ期臨床試驗监氢,擬用于治療類風(fēng)濕關(guān)節(jié)炎。
IMB-102是一種靶向OX40L的單克隆抗體藤违,目前處于臨床前研究階段浪腐,潛在適應(yīng)癥包括中重度特應(yīng)性皮炎及其他自身免疫性疾病。
NO.9 騰盛博藥宣布將從VBI收購BRII-179(VBI-2601)的知識產(chǎn)權(quán)
2月14日顿乒,騰盛醫(yī)藥宣布與VBI Vaccines, Inc.(“VBI”议街,NASDAQ:VBIV)達成協(xié)議,以確保擴大并掌控BRII-179的未來臨床和商業(yè)供應(yīng)璧榄。BRII-179是騰盛博藥乙肝(HBV)功能性治愈產(chǎn)品組合中處于后期臨床階段的產(chǎn)品特漩。
根據(jù)協(xié)議,騰盛博藥最初將向VBI開具250萬美元的本票骨杂,這將取消PreHevbri相關(guān)的特許權(quán)使用費和里程碑費用拾稳。在滿足特定條件后,票據(jù)將增加至1,000萬美元腊脱,以獲得VBI在BRII-179的所有知識產(chǎn)權(quán)访得,BRII-179相關(guān)付款也都將被取消。此外陕凹,在滿足特定條件后左启,騰盛博藥會和VBI一起合作將BRII-179的生產(chǎn)技術(shù)轉(zhuǎn)移至騰盛博藥指定的生產(chǎn)基地。
BRII-179(VBI-2601)是一種基于重組蛋白質(zhì)的新型HBV 免疫治療候選藥物贸薇,可表達Pre-S1技腻、Pre-S2和S HBV表面抗原,旨在誘導(dǎo)增強和廣泛的B細胞和T細胞免疫應(yīng)答鸡犯。作為治療慢性HBV感染的潛在功能性治愈方案的一部分仓筷,騰盛博藥正在開展BRII-179與BRII-835(VIR-2218)聯(lián)合用藥,及BRII-179與PEG-IFNα聯(lián)合用藥的兩項2期研究葫柴。
騰盛博藥于2018年12月從VBI Vaccines, Inc.(“VBI”)引進了BRII-179聂弓,獲得了在包括中國大陸,香港舍辐,澳門和臺灣地區(qū)的商業(yè)化權(quán)益拔若。公司還自2023年7月起,將BRII-179的獨家許可擴展至全球市場茬燃。2023年11月驳楞,中國國家藥品監(jiān)督管理局(NMPA)藥品審評中心(CDE)授予BRII-179突破性治療認定。
NO.10 九典制藥與中晟全肽強強合作兵罢,加速多肽創(chuàng)新藥研發(fā)進程
2月28日献烦,九典制藥與中晟全肽成功簽署抗菌抗炎多肽專利及技術(shù)轉(zhuǎn)讓協(xié)議滓窍。多肽藥物與小分子藥物相比具有高選擇性、高活性和高安全性的優(yōu)勢巩那,已經(jīng)廣泛應(yīng)用到心血管疾病吏夯、中樞神經(jīng)疾病、呼吸拢操、抗腫瘤與免疫調(diào)節(jié)以及抗感染等領(lǐng)域锦亦,可以與大分子抗體藥物以及小分子藥物進行良好的互補舶替,具有廣闊的市場空間令境。
該項目的多肽分子擁有抗菌與抗炎雙重功能,九典制藥將取得該項目在全球進一步開發(fā)顾瞪、生產(chǎn)和商業(yè)化上述多肽候選藥物的獨家權(quán)益舔庶,同時擁有該專利在醫(yī)美等大健康領(lǐng)域的全球獨家權(quán)益。
參考資料:
1陈醒、各公司公眾號
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥魔方Invest
醫(yī)藥魔方Invest  2024-11-26
2024-11-26
 19
19

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥魔方
醫(yī)藥魔方  2024-11-26
2024-11-26
 19
19

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-11-26
2024-11-26
 19
19