
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)麥客
醫(yī)麥客  2024-09-06
2024-09-06
 401
401
自然殺傷(NK)細(xì)胞是人體免疫系統(tǒng)的一部分,被稱為“抗癌第一道防線”暑懊,其可在無(wú)抗體或MHC的情況下宋旭,識(shí)別靶細(xì)胞并進(jìn)行快速的免疫反應(yīng)详毡。這項(xiàng)“特異功能”使NK細(xì)胞逐漸受到廣泛關(guān)注即粗。
NK細(xì)胞由獨(dú)特的先天淋巴樣細(xì)胞群組成浮两,具有多種細(xì)胞毒性機(jī)制和通過細(xì)胞因子調(diào)節(jié)免疫反應(yīng)的能力庸娱,在抗癌免疫中扮演著關(guān)鍵的角色啃炸。過去幾十年中,NK細(xì)胞的潛力得到了廣泛的研究加派。

近日叫确,《Cancer Cell》上發(fā)表了一篇題為“Interleukin-21 engineering enhances NK cell activity against glioblastoma via CEBPD”的文章,概述了IL12工程化改造后的NK細(xì)胞具有卓越的腫瘤控制能力,且毒性非常有限玲装。
從研發(fā)模式來看谍潮,目前基于NK細(xì)胞的創(chuàng)新療法的臨床藥物開發(fā)主要有3個(gè)方向,包括:非工程化的NK細(xì)胞墅糯、工程化的NK細(xì)胞(例如CAR-NK細(xì)胞療法慷啊、TCR-NK細(xì)胞療法等)以及NK細(xì)胞聯(lián)合療法(NK細(xì)胞接合器)。
除了按照是否工程化對(duì)NK細(xì)胞療法進(jìn)行分類外况逼,還可以從多個(gè)維度進(jìn)行細(xì)分某扑,如根據(jù)NK細(xì)胞來源以及治療癌癥類型進(jìn)行區(qū)分。NK細(xì)胞療法不僅來源多樣化了槽,而且在臨床研究均未發(fā)現(xiàn)NK細(xì)胞來源引發(fā)的嚴(yán)重安全事故筐积,同時(shí)在實(shí)體瘤治療中有諸多探索,在肺癌揉罗、黑色素瘤元炭、乳腺癌等研究中都取得了一定的進(jìn)展。
多頭并進(jìn)掷情,多點(diǎn)開花
非工程化NK細(xì)胞療法
NK細(xì)胞憑借其天然的殺傷癌細(xì)胞潛力,能夠在不經(jīng)過基因修飾的情況下瘩将,直接回輸至患者體內(nèi)進(jìn)行治療吟税。不同于T細(xì)胞、B細(xì)胞姿现,NK細(xì)胞具有天然廣譜的殺傷機(jī)制肠仪,無(wú)需抗原呈遞,不受主要組織相容性復(fù)合體(MHC)限制备典,且起效速度快异旧。此外,NK細(xì)胞不含TCR提佣,因此異體使用不會(huì)引發(fā)移植物抗宿主病(GvHD)吮蛹。
非工程化NK細(xì)胞主要源自外周血,其次為造血干細(xì)胞拌屏。目前潮针,該療法在惡性血液腫瘤領(lǐng)域占主導(dǎo),占比高達(dá)65%倚喂,主要適應(yīng)癥包括急性髓系白血病每篷、骨髓增生異常綜合征以及多發(fā)性骨髓瘤。而在實(shí)體瘤領(lǐng)域笛吱,其占比為35%搁蛤,研究熱點(diǎn)集中于非小細(xì)胞肺癌、肝癌、卵巢癌建搞、膠質(zhì)母細(xì)胞瘤和頭頸部腫瘤等芥嫉。
據(jù)粗略統(tǒng)計(jì),全球近90%的NK細(xì)胞療法是自體/異體NK細(xì)胞療法猎肄。對(duì)比國(guó)內(nèi)外進(jìn)展融沟,國(guó)外研究項(xiàng)目整體上稍領(lǐng)先。如CytoImmune欠住、Celularity浮烫、Artiva Biotherapeutics、NKGen Biotech等公司已有候選藥物推進(jìn)臨床揉民;而國(guó)內(nèi)則多為早期研發(fā)階段杆荐,目前啟函生物、恩凱賽藥鼎嫉、景達(dá)生物等進(jìn)展稍領(lǐng)先诉濒。
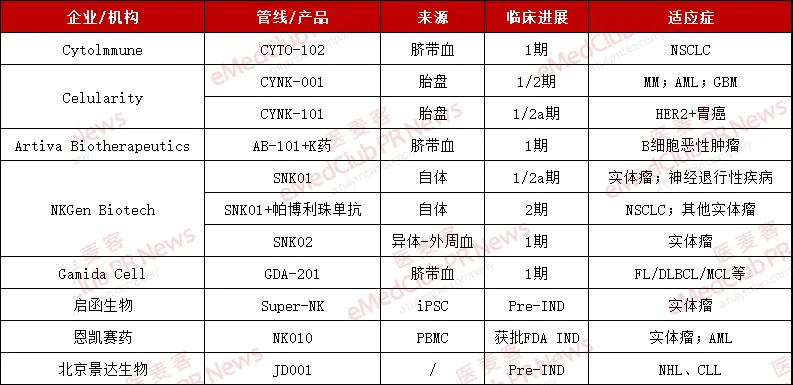
▲國(guó)內(nèi)外部分NK細(xì)胞療法企業(yè)及研發(fā)進(jìn)展(個(gè)人整理,如有疏漏錯(cuò)誤夕春,歡迎補(bǔ)充指正)
Celularity作為NK細(xì)胞療法領(lǐng)域的代表性企業(yè)未荒,專注于開發(fā)胎盤衍生的同種異體細(xì)胞療法,包括未修飾的NK細(xì)胞及志、工程化的NK細(xì)胞片排、間充質(zhì)樣貼壁基質(zhì)細(xì)胞(ASC)和工程化T細(xì)胞,適應(yīng)癥覆蓋癌癥速侈,免疫率寡,傳染病和退行性疾病等多個(gè)領(lǐng)域。
其主導(dǎo)候選藥物CYNK-001為冷凍保存的未經(jīng)基因編輯修飾的同種異體NK細(xì)胞療法倚搬。而另一款NK細(xì)胞療法CYNK-101則是一種實(shí)驗(yàn)性的基因工程化NK細(xì)胞療法冶共,旨在通過新型抗體聯(lián)用增強(qiáng)ADCC效應(yīng)。
工程化NK細(xì)胞療法
盡管非工程化NK細(xì)胞療法取得了一定的進(jìn)展每界,但隨著基因編輯技術(shù)的發(fā)展捅僵,對(duì)NK細(xì)胞進(jìn)行工程化改造已成為增強(qiáng)其靶向殺傷腫瘤活性與持久性的重要途徑。CAR-T細(xì)胞療法的局限性促使人們將目光投向NK細(xì)胞盆犁,兼具良好的安全性和較低的免疫排斥反應(yīng)的CAR-NK細(xì)胞療法應(yīng)運(yùn)而生帅唬。
CAR-NK細(xì)胞療法已經(jīng)在膠質(zhì)母細(xì)胞瘤、乳腺癌蘸腾、卵巢癌噪怜、結(jié)直腸癌、肺癌鸟焊、肝癌等多個(gè)癌癥治療領(lǐng)域取得一定進(jìn)展予售,其研發(fā)思路借鑒CAR-T療法场致,同時(shí)發(fā)揮NK細(xì)胞的獨(dú)特生物學(xué)特性。CAR-NK細(xì)胞療法中NK細(xì)胞的主要源自NK-92細(xì)胞系湿斩。相較而言籍投,CAR-NK細(xì)胞療法在實(shí)體瘤和血液瘤的應(yīng)用中占比相當(dāng)。
同種異體 CAR-NK細(xì)胞的主要優(yōu)勢(shì)在于隨用隨取忧埠,這得益于良好的凍存工藝圣烤,以從特定的細(xì)胞源產(chǎn)生大量的同質(zhì)批次。CAR-T細(xì)胞療法的創(chuàng)始人之一 Carl June 博士也曾公開表示看好CAR-NK 細(xì)胞療法在腫瘤免疫治療中的發(fā)展坤乌。
目前喘建,絕大多數(shù)CAR-NK細(xì)胞療法處于臨床1期,尚無(wú)CAR-NK細(xì)胞療法進(jìn)入臨床3期哼御。全球范圍內(nèi)坯临,Fate Therapeutics、Nkarta等公司是CAR-NK領(lǐng)域最早一批“弄潮兒”恋昼,Artiva Biotherapeutics看靠、Century、Takeda等企業(yè)也緊隨其后液肌。在國(guó)內(nèi)挟炬,英百瑞、國(guó)健呈諾等企業(yè)也已搶先進(jìn)入第一梯隊(duì)嗦哆。
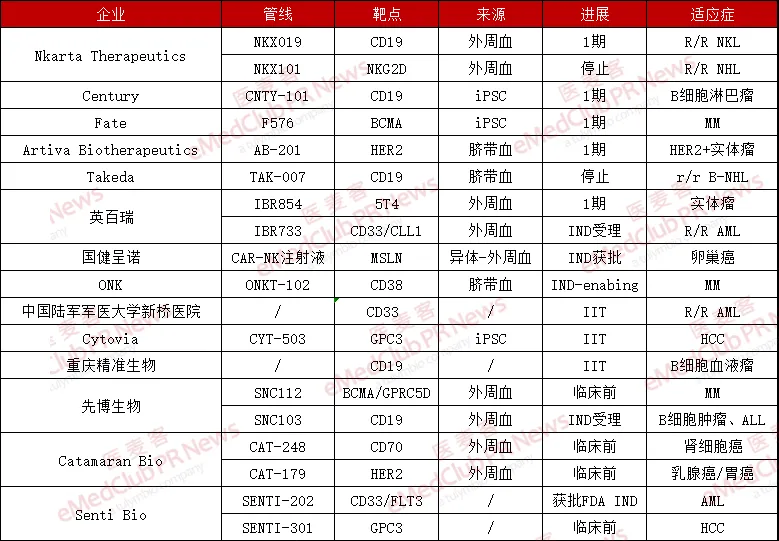
▲國(guó)內(nèi)外部分CAR-NK企業(yè)及研究進(jìn)展(個(gè)人整理辟宗,如有疏漏錯(cuò)誤,歡迎補(bǔ)充指正)
此外吝秕,國(guó)內(nèi)景達(dá)生物、傳奇生物空幻、優(yōu)凱瑞烁峭、科濟(jì)生物、星奕昂秕铛、博生吉醫(yī)藥挤毯、濟(jì)因生物等一些企業(yè)也正在積極布局,但目前還處于早期階段讯完。
從技術(shù)路徑上來看两漫,通過改造NK細(xì)胞表達(dá)細(xì)胞因子如IL-15、IL21以增強(qiáng)其體內(nèi)增殖和持久性成為一類重要途徑于扳,如前文文獻(xiàn)提到的IL12工程化改造后的NK細(xì)胞具有卓越的腫瘤控制能力宅集。另一方面,利用細(xì)胞受體FcγRIII (CD16)與腫瘤抗原特異性抗體Fc段結(jié)合炸穿,介導(dǎo)ADCC作用拔灾,也是提升NK細(xì)胞殺傷力的關(guān)鍵技術(shù)。同時(shí),為增強(qiáng)CAR-NK療法的安全性继锰,多家企業(yè)采用“裝載”安全開關(guān)的方式赠魂,如邏輯回路、TGFβ開關(guān)及窃、EGFR安全開關(guān)等缆刁,以防止脫靶效應(yīng)。
值得一提的是起趾,除了CAR-NK細(xì)胞療法之外诗舰,TCR-NK細(xì)胞療法作為另一類新型同種異體細(xì)胞療法,將NK細(xì)胞固有的泛癌殺傷機(jī)制阳掐、效率與TCR的靶向能力相結(jié)合始衅,展現(xiàn)出治療多種難治性癌癥的潛力。2023年7月缭保,美國(guó)FDA批準(zhǔn)了首款TCR-NK細(xì)胞療法(NY-ESO-1 TCR/IL-15 NK)用于治療復(fù)發(fā)或難治性多發(fā)性骨髓瘤的IND申請(qǐng)汛闸。
NK細(xì)胞聯(lián)合療法——NK細(xì)胞接合器
鑒于NK細(xì)胞數(shù)量稀少、腫瘤浸潤(rùn)有限及免疫抑制微環(huán)境等多挑戰(zhàn)艺骂,NK細(xì)胞接合器的開發(fā)成為提升NK細(xì)胞療法有效性的重要途徑诸老。NK細(xì)胞接合器不僅能通過ADCC直接殺傷腫瘤細(xì)胞,還可以激活NK細(xì)胞釋放多種細(xì)胞因子钳恕,同時(shí)僅在腫瘤部位激活NK細(xì)胞别伏,從而顯著增強(qiáng)其療效。
不少原本持續(xù)在NK細(xì)胞領(lǐng)域布局的公司包括賽諾菲忧额、默沙東等制藥大企業(yè)厘肮,也不再局限于NK細(xì)胞本身,紛紛將NK細(xì)胞接合器納入了未來的發(fā)展之中武帚。目前咆杯,Affimed、GT Biopharma称海、Acepodia终太、Innate Pharma、Dragonfly 脓甘、23 and Me辰丛、Cytovia等公司在此領(lǐng)域進(jìn)展較快,而國(guó)內(nèi)目前入局企業(yè)還相對(duì)較少茅祠,仍有巨大的發(fā)展空間向酝。
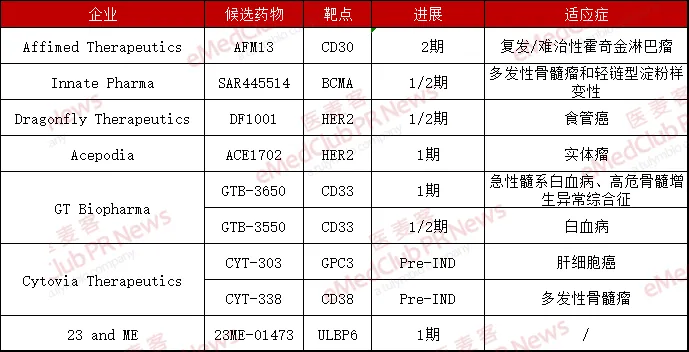
▲NK細(xì)胞接合器領(lǐng)先企業(yè)(個(gè)人整理,如有疏漏錯(cuò)誤踊嘲,歡迎補(bǔ)充指正)
NK細(xì)胞接合器可以同時(shí)靶向腫瘤細(xì)胞抗原以及NK細(xì)胞活化受體村肯,將NK細(xì)胞與腫瘤細(xì)胞拉在一起來實(shí)現(xiàn)對(duì)腫瘤細(xì)胞的殺傷睡清,因而具備獨(dú)特的優(yōu)勢(shì)。該賽道的企業(yè)雖然相對(duì)較少喊解,但隨著未來技術(shù)更迭和臨床推進(jìn)刨仑,相信這一賽道將是一個(gè)頗具潛力的賽道。
總結(jié)
總的來說夹姥,NK免疫細(xì)胞療法杉武、CAR-NK及NK細(xì)胞接合器等創(chuàng)新NK療法的問世,突破了NK細(xì)胞傳統(tǒng)上局限于固有免疫的范疇辙售,也更加驗(yàn)證了其在癌癥治療領(lǐng)域的巨大潛力的廣闊應(yīng)用前景轻抱。然而,目前的NK細(xì)胞相關(guān)療法仍處于發(fā)展的初期階段旦部,各方面仍然面臨諸多挑戰(zhàn)和難題祈搜,要想實(shí)現(xiàn)NK細(xì)胞治療的愿景,還需要持續(xù)進(jìn)行深入探索與研究士八。
參考資料:
1.https://www.cell.com/cancer-cell/fulltext/S1535-6108(24)00272-1?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS1535610824002721%3Fshowall%3Dtrue
2.https://mp.weixin.qq.com/s/w3rTm2J9bmrCO_rGh6Oj3w
3.https://mp.weixin.qq.com/s/HXiSQG-h4wShexnY9HHdOw
4.https://mp.weixin.qq.com/s/Gwj_DoNZHdvwWNVZ8z5YqA
5.https://mp.weixin.qq.com/s/VyBSVOXnpOE_zoRmzZjMtQ
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥魔方Invest
醫(yī)藥魔方Invest  2024-11-26
2024-11-26
 20
20

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥魔方
醫(yī)藥魔方  2024-11-26
2024-11-26
 20
20

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-11-26
2024-11-26
 20
20
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽