
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 研發(fā)客
研發(fā)客  2024-09-10
2024-09-10
 171
171
勃林格殷格翰讼牢、宜聯(lián)生物及和黃醫(yī)藥等生物技術(shù)和制藥公司的臨床戰(zhàn)略和運(yùn)營負(fù)責(zé)人伐藕,通過各自案例蛹疯,探討如何在早期試驗(yàn)階段滿足中美醫(yī)療實(shí)踐需求杀终,從而快速推進(jìn)試驗(yàn)啟動并高效執(zhí)行腌紧。
為落實(shí)與配合國務(wù)院審議通過的《全鏈條支持創(chuàng)新藥發(fā)展實(shí)施方案》,國家藥監(jiān)局近期發(fā)布的《優(yōu)化創(chuàng)新藥臨床試驗(yàn)審評審批試點(diǎn)工作方案》具篇,提出要在試點(diǎn)區(qū)域?qū)崿F(xiàn)10個品種在30個工作日內(nèi)完成創(chuàng)新藥臨床試驗(yàn)申請審評審批淌实,縮短藥物臨床試驗(yàn)啟動用時(shí)。同時(shí)越败,上海和北京等地也出臺了支持生物醫(yī)藥產(chǎn)業(yè)創(chuàng)新發(fā)展的政策触幼。
在研發(fā)客和太美醫(yī)療科技共同舉辦的“出海提效、臨床運(yùn)營新方向”卓越臨床戰(zhàn)略和運(yùn)營高峰論壇上究飞,與會嘉賓探討了在這個充滿變革的時(shí)代置谦、尤其在出海大背景下,如何提升臨床運(yùn)營效率亿傅。
“面對今天的行業(yè)挑戰(zhàn)媒峡,關(guān)鍵在于提升自身的臨床開發(fā)能力,優(yōu)化運(yùn)營效率和質(zhì)量葵擎×掳ⅲ”太美醫(yī)療科技董事長兼CEO趙璐在發(fā)言里表示∧城“太美醫(yī)療科技與中國創(chuàng)新藥產(chǎn)業(yè)一起成長碴秽,目前已經(jīng)能夠提供臨床研究、獨(dú)立療效評估诸跳、藥物警戒铅阎、SMO、CRO和營銷等40余種數(shù)字化解決方案及服務(wù)梅柑,服務(wù)的醫(yī)藥企業(yè)及CRO超過1400家歌饺。”趙璐說脯牛。

趙璐
禮來全球高級副總裁愤凭、藥物發(fā)展及醫(yī)學(xué)事務(wù)中心負(fù)責(zé)人王莉博士表示,中國藥政制度改革讓外企、內(nèi)企原俘、CRO划烫、研究機(jī)構(gòu)等均享受到政策紅利。如今竿刁,跨國企業(yè)紛紛選擇在中國開展全球同步研發(fā)黄锤,今年已有進(jìn)口藥實(shí)現(xiàn)首批上市,國內(nèi)創(chuàng)新企業(yè)也走出國門服務(wù)全球患者食拜。

王莉博士
不過鸵熟,王莉認(rèn)為,盡管中國藥物研發(fā)取得顯著發(fā)展负甸,但在臨床研究的實(shí)施過程仍需提速流强、增效,使中國臨床試驗(yàn)操作與國際接軌呻待,吸引更多跨國企業(yè)將中國帶入全球同步研發(fā)打月,為全球研發(fā)貢獻(xiàn)政策中國的創(chuàng)新力量。同時(shí)蚕捉,國內(nèi)企業(yè)的臨床研究設(shè)計(jì)也要從全球格局出發(fā)奏篙,力爭有中國研究來帶動全球創(chuàng)新。
不過迫淹,王莉認(rèn)為报破,盡管中國藥物研發(fā)取得顯著發(fā)展,但在臨床研究的實(shí)施過程仍需提速柔睡、增效烘梭,使中國臨床試驗(yàn)操作與國際接軌,吸引更多跨國企業(yè)將中國帶入全球同步研發(fā)棺莱。同時(shí)螺子,國內(nèi)企業(yè)的臨床研究設(shè)計(jì)也要從全球格局出發(fā),力爭有中國研究來帶動全球創(chuàng)新陕券。她還提到偏笋,“數(shù)字化臨床試驗(yàn)和人工智能為臨床研究提供新機(jī)遇,如何利用數(shù)字化手段促進(jìn)患者篩選欧舒、優(yōu)化臨床試驗(yàn)莱艺、實(shí)施患者監(jiān)控將成為今后臨床研究的新考量點(diǎn)〔茫”
在這一充滿變革的時(shí)代榄集,臨床戰(zhàn)略與運(yùn)營效率成為了推動藥物創(chuàng)新成功的關(guān)鍵。來自勃林格殷格翰掺厦、宜聯(lián)生物及和黃醫(yī)藥的臨床戰(zhàn)略和運(yùn)營負(fù)責(zé)人苗率,通過各自案例碉渡,探討了如何在早期試驗(yàn)階段滿足中美醫(yī)療實(shí)踐需求,從而快速推進(jìn)試驗(yàn)啟動并高效執(zhí)行母剥。
勃林格殷格翰:
“研發(fā)之花”戰(zhàn)略以患者為核心
勃林格殷格翰大中華區(qū)研發(fā)和醫(yī)學(xué)部戰(zhàn)略和項(xiàng)目管理總監(jiān)蔡萌博士介紹滞诺,勃林格殷格翰2023年公司研發(fā)投入占銷售收入的比重高達(dá)22.5%,共58億歐元用于新藥研發(fā)环疼。未來12~18個月將有10項(xiàng)新的II和III期項(xiàng)目在中國落地习霹,預(yù)計(jì)到2030年,將有25個潛在新藥和/或新適應(yīng)癥獲批炫隶;未來5年淋叶,勃林格殷格翰計(jì)劃在華人用藥研發(fā)投入超35億人民幣。

蔡萌博士
在過去等限,勃林格殷格翰中國與全球新藥獲批時(shí)間差平均為3~5年,2020年之后平均獲批時(shí)間差就縮小到4~5個月芬膝。今年3月6日望门,國家藥監(jiān)局批準(zhǔn)佩索利單抗皮下注射制劑用于治療泛發(fā)性膿皰型銀屑病,成為跨國藥企中首個用全球多中心同步研發(fā)策略率先在華獲批的全球創(chuàng)新藥锰霜,早于美國筹误、歐盟和日本。
拓展閱讀 佩索利單抗如何做到了中國首批谊某?
這得益于公司兩個重要研發(fā)戰(zhàn)略在中國的實(shí)施:一是自2018年起坷顽,勃林格殷格翰實(shí)施“中國納入”項(xiàng)目,中國默認(rèn)加入全球所有注冊臨床試驗(yàn)订岗,實(shí)現(xiàn)了與歐美同步研發(fā)和遞交新藥及其新適應(yīng)癥申請喇喂;二是2019年10月升級推出“中國關(guān)鍵”項(xiàng)目,成為首家將中國全面納入全球同步早期臨床研發(fā)的跨國藥企囊骆。
目前雪奠,中國已100%加入勃林格殷格翰全球關(guān)鍵性臨床研究和80%的全球早期臨床研究》し耍“中國關(guān)鍵”項(xiàng)目開展后踪启,中國已經(jīng)加入全球22個早期全球研發(fā)項(xiàng)目,中國有8個國際多中心項(xiàng)目為全球首個CTA和/或NDA遞交慢俄。為了確保了早期研究的高質(zhì)量和高效啟動茧天,勃林格殷格翰推出了HOPE項(xiàng)目,目前已與多家中國大陸妄结、中國香港和中國臺灣的醫(yī)院簽署了戰(zhàn)略合作協(xié)議磨夕,全速提升臨床啟動時(shí)間,因此目前中國有多項(xiàng)臨床研究取得了全球首個患者入組蔓姚,中國團(tuán)隊(duì)在臨床研究啟動速度上獲多項(xiàng)全球第一拖叙。
此外氓润,蔡萌介紹了勃林格殷格翰的“研發(fā)之花”戰(zhàn)略。
“我們始終將患者放在我們工作的中心薯鳍,患者是研發(fā)之花的花蕊咖气,即研發(fā)創(chuàng)新的核心。外圍有三個花瓣:持續(xù)耕耘優(yōu)勢領(lǐng)域挖滤、關(guān)注疾病機(jī)制之間的協(xié)同效應(yīng)崩溪、利用新興科學(xué)和技術(shù)。與當(dāng)下高度未滿足的醫(yī)療需求結(jié)合斩松,倡導(dǎo)創(chuàng)新的企業(yè)文化伶唯,注重外部創(chuàng)新合作,實(shí)施人才制勝戰(zhàn)略惧盹,追求可持續(xù)的創(chuàng)新模式和管線乳幸,利用新興數(shù)字技術(shù)等等構(gòu)成了創(chuàng)新之花的外層花瓣【”
值得一提的是粹断,勃林格殷格翰中國團(tuán)隊(duì)深度參與了全球疾病圖譜繪制。公司的Disease mapping戰(zhàn)略旨在明確研發(fā)方向刻吵,每五年進(jìn)行一次恼孩,首要考慮未滿足的臨床需求,其次是創(chuàng)新和競爭環(huán)境苦突,最后是商業(yè)市場吸引力牙硫。勃林格殷格翰從一萬種未滿足需求的疾病中篩選出51種作為戰(zhàn)略關(guān)注的疾病,進(jìn)一步確定13種作為研發(fā)重點(diǎn)街剂,其中6種為首要重點(diǎn)防徊,7種納入戰(zhàn)略儲備,3種是新興領(lǐng)域绎弯。所有疾病選定都基于深入的疾病生物學(xué)和基因?qū)W欠怕,疾病機(jī)制研究和分子靶標(biāo)的選擇。

蔡萌說饰样,勃林格殷格翰非常重視外部合作潘所,管線中50%來源于外部合作,主要聚焦于心腎代謝菲瓶、腫瘤怠褐、呼吸、免疫和中樞神經(jīng)系統(tǒng)疾病等領(lǐng)域您宪。
最后奈懒,她用張維博士常引用的《詩經(jīng)·大雅·蕩》中的成語“靡不有初,鮮克有終”宪巨,來勉勵臨床運(yùn)營的從業(yè)者們一同建立更加開放和高效的創(chuàng)新環(huán)境磷杏,共同推進(jìn)高質(zhì)量溜畅、高水平的國際多中心臨床研究在中國快速落地和執(zhí)行。
宜聯(lián)生物:
高效運(yùn)營需要充分規(guī)劃與準(zhǔn)備
宜聯(lián)生物CMO秦續(xù)科博士介紹了宜聯(lián)生物臨床研究推進(jìn)的現(xiàn)狀极祸。自2020年成立以來慈格,宜聯(lián)迅速推進(jìn)技術(shù)開發(fā)與場地建設(shè),布局前沿靶點(diǎn)管線遥金,并在多個領(lǐng)域擁有自主知識產(chǎn)權(quán)浴捆,其ADC平臺國際領(lǐng)先,臨床前及臨床數(shù)據(jù)表現(xiàn)優(yōu)異稿械。近年來选泻,宜聯(lián)完成臨床獲批并實(shí)現(xiàn)中美雙報(bào),成功籌集A輪和B輪融資寿宅。

秦續(xù)科博士
創(chuàng)立4年內(nèi)洒唇,宜聯(lián)將十個藥物研發(fā)管線推進(jìn)至試驗(yàn)階段,因效率高卫糙、數(shù)據(jù)產(chǎn)出快卸腐,獲得與羅氏、BioNTech慢荧、復(fù)宏漢霖杯岩、再鼎等公司的合作朽慕,其中4個產(chǎn)品由宜聯(lián)生物自主開展臨床松奖,6個由合作方帶到臨床研究中。
關(guān)于宜聯(lián)的臨床試驗(yàn)規(guī)劃盹挑,秦續(xù)科提到:第一階段包括全球和中國的單藥治療研究赃慰,以及全球和中國的組合治療研究;第二階段將深入全球及中國的單藥與組合治療研究假刘,擴(kuò)大樣本量纪尊,評估藥物的長期安全性和有效性;第三階段包括全球及中國大規(guī)模對照研究判哥,驗(yàn)證藥物在廣泛患者群體中的療效献雅,并科學(xué)評估其相對于現(xiàn)有療法的優(yōu)勢。
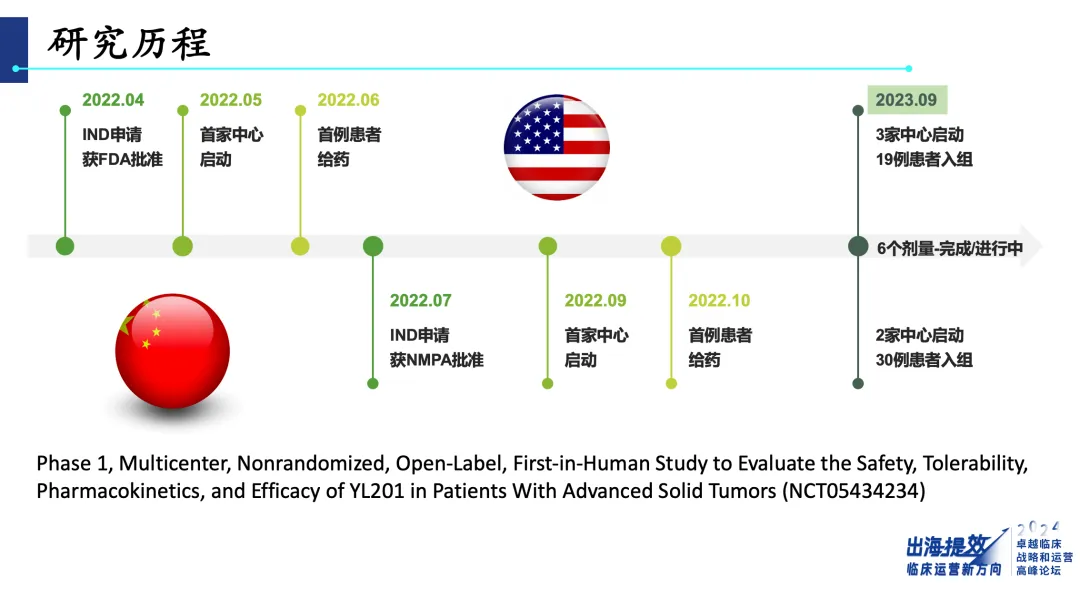
宜聯(lián)生物首個臨床試驗(yàn)從2022年4月開始塌计,首例病人從2022年6月入組挺身,不到1年6個月就完成了1期試驗(yàn)⌒拷觯“所有這些快的背后章钾,都是充分準(zhǔn)備,包括分子設(shè)計(jì)热芹、試驗(yàn)設(shè)計(jì)贱傀、跟研究者的溝通惨撇,都做了充分的準(zhǔn)備「”秦續(xù)科說魁衙。目前,宜聯(lián)生物的全球多中心試驗(yàn)已不只是中美兩地椰棘,還有歐洲纺棺、加拿大、澳洲丰倾。在他看來助苫,臨床運(yùn)營的執(zhí)行前提是確保戰(zhàn)略和設(shè)計(jì)的完善,一旦戰(zhàn)略和設(shè)計(jì)確定無誤齿雕,執(zhí)行階段就應(yīng)堅(jiān)定不移地推進(jìn)条馍,不需要猶豫不決。
展望未來競爭格局赂相,秦續(xù)科指出寓鳄,當(dāng)前國內(nèi)ADC的競爭激烈,因此他建議晋挑,企業(yè)應(yīng)專注于自身擅長的領(lǐng)域跛孕,避免在不具優(yōu)勢的領(lǐng)域與他人競爭。
和黃醫(yī)藥:
全球化臨床運(yùn)營人才亟待培養(yǎng)
和黃醫(yī)藥臨床運(yùn)營部負(fù)責(zé)人肄寻、臨床運(yùn)營副總裁楊彬博士在加入和黃醫(yī)藥之前舟鲁,擁有豐富的跨國公司工作經(jīng)驗(yàn)。她詳細(xì)分享了自己對全球化背景下臨床運(yùn)營的挑戰(zhàn)及有效策略串锁、數(shù)字化在臨床運(yùn)營中應(yīng)用的思考和建議坡沿。

楊彬博士
2004年至2023年間,全球腫瘤新型抗癌藥物(NAS)上市數(shù)量顯著增長钾埂,總數(shù)達(dá)259種河闰,其中美國領(lǐng)先,中國緊隨其后褥紫,展現(xiàn)出明顯的地域差異姜性。近十年來,中國在化合物新分子的開發(fā)上與全球保持同步髓考。楊彬說部念,現(xiàn)在中國早期研發(fā)速度與世界接軌,尤其在ADC绳军、抗體領(lǐng)域交易活躍印机,但中國企業(yè)仍面臨全球臨床開發(fā)資金難題及能力提升的挑戰(zhàn)∶偶荩《自然》雜志文章指出射赛,2007年1月至2023年12月間多柑,中國177家生物制藥企業(yè)的350個化合物從1期到3期再到NDA階段的成功率僅1.7%。
在國際化的進(jìn)程中楣责,企業(yè)將面臨人才平俘、政策以及新藥研發(fā)環(huán)境、流程和時(shí)間表等多方面的挑戰(zhàn)玻温,這些方面相較于過去都發(fā)生了較大的變化猴豁。盡管本土藥企在人才培養(yǎng)和引進(jìn)上取得顯著成果,涌現(xiàn)出一批具備深厚研發(fā)技術(shù)和臨床經(jīng)驗(yàn)级闭、展現(xiàn)跨國協(xié)作能力的創(chuàng)新型人才悲碰,但楊彬認(rèn)為,大多數(shù)中國公司選擇早期將項(xiàng)目轉(zhuǎn)讓給跨國公司本洁,以利用其全球臨床團(tuán)隊(duì)和網(wǎng)絡(luò)泻磅,這反映出中國公司在臨床試驗(yàn)設(shè)計(jì)和運(yùn)營方面、尤其是早期設(shè)計(jì)人才上的不足搔片。
她回顧了在昆泰的工作經(jīng)歷煞松,提到每年有150個進(jìn)行中的項(xiàng)目,其中約60個來自中國生物技術(shù)公司脸缆。但她發(fā)現(xiàn)芳争,許多中國公司在試驗(yàn)設(shè)計(jì)時(shí)傾向于直接將中國經(jīng)驗(yàn)應(yīng)用于全球市場,這蘊(yùn)含較大失敗風(fēng)險(xiǎn)别粮。同時(shí)懈词,歐美與中國在執(zhí)行力和工作方式上存在差異,需要中國研究人員做出調(diào)整和適應(yīng)计贰。盡管一些國內(nèi)公司擁有資深人才钦睡,但在全球臨床試驗(yàn)中蒂窒,具有全球項(xiàng)目管理經(jīng)驗(yàn)的人才相對較少躁倒。
楊彬曾參與阿斯利康一項(xiàng)目,在美國66家醫(yī)院迅速啟動中心倫理審查洒琢,6個月內(nèi)完成所有病人招募秧秉。她建議,應(yīng)充分利用美國醫(yī)療政策衰抑,積極與FDA溝通象迎,在樣本量、人種選擇等關(guān)鍵方面獲取充分建議和指導(dǎo)呛踊。
除研發(fā)團(tuán)隊(duì)外砾淌,注冊、醫(yī)學(xué)等部門也應(yīng)緊密合作谭网,關(guān)注各國藥研法規(guī)變動及監(jiān)管趨勢汪厨,確保項(xiàng)目實(shí)施合規(guī)且具有前瞻性例是。需要全面考量國內(nèi)外審批差異,特別是海外市場對技術(shù)和方法的嚴(yán)苛要求蛙檐。應(yīng)與歐盟或美國藥監(jiān)部門建立溝通渠道狐怯,確保深入理解并及時(shí)響應(yīng)FDA反饋。同時(shí)贪犁,必須充分準(zhǔn)備FDA認(rèn)為上市所必需的臨床數(shù)據(jù)與CMC數(shù)據(jù)颜肥,保證數(shù)據(jù)的完整有效√词希可以充分利用美國加速審批渠道退厕,結(jié)合當(dāng)?shù)蒯t(yī)療實(shí)踐。
她認(rèn)為纳帽,制定臨床開發(fā)計(jì)劃及全球注冊策略非常關(guān)鍵个荔。國際多中心試驗(yàn)?zāi)茱@著提升效率,避免資源冗余返工,優(yōu)于傳統(tǒng)模式易贿。面對全球市場挑戰(zhàn),僅依賴中國數(shù)據(jù)支持美國NDA或BLA成功率低嫡纠,需考慮疾病分布烦租、患者流行病學(xué)差異及競爭格局。精心設(shè)計(jì)的全球多中心臨床試驗(yàn)可確保產(chǎn)品順利過渡并滿足各國要求除盏。
在全球競爭中叉橱,“速度”是關(guān)鍵,首個上市藥物往往能占據(jù)高達(dá)64%市場份額者蠕。因此窃祝,加大全球研發(fā)投入是藥物研發(fā)成功和市場先機(jī)的保障。選擇全球化國家需謹(jǐn)慎踱侣,評估人力粪小、資源和核心能力。全球化臨床運(yùn)營復(fù)雜抡句,需借助數(shù)字化手段探膊。中國企業(yè)需從依賴直覺和不完整信息的決策,轉(zhuǎn)變?yōu)橐詳?shù)據(jù)和事實(shí)為依據(jù)的決策方式待榔,這是其發(fā)展和國際化中的重要一課逞壁。
數(shù)字化臨床運(yùn)營已廣泛應(yīng)用于臨床試驗(yàn),能提高效率锐锣,但楊彬認(rèn)為需權(quán)衡利弊债轰,充分了解和評估,尤其是前期設(shè)計(jì)至關(guān)重要,以避免返工浪費(fèi)時(shí)間丐闲。據(jù)統(tǒng)計(jì)参匀,中國試驗(yàn)方案平均需要20多次修訂,成本巨大市协。
太美醫(yī)療科技:
數(shù)智技術(shù)助力臨床運(yùn)營全球化
太美醫(yī)療科技高級副總裁馬東介紹說昭仓,近3年來,正值中國創(chuàng)新藥研發(fā)蓬勃興起瞬芒、出海交易頻繁的高峰期凯辆。2023年,中國創(chuàng)新藥License-out(對外授權(quán))已披露金額達(dá)350億美元接吠,且新藥研發(fā)管線數(shù)量已占全球26.7%宜裂,國際化進(jìn)程進(jìn)一步加速。

馬東
而在創(chuàng)新藥出海的同時(shí)缕圣,越來越多創(chuàng)新藥企業(yè)開始面臨全球化臨床研究運(yùn)營體系的構(gòu)建難題掀哎,全球運(yùn)營體系割裂、跨區(qū)域團(tuán)隊(duì)缺乏合作旺坠、運(yùn)營效率低下等問題日益突出乔遮,亟需破局。
馬東以一家與太美醫(yī)療科技合作超過5年的客戶為例取刃,該客戶近年來發(fā)展迅猛蹋肮,每年新增30+個項(xiàng)目,曾自建全球臨床運(yùn)營體系但遭遇了難題:運(yùn)營模式不滿足戰(zhàn)略需求璧疗,海外團(tuán)隊(duì)缺乏與監(jiān)管機(jī)構(gòu)溝通經(jīng)驗(yàn)坯辩,人員成本攀升且團(tuán)隊(duì)間缺乏協(xié)作。太美醫(yī)療科技數(shù)字化運(yùn)營團(tuán)隊(duì)與客戶方接觸后崩侠,開展深入調(diào)研漆魔,與客戶共同制定了全球化數(shù)字轉(zhuǎn)型的“三步走“策略:
第一階段,太美醫(yī)療科技與客戶一起梳理流程和體系却音,建立了全球化的運(yùn)營管理流程改抡,為提升管理效率和數(shù)字化轉(zhuǎn)型建立基礎(chǔ)。
第二階段僧家,提供全球化數(shù)字轉(zhuǎn)型解決方案雀摘,助力海內(nèi)外團(tuán)隊(duì)高效運(yùn)營宜柱,并持續(xù)改進(jìn)建立運(yùn)營指標(biāo)侦演。以eTMF為例,其人均月使用時(shí)長超過300小時(shí)拣薄,年文件存儲量超過15萬份左撤,文件質(zhì)量、及時(shí)性、完整性等均顯著提升三二;如電子簽名解決方案号找,該方案實(shí)施一年內(nèi),完成約2.5萬份電子簽名会刀,收集周期縮短30天以上泥碳,文件完整度提升25%,覆蓋2500名人員掏绍,幾乎所有研究者參與泰牵。
第三階段,以數(shù)據(jù)輔助決策優(yōu)化译命,設(shè)立運(yùn)營指標(biāo)體系芥吟,確定關(guān)鍵業(yè)務(wù)指標(biāo)并持續(xù)改善,推動戰(zhàn)略目標(biāo)落地专甩。2023年钟鸵,該公司歷經(jīng)12次FDA、EMA和CDE審查涤躲,均順利通過棺耍,驗(yàn)證了數(shù)字化轉(zhuǎn)型的有效性和可靠性。
馬東總結(jié)說种樱,面對全球數(shù)字化轉(zhuǎn)型浪潮烈掠,中國醫(yī)藥企業(yè)正積極轉(zhuǎn)型,但也會面臨多重挑戰(zhàn)缸托。首先需要制定并有效執(zhí)行長期戰(zhàn)略左敌,細(xì)致規(guī)劃階段性目標(biāo),確保穩(wěn)健前行俐镐。其次矫限,認(rèn)識到長期數(shù)字化投入是轉(zhuǎn)型基石,需持續(xù)投入資源支撐技術(shù)革新與流程優(yōu)化佩抹。最后叼风,選擇合適的數(shù)字化合作伙伴至關(guān)重要,關(guān)乎成本效益飒晴、可持續(xù)投入威众、快速響應(yīng)、落地執(zhí)行及研發(fā)實(shí)力拙位。通過精心布局哼股,中國醫(yī)藥企業(yè)正穩(wěn)步邁向數(shù)字化轉(zhuǎn)型新階段。
圓桌論壇:臨床開發(fā)如何協(xié)同加速

圓桌討論嘉賓:
主持人:研發(fā)客主編 毛冬蕾
黃燕俠:默沙東 臨床研究運(yùn)營部負(fù)責(zé)人属胖,副總裁
于 球:信達(dá)生物 臨床運(yùn)營執(zhí)行總監(jiān)
孫 宇:拜耳 臨床供應(yīng)商管理總監(jiān)
孔 亮:禮新醫(yī)藥 臨床運(yùn)營高級副總裁
周曉琳:圣方醫(yī)藥 研發(fā)臨床運(yùn)營副總裁
研發(fā)客:臨床試驗(yàn)涉及眾多環(huán)節(jié)荧肴,尤其在北京杆赃、上海等試點(diǎn)的研究中心將IND從60天縮短至30天之后,面臨的挑戰(zhàn)更巨大恃定。這一過程類似奧運(yùn)接力賽宣忧,從明確臨床開發(fā)策略到與研究中心簽訂合同、召開研究者會議寞殿,再到臨床試驗(yàn)正式結(jié)束锤扣,每一環(huán)節(jié)都要緊密銜接。在啟動環(huán)節(jié)中骡尽,可能延誤的環(huán)節(jié)有哪些忿檩?應(yīng)該如何解決?

黃燕俠:
30個工作日完成IND爆阶,對臨床運(yùn)營的加速提出了新的要求燥透,但同時(shí)也給臨床運(yùn)營的同仁們帶來了更多不斷自我挑戰(zhàn)、從做好到追求運(yùn)營卓越的機(jī)會辨图。我們需要不斷思考如何在保證質(zhì)量與合規(guī)的同時(shí)班套,探索臨床途徑提速。加速臨床研究中心的立項(xiàng)啟動故河,早日實(shí)現(xiàn)中國第一例病人入組吱韭,是藥監(jiān)部門、臨床研究機(jī)構(gòu)和研究團(tuán)隊(duì)及申辦者大家共同關(guān)注并努力推動的關(guān)鍵點(diǎn)鱼的。
在我看來理盆,臨床試驗(yàn)啟動的序貫審批、合同簽署都屬于比較容易產(chǎn)生延誤的環(huán)節(jié)凑阶。
許多臨床研究機(jī)構(gòu)都需要收到受理通知單(CIC)才能正式啟動立項(xiàng)猿规。新政策不僅支持IND的加速批準(zhǔn),還通過有效協(xié)調(diào)臨床研究的相關(guān)部門特別是研究機(jī)構(gòu)宙橱,推動機(jī)構(gòu)臨床試驗(yàn)從序貫審批轉(zhuǎn)變?yōu)椴⑿袑徟唇桑瑥募韧牧㈨?xiàng)-倫理委員會審批-研究協(xié)議的簽字蓋章串聯(lián)流程,提升到同步并聯(lián)的流程版掘。這種變化犁式,可以極大程度地加速研究機(jī)構(gòu)和研究中心的啟動速度。
還有昔疆,合同簽署是試驗(yàn)機(jī)構(gòu)運(yùn)營耗時(shí)最長的環(huán)節(jié)蚌汁。為了加速這一流程,我們努力推動master agreement的協(xié)議模版谤郑,通過對于標(biāo)本模版的審批鲸嫁,對于研究協(xié)議條款在大的框架上達(dá)成共識,后續(xù)根據(jù)每個適用具體的情況拯耿,輔以相應(yīng)的調(diào)整贪类,這種做法極大程度地加速了研究協(xié)議的審批流程胃愉。我們建議與多家中心合作時(shí)射粹,為了確保合同快速簽署暑尝,需要加強(qiáng)與機(jī)構(gòu)老師溝通,實(shí)現(xiàn)合同流程標(biāo)準(zhǔn)化雅镊,不斷為提速助力襟雷,這樣也可以將機(jī)構(gòu)審閱合同的老師的資源解放出來,使大家把精力投入到其他臨床試驗(yàn)的工作中去仁烹。
默沙東目前與200多家醫(yī)院合作耸弄,合作的研究中心有2000家左右,合作最多的醫(yī)院同時(shí)有50~60家項(xiàng)目在運(yùn)行卓缰。為了更好计呈、更高效地根據(jù)臨床試驗(yàn)機(jī)構(gòu)的要求進(jìn)行臨床試驗(yàn)運(yùn)營管理,對于經(jīng)常合作的醫(yī)院征唬,我們會建立并維護(hù)相應(yīng)的機(jī)構(gòu)數(shù)據(jù)庫捌显。這個數(shù)據(jù)庫包含了所有醫(yī)院對于臨床試驗(yàn)執(zhí)行要求的各種信息,在醫(yī)院啟動新項(xiàng)目時(shí)总寒,都可以從數(shù)據(jù)庫中查到機(jī)構(gòu)的要求扶歪,無需再與醫(yī)院反復(fù)溝通,大大提升了遞送研究審批文件的質(zhì)量摄闸,從而加速了中心啟動的速度善镰。
我們美國入組速度、中國首例患者入組速度依然有提高空間蟹故,其余病人入組加快也非常重要措瑞。同時(shí),我們還在不斷探索其他可能的限速環(huán)節(jié)逾丑。隨著中國在MRCT中的參與度不斷提升史代,加入國際全球同步研發(fā)項(xiàng)目同時(shí)支持中國產(chǎn)品注冊申報(bào)和全球產(chǎn)品上市申報(bào)成為大多數(shù)跨國公司的研發(fā)策略。為了確保試驗(yàn)數(shù)據(jù)的一致性和高質(zhì)量姥仍,同時(shí)滿足中國市場的特定需求及監(jiān)管要求乐玛,需在中國設(shè)立中心實(shí)驗(yàn)室。
然而傻牙,一些新的生物標(biāo)志物檢測需要先探索全球統(tǒng)一的有效檢測方法纪立,然后才能把相應(yīng)方法轉(zhuǎn)移到中國的中心實(shí)驗(yàn)室,這種操作會導(dǎo)致中心實(shí)驗(yàn)室方法學(xué)建立耗時(shí)較長阐泻,進(jìn)而影響了整體臨床試驗(yàn)的速度胰肆。針對此,可否探討針對某些特定的臨床研究項(xiàng)目担急,批準(zhǔn)樣本出口檢測及海關(guān)流程簡化的可能桦闪,這樣對于中國在全球同步研發(fā)的地位提升有至關(guān)重要的作用侠坎。
同時(shí),隨著臨床試驗(yàn)的方案復(fù)雜性不斷提升裙盾,藥物采購選擇也是可以與藥監(jiān)局商討的重要議題实胸。尤其在腫瘤領(lǐng)域的藥物臨床試驗(yàn)中,采購環(huán)節(jié)尤為復(fù)雜番官,涉及多種臨床用藥庐完,可能用于聯(lián)合用藥或?qū)φ者x擇。采購時(shí)需在全球范圍內(nèi)尋找滿足FDA徘熔、EMA及NMPA要求的藥物门躯,挑戰(zhàn)較大。選擇創(chuàng)新藥或仿制藥時(shí)酷师,若藥物未在中國上市讶凉,則需更多時(shí)間和精力篩選以能采購到符合各國法規(guī)要求及方案要求的藥物,這部分挑戰(zhàn)也會影響到臨床試驗(yàn)的啟動山孔。
即便有很多可以繼續(xù)努力的方面懂讯,我們相信在積極的大環(huán)境下,所有臨床試驗(yàn)參與人員饱须,大家通力合作域醇,努力推進(jìn)整體研發(fā)效率的提升,不斷加速整體流程的優(yōu)化整合果孝,我們有信心在不久的將來肖升,中國也可以成為全球臨床試驗(yàn)首例受試者入組的常駐國,成為藥物研發(fā)的wave 1 FPE 國家炼缰。
研發(fā)客:在臨床試驗(yàn)的實(shí)施過程中拦袍,為了確保試驗(yàn)的順利進(jìn)行和數(shù)據(jù)的準(zhǔn)確性,需要采取哪些關(guān)鍵措施脸婉?

于球:
我的老板對我說過誓拉,一項(xiàng)研究能否成功,首先基于科學(xué)和好的策略尝赵;其次是臨床運(yùn)營篓羊。對于臨床運(yùn)營部門而言,一旦臨床開發(fā)策略確定弓呵,那就要制定臨床運(yùn)營策略六赢,必須堅(jiān)定且高效地執(zhí)行。臨床策略的制定至關(guān)重要茉漂,臨床運(yùn)營的執(zhí)行同樣重要劳景。
在臨床運(yùn)營的執(zhí)行過程中,面對眾多競爭對手和同質(zhì)化的分子與試驗(yàn)項(xiàng)目碉就,我們需要深入研究自己研發(fā)的新分子機(jī)制和特點(diǎn)盟广,分析競爭對手產(chǎn)品的特點(diǎn)闷串,進(jìn)行SWOT分析,以明確自己分子或研究的優(yōu)勢和劣勢筋量,揚(yáng)長避短烹吵。
在試驗(yàn)后續(xù)過程中,數(shù)據(jù)監(jiān)查同樣重要毛甲,包括監(jiān)查頻次年叮、質(zhì)量管理及風(fēng)險(xiǎn)管控等具被。為此玻募,需要制定詳細(xì)的計(jì)劃表,涵蓋預(yù)算成本一姿、臨床研究人員分配七咧,并特別注意核對重點(diǎn)事項(xiàng)和細(xì)節(jié)。
在研究過程中叮叹,速度顿储、質(zhì)量和合規(guī)性的把控是最具挑戰(zhàn)性的環(huán)節(jié)。首先PM需要發(fā)揮大管家的作用济问,在項(xiàng)目組中發(fā)揮leadership的能力遮店,將跨部門的人員聚攏在一起。就CRA而言吝殖,北京戳酒、上海、廣州的人員配備較多帚颤,這是因?yàn)轫?xiàng)目主要集中在這些地區(qū)伟杂。人員的培訓(xùn)至關(guān)重要,不僅包括臨床試驗(yàn)知識和技能提升饮噪,還涉及軟技能的培養(yǎng)名挪。CRA要與研究者建立好的關(guān)系,保持謙虛謹(jǐn)慎的態(tài)度膏姨,這是臨床試驗(yàn)運(yùn)營事半功倍的關(guān)鍵因素绵笆。
最后,項(xiàng)目經(jīng)理和運(yùn)營總監(jiān)應(yīng)該重視跨部門協(xié)作橙喘,共同推動項(xiàng)目的進(jìn)展时鸵。如果能與醫(yī)院建立緊密的戰(zhàn)略合作關(guān)系,將來可以提升我們研究在醫(yī)院和在科室的優(yōu)先級渴杆,從而攜手提升試驗(yàn)效率寥枝。
研發(fā)客:您在供應(yīng)商選擇和管理方面有多年經(jīng)驗(yàn),有哪些具體建議跟大家分享磁奖?

孫宇:
在過去3年里囊拜,我見證了拜耳在全球化與本土化策略上的深度融合與切實(shí)執(zhí)行某筐。以往,拜耳的供應(yīng)商管理團(tuán)隊(duì)主要駐扎在美國與德國冠跷,我作為公司在中國的代表南誊,有幸目睹了中國生物醫(yī)藥創(chuàng)新力量的蓬勃興起。正是基于這一重要原因蜜托,拜耳決定將供應(yīng)商管理團(tuán)隊(duì)落地中國抄囚,以更緊密地連接和響應(yīng)這一充滿活力的市場。
身為中國人橄务,我深諳中國市場幔托。我給自己設(shè)定一個使命,那就是與合作供應(yīng)商攜手王庐,將中國優(yōu)質(zhì)產(chǎn)品推向全球细周。讓全世界看到中國產(chǎn)業(yè)鏈的強(qiáng)大實(shí)力。當(dāng)我離開運(yùn)營部門后毫例,才意識到前面有許多準(zhǔn)備工作需要完成谒酌,這不僅是一紙批文那么簡單。做好供應(yīng)鏈各個環(huán)節(jié)的鋪墊惹捡,需要有效溝通遮结。
目前,在全球臨床研究開展過程中男赴,一個重要的理念是“patient insight”曾负,即以患者為中心。這一理念還涵蓋了patient engagement(患者參與)和patient mind(患者心聲)渊喘。在啟動入組前诊捆,需要確保已充分考慮了以患者為中心的試驗(yàn)運(yùn)營方案。
在開展DCT時(shí)拨才,部分試驗(yàn)人群可能來自偏遠(yuǎn)地區(qū)的少數(shù)民族纸措。試驗(yàn)啟動時(shí),患者無需長途跋涉至北京官脓、上海等大城市协怒,可以通過全球產(chǎn)業(yè)鏈和物流鏈來滿足患者的入組需求。這其中涉及更多的細(xì)節(jié)和溝通技巧卑笨。
研發(fā)客:在臨床試驗(yàn)的后期結(jié)束階段孕暇,哪些環(huán)節(jié)最容易出現(xiàn)延誤?為了提速這一階段的工作赤兴,可以采取哪些具體措施妖滔?

孔亮:
我很贊同黃老師的觀點(diǎn)。目前,研究中心面臨的主要問題集中在合同簽署座舍,各家公司都在積極尋求解決方案以推動此事沮翔,但遇到的阻力很大,占據(jù)了大多數(shù)機(jī)構(gòu)大量時(shí)間和精力曲秉。不過采蚀,也有個別中心愿意采用統(tǒng)一的合同模板來開展臨床研究。國外也有我們值得學(xué)習(xí)的案例承二,以澳大利亞為例榆鼠,其合同標(biāo)準(zhǔn)由第三方民間機(jī)構(gòu)設(shè)定,提供一個包含所有已談妥條款的標(biāo)準(zhǔn)模板漠盔,企業(yè)只需就預(yù)算談判规倚。未來,為了加速國內(nèi)的研究流程促驶,需要從引入第三方推進(jìn)的角度出發(fā)肢有,借鑒并優(yōu)化合同簽署流程单步。
確實(shí)物遗,選擇有合作基礎(chǔ)并建立信任的研究中心很重要,但我們也應(yīng)打破固定思維且奔,嘗試納入新的研究中心插撩。只要他們熱情、有責(zé)任心此腊,給予培訓(xùn)和機(jī)會摹院,就能不斷成長并做出貢獻(xiàn)。申辦方不必局限于知名醫(yī)院和PI羊捧,要有錯位發(fā)展的意識众巷。
關(guān)于方案修訂,我特別贊同和黃醫(yī)藥楊彬老師的觀點(diǎn)炊豪。有些團(tuán)隊(duì)在試驗(yàn)方案上平均要修改20多次凌箕,這一成本是巨大的。如果能在方案制定之初就將更多良好的設(shè)計(jì)考慮進(jìn)去词渤,盡量減少試驗(yàn)方案更新的次數(shù)牵舱,那就取得了很大的成功。良好的設(shè)計(jì)是成功的一半缺虐,對于國內(nèi)的企業(yè)來說芜壁,制定創(chuàng)新藥早期臨床試驗(yàn)方案還面臨很多未知因素。但是高氮,應(yīng)該盡量在關(guān)鍵流程中將給藥方法慧妄、給藥劑量及聯(lián)合用藥的可能性詳細(xì)寫入方案中,這樣將來需要修改的次數(shù)就能減少剪芍,從而降低時(shí)間成本和相關(guān)費(fèi)用塞淹。
要明確區(qū)分項(xiàng)目主次韧掩,爭取能夠開展的項(xiàng)目都變成公司重要的項(xiàng)目,公司要及時(shí)對項(xiàng)目開展評估窖铡,及時(shí)終止前景不佳或進(jìn)展不順的項(xiàng)目柒汉,避免資源浪費(fèi)。若項(xiàng)目展現(xiàn)良好前景和市場潛力萨宙,則應(yīng)果斷分配更多資源监昏,確保其發(fā)展并最大化讓病人早日受益。如果前期工作能夠扎實(shí)做好惦知,收尾工作自然也能水到渠成承副。除了追求速度,對于運(yùn)營團(tuán)隊(duì)的同事們來說爪辟,質(zhì)量意識必須時(shí)刻銘記于心冻菌。如果平時(shí)不注重質(zhì)量,只想著在最后一步既权,比如明天臨床研究數(shù)據(jù)庫就要鎖庫了荚砍,或馬上就要迎接國家藥監(jiān)局的稽查核查時(shí),才匆忙去做準(zhǔn)備工作酌沥,那為時(shí)已晚四洗。
因此,內(nèi)部質(zhì)量控制一定要在平時(shí)做到位呵扛。如果平時(shí)不抓質(zhì)量每庆,到最后即使神仙也救不了你,這樣的例子實(shí)在太多了今穿。說到鎖庫缤灵,前幾年項(xiàng)目緊張的時(shí)候,個別中心排隊(duì)等待質(zhì)量控制(QC)需要很長時(shí)間蓝晒。很多研究中心都有QC和QA的要求腮出,很多已開始了AI QC的實(shí)踐,這極大地提高了效率拔创。在公司內(nèi)部利诺,醫(yī)學(xué)和數(shù)據(jù)團(tuán)隊(duì)采用滾動和平行運(yùn)行的工作方式,這大大縮短了鎖庫所需的時(shí)間剩燥。最后慢逾,要提升效率和保證質(zhì)量,關(guān)鍵在于平日的積累和努力灭红。
研發(fā)客:前面幾位老師分享了各自的觀點(diǎn)侣滩,相信您也感同身受,可否請您詳細(xì)談?wù)劊?/strong>

周曉琳:
黃燕俠老師的發(fā)言始于合同終于合同,強(qiáng)調(diào)了合同審閱簽署是制約臨床試驗(yàn)開展最重要的因素之一相询。除此之外逐嗅,在臨床試驗(yàn)的啟動過程中,涉及多個利益方褒谒,包括監(jiān)管部門菊车、申辦方、研究機(jī)構(gòu)奕喻、供應(yīng)商等您奶,每一個環(huán)節(jié)都需要與這些利益相關(guān)方緊密合作。除了合同簽署的問題摧篱,目前中國的倫理審查體系還未形成中心倫理或區(qū)域倫理晋鼓,這導(dǎo)致倫理審查進(jìn)程非常滯后。因此松苹,需要大力推行中心倫理的做法摘链,以改進(jìn)這一現(xiàn)狀。除了中心倫理的推行丘多,很多國家岗努,如新加坡、馬來西亞姻僧、澳大利亞等规丽,在全國一體化進(jìn)程上的進(jìn)展也遠(yuǎn)超中國,對此撇贺,我們可謂是任重而道遠(yuǎn)。
于球老師是項(xiàng)目管理領(lǐng)域的專家冰抢,我本人也是長期在項(xiàng)目一線深耕的資深項(xiàng)目經(jīng)理松嘶,因此都有深刻的共鳴:那就是強(qiáng)化內(nèi)部協(xié)同、提升PM領(lǐng)導(dǎo)力和統(tǒng)籌能力挎扰;并在中心層面著力加強(qiáng)區(qū)域運(yùn)營能力和部署戰(zhàn)略合作中心翠订,從而在項(xiàng)目管理和中心管理兩個維度雙管齊下。在這方面遵倦,我們與信達(dá)可謂是一脈相承尽超。
孫老師所強(qiáng)調(diào)“Patient insights”(患者洞察)可以與圣方醫(yī)藥的實(shí)踐案例相結(jié)合。很多公司在受試者招募時(shí)梧躺,主要依賴與研究者溝通似谁,由研究者推薦病人參與臨床試驗(yàn)。但圣方醫(yī)藥則直接面向患者遣惊,通過AI初步篩選和核對钓赛,再輔以人工合作,這是一種創(chuàng)新性的嘗試,極大提升了招募效率和透明度勃说。
孔總強(qiáng)調(diào)項(xiàng)目最終的成功與否狞饮,取決于前面每一步的執(zhí)行,是否既快速又高質(zhì)量地完成痒塞。在關(guān)閉項(xiàng)目中心時(shí)佣各,他強(qiáng)調(diào)了跨部門合作的重要性,用“千里之行始于足下”來形容洪磕,要想臨床試驗(yàn)做得好朦阶,從第一步就開始嚴(yán)格把控,以終為始瘪吭,確保每個環(huán)節(jié)的完美執(zhí)行杰翰。
研發(fā)客:中國每年大約2500項(xiàng)藥物臨床試驗(yàn)的開展離不開臨床研究運(yùn)營同事的努力。請大家用一句話寄語臨床研究未來经芋。
黃燕俠:
推進(jìn)藥物臨床試驗(yàn)在中國的發(fā)展焰诲,需要各界攜手合作,共創(chuàng)輝煌碟嘴。
于球:
臨床試驗(yàn)運(yùn)營應(yīng)重視CRC的職責(zé)回歸與職業(yè)發(fā)展溪食,同時(shí),銘記過去十年中國有470萬名受試者參與臨床試驗(yàn)娜扇,因此错沃,以患者為中心,保護(hù)受試者權(quán)益雀瓢,是我們行業(yè)義不容辭的責(zé)任枢析。
孫宇:
我對中國的臨床試驗(yàn)前景始終充滿信心,相信我們擁有雄厚的技術(shù)實(shí)力和人才儲備刃麸。只需些許耐心與時(shí)間的沉淀醒叁,我堅(jiān)信我們會做得更好,走向更高的巔峰泊业。
孔亮:
盡管近兩年中國生物醫(yī)藥產(chǎn)業(yè)經(jīng)歷了些許波折把沼,但前人的積累、技術(shù)和人才儲備為我們奠定了堅(jiān)實(shí)基礎(chǔ)吁伺。未來饮睬,將有更多企業(yè)能夠開展高質(zhì)量的臨床試驗(yàn),并走向世界舞臺谷培。
周曉琳:
愿醫(yī)藥卦瘤、創(chuàng)新藥行業(yè)能夠乘風(fēng)破浪,揚(yáng)帆起航梧杠。借助政策的東風(fēng)和數(shù)字化的浪潮弧蜒,雖然前路漫長且充滿挑戰(zhàn)也菊,但我們定能披荊斬棘,揚(yáng)帆遠(yuǎn)航砰穗,穿越創(chuàng)新藥內(nèi)卷的紅海揽宵,駛向更廣闊的國際市場。

與會講者合影渣么,我們明年再見脐拄!
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥魔方Invest
醫(yī)藥魔方Invest  2024-11-26
2024-11-26
 16
16

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥魔方
醫(yī)藥魔方  2024-11-26
2024-11-26
 16
16

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-11-26
2024-11-26
 17
17
 熱門資訊
熱門資訊