
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 ANLONG醫(yī)學(xué)
ANLONG醫(yī)學(xué)  2024-09-13
2024-09-13
 1334
1334
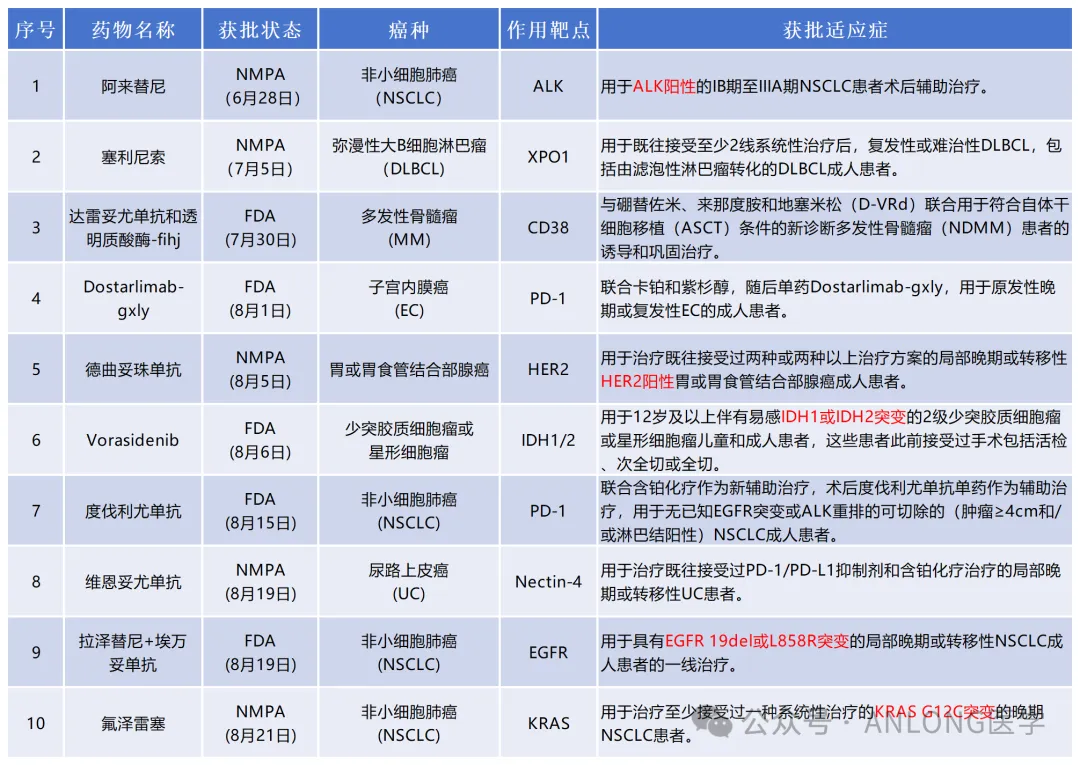
據(jù)公開資料顯示桦锄,2024年7-8月共有FDA批準新適應(yīng)癥5條冗吟,NMPA批準新適應(yīng)癥5條痒仆。靶向藥物新獲批主要針對ALK、HER2驾萄、IDH1/2碍逐、EGFR、KRAS等靶點基因。
詳細7-8月獲批上市藥物及藥物新獲批適應(yīng)癥見下文薪丐。
Part.1
新藥速遞(概括版)
Part.2
新藥速遞(詳細版)
1. 阿來替尼
商品名:安圣莎
通用名:阿來替尼
適應(yīng)癥:ALK陽性的IB期至IIIA期非小細胞肺癌
臨床試驗:ALINA
原研公司:羅氏
獲批日期:2024.06.28
獲批機構(gòu):NMPA
2024年6月28日冗腐,NMPA批準阿來替尼用于ALK陽性的IB期至IIIA期非小細胞肺癌(NSCLC)患者術(shù)后輔助治療。此前脱睛,NMPA已批準阿來替尼用于治療ALK陽性的局部晚期或轉(zhuǎn)移性NSCLC蚊患。此次阿來替尼新適應(yīng)癥的獲批,填補了國內(nèi)ALK陽性早期肺癌治療領(lǐng)域的空白护盈,也標志著阿來替尼成為了目前國內(nèi)首個同時覆蓋早期和晚期的ALK-TKI查库。
本次獲批是基于一項國際多中心、開放標簽黄琼、隨機、III期臨床試驗ALINA整慎,旨在評估阿來替尼對比含鉑化療輔助治療術(shù)后ALK陽性的NSCLC患者的療效和安全性脏款。研究共納入了257例IB-IIIA期且成功接受手術(shù)切除的ALK陽性NSCLC患者,以上患者隨機1:1分配到阿來替尼輔助治療組和含鉑化療輔助治療組裤园。研究主要終點為研究者評估的無病生存期(DFS)撤师,其他終點包括中樞神經(jīng)系統(tǒng)無病生存期(CNS-DFS)、總生存(OS)及安全性拧揽。
結(jié)果顯示剃盾,阿來替尼2年DFS率和3年DFS率都優(yōu)于化療組(2年:93.6%vs. 63.7%;3年:88.7%vs. 54%)淤袜,對比輔助化療痒谴,阿來替尼輔助治療可降低ALK陽性早期NSCLC患者76%的復(fù)發(fā)或死亡風(fēng)險(HR:0.24,P<0.001)蜻赃;其次椰严,阿來替尼在顱內(nèi)也展示著優(yōu)越的療效,可以降低中樞神經(jīng)系統(tǒng)78%的復(fù)發(fā)或死亡風(fēng)險(HR:0.22)钥币。安全性方面荡偶,阿來替尼展現(xiàn)出了完全可控的安全性特征:治療期間只有5%的患者因不良事件退出治療;健康相關(guān)生活質(zhì)量(HRQoL)分析結(jié)果顯示嘁老,接受阿來替尼治療的患者烧乙,心理狀態(tài)和生理狀態(tài)都得到快速恢復(fù);在2年治療中醉镇,心理和生理狀態(tài)均保持改善辱窘,與健康人群無異。
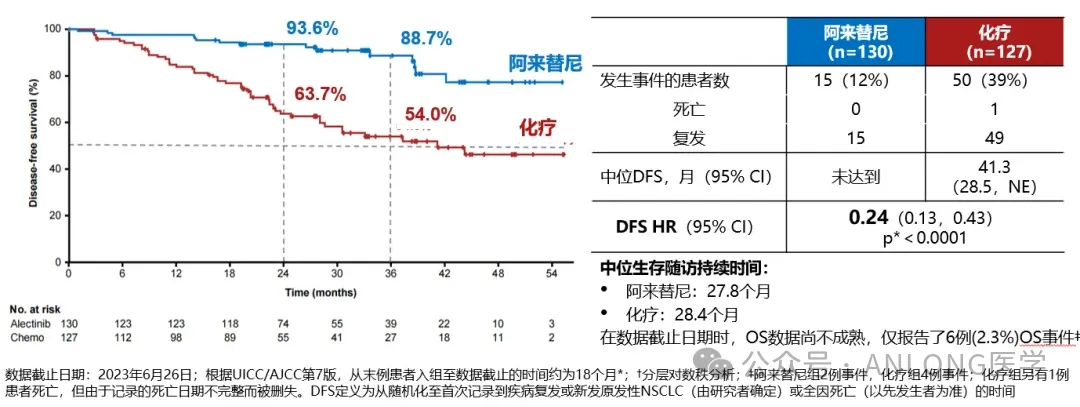
ALINA研究數(shù)據(jù)
2. 塞利尼索
商品名:希維奧
通用名:塞利尼索
適應(yīng)癥:復(fù)發(fā)性或難治性彌漫性大B細胞淋巴瘤
臨床試驗:SEARCH
原研公司:德琪醫(yī)藥
獲批日期:2024.07.05
獲批機構(gòu):NMPA
2024年7月5日窒汤,NMPA批準塞利尼索用于既往接受至少2線系統(tǒng)性治療后蜂镇,復(fù)發(fā)性或難治性彌漫性大B細胞淋巴瘤(DLBCL),包括由濾泡性淋巴瘤轉(zhuǎn)化的DLBCL成人患者。塞利尼索是一款口服選擇性核輸出蛋白(XPO1)抑制劑给酥。通過抑制核輸出蛋白XPO1深怕,塞利尼索可促使腫瘤抑制蛋白和其他生長調(diào)節(jié)蛋白的核內(nèi)儲留和活化,并下調(diào)細胞漿內(nèi)多種致癌蛋白水平泵肄,從而達到抗腫瘤的效果捆交。此前,NMPA已批準塞利尼索用于既往接受過治療且對至少一種蛋白酶體抑制劑腐巢,一種免疫調(diào)節(jié)劑以及一種抗CD38單克隆抗體藥物難治的復(fù)發(fā)/難治性多發(fā)性骨髓瘤(R/R MM)成人患者品追。
本次獲批基于一項中國注冊性臨床試驗SEARCH (NCT03992339),該研究共入組60例中國DLBCL患者冯丙,所有受試者由中心放射影像實驗室評估的總體緩解率(ORR)達到試驗預(yù)設(shè)的主要終點肉瓦。研究結(jié)果表明,塞利尼索單藥口服在中國受試者中具有明確的臨床療效胃惜,包括顯著的緩解率泞莉、持久的緩解時間和生存期。
3. 達雷妥尤單抗和透明質(zhì)酸酶-fihj
商品名:Darzalex Faspro
通用名:達雷妥尤單抗和透明質(zhì)酸酶-fihj
適應(yīng)癥:新診斷多發(fā)性骨髓瘤
臨床試驗:PERSEUS
原研公司:強生
獲批日期:2024.07.30
獲批機構(gòu):FDA
2024年7月30日船殉,F(xiàn)DA批準達雷妥尤單抗和透明質(zhì)酸酶-fihj與硼替佐米鲫趁、來那度胺和地塞米松(D-VRd)聯(lián)合用于符合自體干細胞移植(ASCT)條件的新診斷多發(fā)性骨髓瘤(NDMM)患者的誘導(dǎo)和鞏固治療。
本次獲批是基于一項隨機利虫、開放標簽的臨床試驗PERSEUS (NCT03710603)挨厚,研究納入了70歲及以下的符合自體干細胞移植條件的新診斷多發(fā)性骨髓瘤患者,隨機1:1分配到達雷妥尤單抗和透明質(zhì)酸酶-fihj聯(lián)合硼替佐米舔远、來那度胺和地塞米松治療組(D-VRd)及硼替佐米弓席、來那度胺和地塞米松治療組(VRd),主要療效結(jié)果指標是獨立審查委員會(IRC)基于國際骨髓瘤工作組(IMWG)緩解標準評估的無進展生存期(PFS)现碰。
結(jié)果顯示庵偏,D-VRd組的PFS優(yōu)于VRd組,兩組中位PFS均未達到现辑;與VRd相比母掀,D-VRd治療可使疾病進展或死亡風(fēng)險降低60%(HR [95% CI]: 0.40 [0.29, 0.57];p<0.0001)扳耘;此外焰哮,D-VRd組的完全緩解率(CR)為44.5%,高于VRd組的34.7%液茧;D-VRd組的微小殘留病灶(MRD)陰性率顯著高于VRd組(57.5%vs. 32.5%)仆加。安全性方面,接受 D-VRd 治療的患者最常見的(≥20%)不良反應(yīng)為周圍神經(jīng)病變缚庐、乏力唁奢、水腫、發(fā)熱、上呼吸道感染麻掸、便秘酥夭、腹瀉、肌肉骨骼疼痛脊奋、失眠和皮疹熬北。
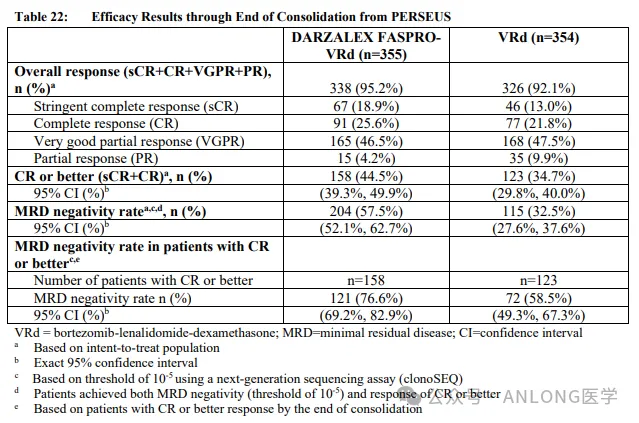
PERSEUS研究數(shù)據(jù)
4. Dostarlimab-gxly
商品名:Jemperli
通用名:Dostarlimab-gxly
適應(yīng)癥:原發(fā)性晚期或復(fù)發(fā)性子宮內(nèi)膜癌
臨床試驗:RUBY
原研公司:葛蘭素史克(GSK)
獲批日期:2024.08.01
獲批機構(gòu):FDA
2024年8月1日,F(xiàn)DA批準Dostarlimab-gxly聯(lián)合卡鉑和紫杉醇诚隙,隨后單藥Dostarlimab-gxly讶隐,用于原發(fā)性晚期或復(fù)發(fā)性子宮內(nèi)膜癌(EC)的成人患者。此前久又,F(xiàn)DA已批準Dostarlimab-gxly聯(lián)合卡鉑和紫杉醇巫延,隨后單藥Dostarlimab-gxly,用于dMMR/MSI-H的原發(fā)性晚期或復(fù)發(fā)性子宮內(nèi)膜癌患者地消。此次獲批擴大了Dostarlimab-gxly聯(lián)合化療的適應(yīng)癥烈评,涵蓋了pMMR/MSS腫瘤患者,這類患者占子宮內(nèi)膜癌的70~75%犯建,且治療選擇有限。
本次獲批基于一項多中心娇歹、隨機张相、雙盲、安慰劑對照的臨床試驗RUBY(NCT03981796)劣屑,研究納入494例原發(fā)性晚期或復(fù)發(fā)性EC患者蝗腻,隨機1:1分配到Dostarlimab-gxly組(先Dostarlimab-gxly聯(lián)合卡鉑和紫杉醇,隨后Dostarlimab-gxly單藥治療)及安慰劑組(先安慰劑聯(lián)合卡鉑和紫杉醇涮凡,隨后安慰劑治療)拓币,該研究主要療效結(jié)局指標是根據(jù)RECIST v1.1評估的無進展生存期(PFS)及總生存期(OS)。
結(jié)果顯示肤侍,不考慮MMR和MSI狀態(tài)情況下琳宽,Dostarlimab-gxly組的中位OS顯著高于安慰劑組(44.6個月vs. 28.2個月);Dostarlimab-gxly組和安慰劑組的中位PFS分別為11.8個月和7.9個月弄业。針對pMMR/MSS的EC患者泛邮,Dostarlimab-gxly組的中位OS也高于安慰劑組(32.5個月vs. 28.2個月),中位PFS也相對較長(9.8個月vs. 7.9個月)辈净。安全性方面盯质,Dostarlimab-gxly組的安全性特征與已知的各個單一藥物的安全性特征總體一致;接受Dostarlimab-gxly聯(lián)合化療治療的患者中概而,最常見的治療相關(guān)不良事件(≥20%)包括惡心呼巷、脫發(fā)、疲勞、周圍神經(jīng)病變王悍、貧血破镰、關(guān)節(jié)痛、便秘配名、腹瀉啤咽、肌痛、皮疹渠脉、低鎂血癥宇整、食欲減退、周圍感覺神經(jīng)病變和嘔吐芋膘。
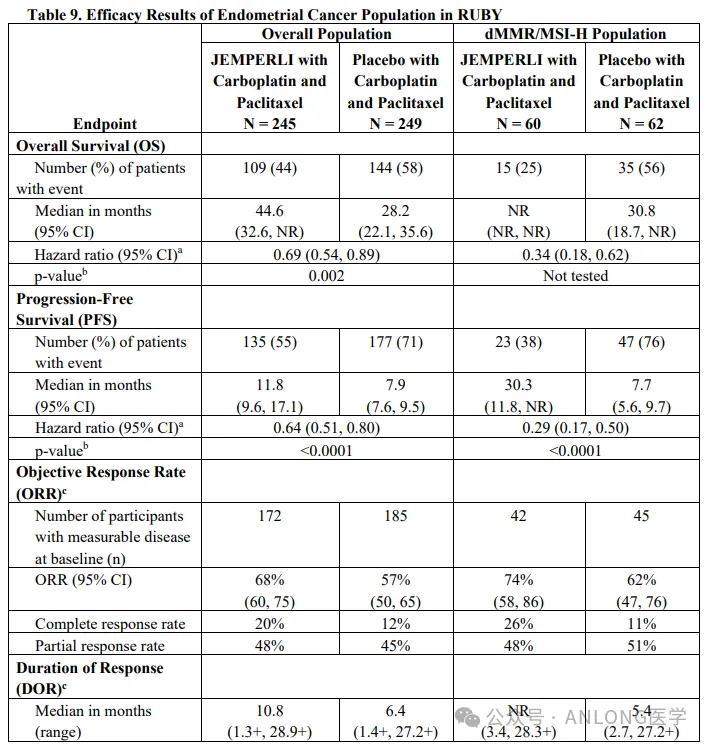
RUBY研究數(shù)據(jù)
5. 德曲妥珠單抗
商品名:優(yōu)赫得
通用名:德曲妥珠單抗
適應(yīng)癥:HER2陽性胃或胃食管結(jié)合部腺癌成人患者
臨床試驗:DESTINY-Gastric06
原研公司:阿斯利康鳞青、第一三共
獲批日期:2024.08.05
獲批機構(gòu):NMPA
2024年8月5日,NMPA批準德曲妥珠單抗用于治療既往接受過兩種或兩種以上治療方案的局部晚期或轉(zhuǎn)移性HER2陽性胃或胃食管結(jié)合部腺癌成人患者凡矿。這是德曲妥珠單抗在國內(nèi)獲批的第3項重磅適應(yīng)癥键先。此前,NMPA批準其單藥用于治療既往接受過一種或一種以上抗HER2藥物治療的不可切除或轉(zhuǎn)移性HER2陽性乳腺癌成人患者紊竹;NMPA批準其單藥用于治療既往在轉(zhuǎn)移性疾病階段接受過至少一種系統(tǒng)治療的牺道,或在輔助化療期間或完成輔助化療之后6個月內(nèi)復(fù)發(fā)的,不可切除或轉(zhuǎn)移性HER2低表達(IHC 1+或IHC 2+/ISH-)乳腺癌成人患者壹会。
本次獲批基于一項開放標簽颈顽、單臂、II期的中國橋接試驗DESTINY-Gastric06(NCT04989816)及键,研究納入了95例既往接受過至少兩種治療方案(包括氟嘧啶和鉑類藥物)的HER2陽性(IHC3+或IHC2+/ISH+)晚期胃/胃食管結(jié)合部腺癌患者盖赛,以上患者接受德曲妥珠單抗治療,主要研究終點為獨立中心評審(ICR)根據(jù)RECIST v1.1評估確認的客觀緩解率(ORR)胸胚,次要終點包括研究者評估(INV)確認的ORR甜届、緩解持續(xù)時間(DoR)、無進展生存期(PFS)垫嚣、總生存期(OS)以及安全性和耐受性岩模。
結(jié)果顯示,中位隨訪時間8.0個月時肖粮,ICR確認的德曲妥珠單抗治療組的ORR為28.8%简逮,INV確認的ORR為35.6%;中位DoR尿赚、OS和PFS分別為7.9個月散庶、10.2個月和5.7個月。安全性方面凌净,3.2%的患者因藥物相關(guān)AE而停止治療悲龟,5.3%患者因COVID-19相關(guān)AE而停止治療屋讶;與藥物相關(guān)的間質(zhì)性肺病/肺炎發(fā)生率為3.2%,且均為1-2級须教。
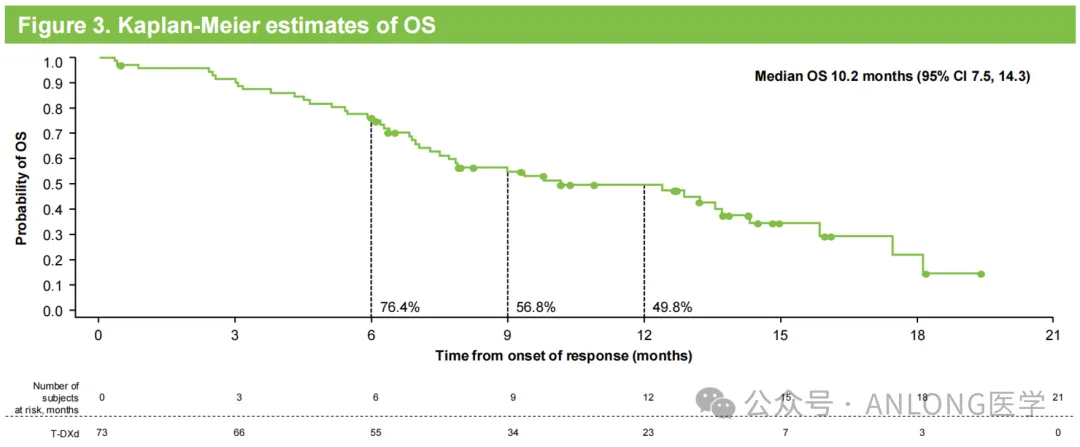
DESTINY-Gastric06研究數(shù)據(jù)
6. Vorasidenib
商品名:Voranigo
通用名:Vorasidenib
適應(yīng)癥:IDH1或IDH2突變的2級少突膠質(zhì)細胞瘤或星形細胞瘤
臨床試驗:INDIGO(Study AG881-C-004)
原研公司:施維雅
獲批日期:2024.08.06
獲批機構(gòu):FDA
2024年8月6日皿渗,F(xiàn)DA批準Vorasidenib用于12歲及以上伴有易感IDH1或IDH2突變的2級少突膠質(zhì)細胞瘤或星形細胞瘤兒童和成人患者,這些患者此前接受過手術(shù)包括活檢轻腺、次全切或全切乐疆。這是FDA首次批準的可用于這類患者的全身療法。
本次獲批是基于一項隨機贬养、多中心挤土、雙盲、安慰劑對照的臨床試驗INDIGO(NCT04164901)郎博,研究納入了331伴有IDH1或IDH2突變的2級少突膠質(zhì)細胞瘤或星形細胞瘤患者巧杰,他(她)們之前進行過手術(shù)(包括活檢、次全切除術(shù)或全切除術(shù))抱壶,以上患者隨機1:1分配到Vorasidenib治療組和安慰劑治療組谈嚣,主要療效終點是無進展生存期(PFS),關(guān)鍵次要終點為至下一次干預(yù)時間(TTNI)院颜。
結(jié)果顯示琅沟,對比安慰劑治療組,Vorasidenib治療能夠顯著延長患者PFS(27.7個月vs. 11.1個月驳墓;HR=0.39熏屎;95% CI:[0.27, 0.56],p<0.0001)逮赋。此外,Vorasidenib組中位TTNI未達到镰对,安慰劑組的中位TTNI為17.8個月(HR=0.26卓奄;95% CI:[0.15, 0.43],p<0.0001)止毕。安全性方面模蜡,研究最常見的(≥15%)不良反應(yīng)是疲勞、頭痛扁凛、covid-19感染忍疾、肌肉骨骼疼痛、腹瀉谨朝、惡心和癲癇發(fā)作卤妒;最常見的3級或4級實驗室異常(>2%)是丙氨酸氨基轉(zhuǎn)移酶升高、天冬氨酸氨基轉(zhuǎn)移酶升高字币、GGT升高和中性粒細胞減少则披。

INDIGO研究數(shù)據(jù)
7. 度伐利尤單抗
商品名:英飛凡
通用名:度伐利尤單抗
適應(yīng)癥:無EGFR突變或ALK重排的可切除非小細胞肺癌圍手術(shù)期治療
臨床試驗:AEGEAN
原研公司:阿斯利康
獲批日期:2024.08.15
獲批機構(gòu):FDA
2024年8月15日共缕,F(xiàn)DA批準度伐利尤單抗聯(lián)合含鉑化療作為新輔助治療,術(shù)后度伐利尤單抗單藥作為輔助治療士复,用于無已知EGFR突變或ALK重排的可切除的(腫瘤≥4cm和/或淋巴結(jié)陽性)NSCLC成人患者图谷。
本次獲批是基于一項隨機、雙盲阱洪、安慰劑對照便贵、多中心試驗AEGEAN( NCT03800134 ),根據(jù)AJCC第8版標準弱豹,研究納入了未經(jīng)治療遂辐、可切除且不攜帶已知EGFR突變或ALK重排的IIA至IIIB期NSCLC患者,以上患者隨機1:1分配到實驗組(度伐利尤單抗聯(lián)合含鉑化療新輔助治療孕称,度伐利尤單抗輔助治療)和對照組(安慰劑聯(lián)合含鉑化療新輔助治療式涝,安慰劑輔助治療),研究的主要終點是由盲法中心病理實驗室確定的病理學(xué)完全緩解率(pCR)和盲法獨立中心審查(BICR)確定的無事件生存期(EFS)酝遇。
結(jié)果顯示图汪,實驗組的中位EFS未達到(95%CI,31.9-NR)驳芙,對照組的中位EFS為25.9個月(95%CI讳汇,18.9-NR)(HR=0.68;95%CI掰闯,0.53-0.88)枪第;對比對照組,實驗組的pCR更優(yōu)(17.2%vs. 4.3%)的钞,兩組反映出絕對差異為12.9%(95% CI兜蠕,8.7%-17.6%;P< 0.0001)抛寝。安全性方面熊杨,兩組3-4級不良事件的發(fā)生率相當(dāng)(42.4%vs. 43.2%),最常見的不良反應(yīng)(≥20%)是貧血盗舰、惡心晶府、便秘、疲勞钻趋、肌肉骨骼疼痛和皮疹川陆;在接受度伐利尤單抗新輔助治療的患者中,1.7%因不良反應(yīng)而無法接受手術(shù)蛮位,而安慰劑組為1%较沪。
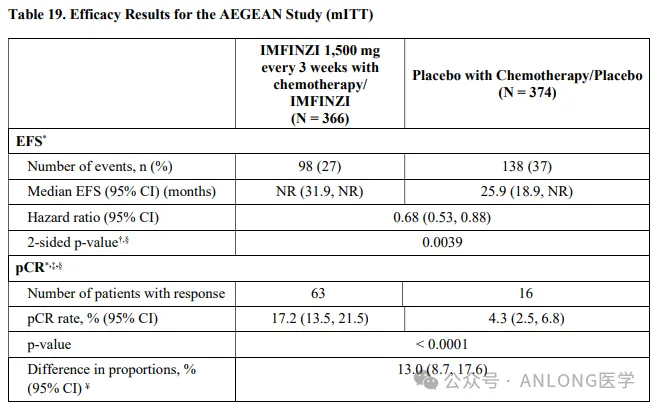
AEGEAN研究數(shù)據(jù)
8. 維恩妥尤單抗
商品名:Padcev
通用名:維恩妥尤單抗
適應(yīng)癥:接受過PD-1/PD-L1抑制劑和含鉑化療治療的局部晚期或轉(zhuǎn)移性尿路上皮癌
臨床試驗:EV-203
原研公司:安斯泰來、輝瑞
獲批日期:2024.08.19
獲批機構(gòu):NMPA
2024年8月19日失仁,NMPA批準維恩妥尤單抗用于治療既往接受過PD-1/PD-L1抑制劑和含鉑化療治療的局部晚期或轉(zhuǎn)移性尿路上皮癌(mUC)患者购对。維恩妥尤單抗是全球首個獲批的Nectin-4靶向ADC藥物猾昆,此前,國外已經(jīng)獲批其用于局部晚期或轉(zhuǎn)移性尿路上皮癌患者中协包,本次獲批也使其成為了首個在國內(nèi)獲批的Nectin-4靶向ADC藥物帅珍。
本次獲批是基于一項在中國開展的單臂、開放標簽幔憋、多中心的II期橋接臨床試驗EV-203 (NCT04995419)司报,該研究納入了40例既往接受過含鉑化療和PD-1/PD-L1抑制劑治療的局部晚期或轉(zhuǎn)移性尿路上皮癌中國患者,旨在評估維恩妥尤單抗治療以上患者的療效全乙、安全性和藥代動力學(xué)特征偎洋,主要終點是獨立審查委員會(IRC) 確認的客觀緩解率(ORR)。
結(jié)果顯示侄伟,IRC評估的ORR為37.5%睁奶,其中1位患者達到完全緩解(CR),14位患者達到部分緩解(PR)撇委,IRC 評估的疾病控制率(DCR)為 72.5%爵蝠;研究者評估的ORR為42.5%,DCR為 82.5%汪仰。安全性方面揩墓,研究中未發(fā)現(xiàn)新的安全性信號,大多數(shù)治療相關(guān)的不良反應(yīng)多為1-2級典挑,2例患者因治療相關(guān)不良反應(yīng)(急性冠狀動脈綜合征和高血糖/皮疹)而停藥酥宴。

EV-203研究數(shù)據(jù)
9. 拉澤替尼+埃萬妥單抗
商品名:Leclaza+Rybrevant
通用名:拉澤替尼(Lazertinib)+埃萬妥單抗(Amivantamab-vmjw)
適應(yīng)癥:EGFR 19del或L858R突變的局部晚期或轉(zhuǎn)移性非小細胞肺癌
臨床試驗:MARIPOSA
原研公司:強生
獲批日期:2024.08.19
獲批機構(gòu):FDA
2024年8月19日,F(xiàn)DA批準拉澤替尼(Lazertinib) 聯(lián)合埃萬妥單抗(Amivantamab-vmjw)用于具有EGFR 19del或L858R突變的局部晚期或轉(zhuǎn)移性非小細胞肺癌(NSCLC)成人患者的一線治療您觉。
本次獲批基于一項隨機拙寡、陽性藥物對照、多中心的III期臨床試驗MARIPOSA(NCT04487080)琳水,研究納入了1074例既往未經(jīng)治療的EGFR 19del或L858R突變的局部晚期或轉(zhuǎn)移性NSCLC患者肆糕,隨機2:2:1分配到拉澤替尼+埃萬妥單抗治療組、奧希替尼單藥治療組或拉澤替尼單藥治療組炫刷,研究的主要終點是由獨立盲法中心評估的無進展生存期(PFS),次要終點包括客觀緩解率(ORR)郁妈、緩解持續(xù)時間(DoR)和安全性浑玛。
結(jié)果顯示,拉澤替尼+埃萬妥單抗組和奧希替尼組的中位PFS分別為23.7個月和16.6個月(HR=0.70噩咪,P<0.001)顾彰;無論患者是否伴腦轉(zhuǎn),拉澤替尼+埃萬妥單抗組的PFS獲益一致(HR均為0.69)胃碾;拉澤替尼+埃萬妥單抗組和奧希替尼組的ORR分別為78%和73%蜻罕;在確認達到緩解的患者中蛹鼎,拉澤替尼+埃萬妥單抗組的中位DoR優(yōu)于奧希替尼組(25.8個月vs. 16.7個月)。安全性方面涯贝,聯(lián)合治療組和奧希替尼組因治療相關(guān)不良事件(TRAE)導(dǎo)致停藥的發(fā)生率分別為10%和3%列充,聯(lián)合治療組最常見的AE包括甲溝炎(68%;≥3級為11%)和輸液相關(guān)反應(yīng)(63%跃呛;≥3級為6%)频咨;靜脈血栓栓塞(VTE)是特別關(guān)注的AE,多為1-2級秦砌,且大多數(shù)VTE發(fā)生在拉澤替尼+埃萬妥單抗治療開始后4個月內(nèi)埃账,并通過抗凝治療得到了有效控制。
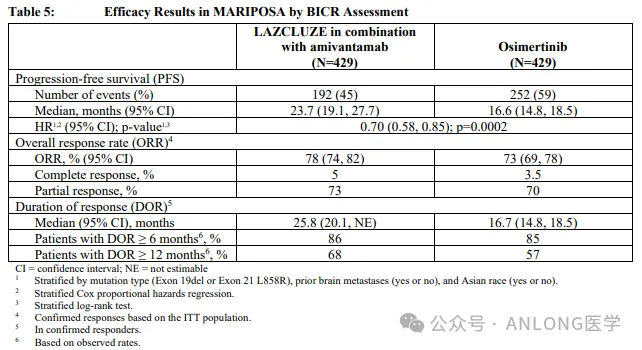
MARIPOSA研究數(shù)據(jù)
10. 氟澤雷塞
商品名:達伯特
通用名:氟澤雷塞
適應(yīng)癥:至少接受過一種系統(tǒng)性治療的KRAS G12C突變的晚期非小細胞肺癌
臨床試驗:NCT05005234
原研公司:信達生物经聊、勁方醫(yī)藥
獲批日期:2024.08.21
獲批機構(gòu):NMPA
2024年8月21日唱棍,NMPA批準氟澤雷塞用于治療至少接受過一種系統(tǒng)性治療的KRAS G12C突變的晚期非小細胞肺癌(NSCLC)。截至到目前守譬,全球范圍內(nèi)目前共有3款KRAS G12C抑制劑獲批上市估喷,分別為安進的索托拉西布(Sotorasib)、百時美施貴寶的阿達格拉西(Adagrasib)疗韵、信達/勁方醫(yī)藥的氟澤雷塞(Fulzerasib)兑障。本次獲批藥物氟澤雷塞不僅是首個在國內(nèi)獲批的KRAS抑制劑,也是全球范圍內(nèi)首個獲批上市的國產(chǎn)KRAS抑制劑蕉汪。
本次獲批是基于一項在中國開展的臨床II期單臂注冊研究(NCT05005234)流译,旨在評估氟澤雷塞單藥在標準治療失敗或不耐受且攜帶KRAS G12C突變的晚期NSCLC患者中的安全性、耐受性和療效者疤。
結(jié)果顯示福澡,經(jīng)獨立影像學(xué)評審委員會(IRRC)評估的患者的客觀緩解率(ORR)達 49.1%,高于此前已獲批的兩款KRAS G12C抑制劑的ORR(Sotorasib:32.7%驹马;Adagrasib:43%)革砸;疾病控制率(DCR)達 90.5% ;中位緩解持續(xù)時間(DoR)未達到糯累;中位無進展生存期(mPFS)為 9.7 個月算利;中位生存期(OS)尚未達到。亞組分析顯示泳姐,各亞組在氟澤雷塞單藥治療中基本取得一致獲益效拭,包括預(yù)后較差的腦轉(zhuǎn)移患者,35例(30.2%)基線腦轉(zhuǎn)移患者經(jīng)IRRC確認的ORR為48.6%门烧,DCR為94.3%甜湾;81例基線無腦轉(zhuǎn)移患者經(jīng)IRRC確認的ORR為49.4%,DCR為88.9%鹅棺,兩者腫瘤應(yīng)答狀況相似兜充;與腦轉(zhuǎn)移患者相比淋渤,基線無腦轉(zhuǎn)移患者的mPFS較好(10.4個月vs. 6.4個月)。安全性方面雄睦,患者總體安全性良好荷十,共有90.5%(105/116)的受試者發(fā)生治療相關(guān)不良事件(TRAE),大部分為1-2級妆跌,最常見的TRAEs為貧血榴廷、丙氨酸氨基轉(zhuǎn)移酶升高、天門冬氨酸氨基轉(zhuǎn)移酶升高证账、乏力和蛋白尿钢战,40.5%的受試者發(fā)生3級及以上TRAEs。
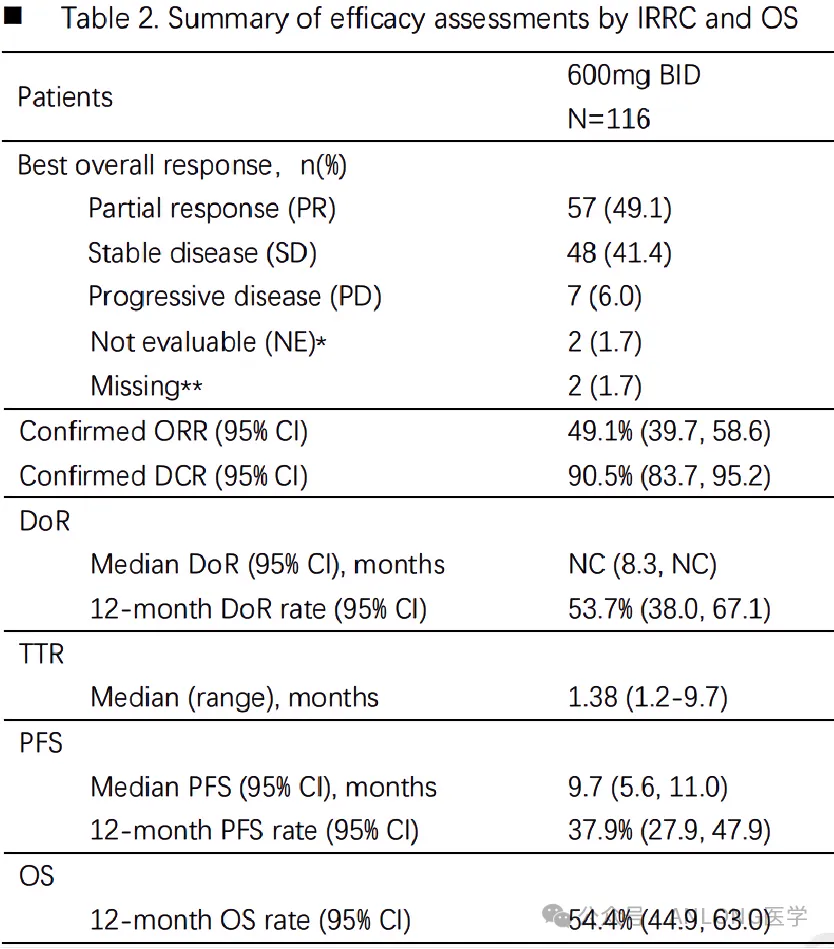
臨床研究數(shù)據(jù)
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥魔方Invest
醫(yī)藥魔方Invest  2024-11-26
2024-11-26
 8
8

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥魔方
醫(yī)藥魔方  2024-11-26
2024-11-26
 7
7

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-11-26
2024-11-26
 7
7