
 研發(fā)追蹤
研發(fā)追蹤
 2015-07-06
2015-07-06
 4398
4398
來源:新康界/金伊??? 2015-7-6
表1 2015年06月份美國FDA審批通過新藥
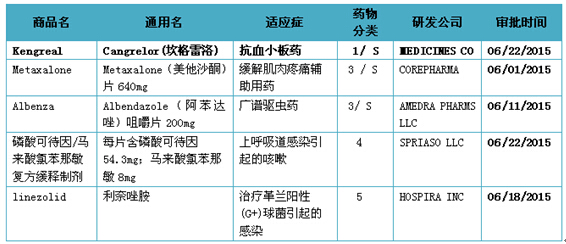
注:1)化學(xué)新藥分類:1類新分子實體化合物;3類新劑型;4類新組合物涝桅; 5類藥物新規(guī)格或新生產(chǎn)商惊奇;
2)審批分類:P優(yōu)先評審;S常規(guī)評審
美國FDA審批新藥主要是根據(jù)藥物化學(xué)類型和治療潛能來進行分類的开仰。新藥按化學(xué)類型主要分為:1類新分子實體化合物(NME)拟枚,創(chuàng)新性最強。指在美國從未作為藥品批準或銷售的活性成分众弓,可以是單一成分恩溅,也可以是立體異構(gòu)混合物中的一部分;2類新的衍生物谓娃。從已上市的活性成分(即所謂“專利”藥)化學(xué)衍生而來脚乡,即已在美國上市的活性成分的酯、鹽或其它非共價鍵衍生物,或者是去修飾基團的母體化合物未在美國批準上市的滨达;3類新劑型奶稠。含有已上市活性成分的新劑型或新處方,其適應(yīng)癥可以與上市產(chǎn)品相同恃打,也可以不同钟唯;4類新組合物。含有兩種或兩種以上已上市的活性成分的品種市缠,上市產(chǎn)品中尚無這種組合掏谎;5類藥物新規(guī)格或新生產(chǎn)商;6類新適應(yīng)癥钮瘪。由同一家公司或其他公司在美國批準或上市的具有新用途的復(fù)制品锄菊;7類已上市但未經(jīng)NDA批準的藥品。適應(yīng)癥已與上市產(chǎn)品相同,也可不同占犹;8類變?yōu)榉翘幏剿帲?span>10類適應(yīng)癥不同的新的新藥申請诞昧。
抗血小板新分子實體藥物Kengreal(Cangrelor)
2015年06月22日,美國FDA批準了Medicine’s Company的抗血小板注射劑Kengreal(Cangrelor)上市理币。Kengreal為P2Y12血小板抑制劑步嘹,用于避免成人患者在經(jīng)皮冠狀動脈介入治療(percutaneous coronary intervention,PCI)過程中因凝血造成的冠狀動脈堵塞聋亡。
?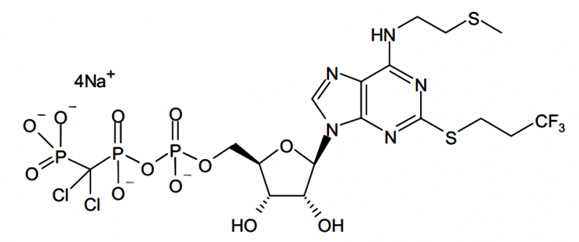
Kengreal在經(jīng)皮冠狀動脈介入治療開始前給藥肘习。患者首先靜脈推注Kengreal坡倔,給藥劑量是30 mcg/kg漂佩;隨后靜脈輸液Kengreal,給藥劑量為4 mcg/kg/min罪塔,Kengreal靜脈輸液一般要給藥至少2個小時投蝉,或持續(xù)整個經(jīng)皮冠狀動脈介入治療期。和其它抗血小板藥物一樣征堪,Kengreal最嚴重的風險是大出血的可能瘩缆。

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 200
200

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 202
202

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 207
207