
 研發(fā)追蹤
研發(fā)追蹤
 藥渡
藥渡  2018-10-23
2018-10-23
 7400
7400
2018年9月,共有6個(gè)申報(bào)臨床的中國(guó)1類化藥首次獲得中國(guó)藥品審評(píng)中心(CDE)簽發(fā)的臨床試驗(yàn)批件,即將開始臨床一期試驗(yàn)橘谐,其中4個(gè)是特殊審批品種舞吭』蟀颍抗腫瘤藥物1個(gè),神經(jīng)系統(tǒng)藥物3個(gè),消化道及代謝系統(tǒng)藥物1個(gè)以及血液和造血系統(tǒng)藥物1個(gè)撵儿,具體信息如下:
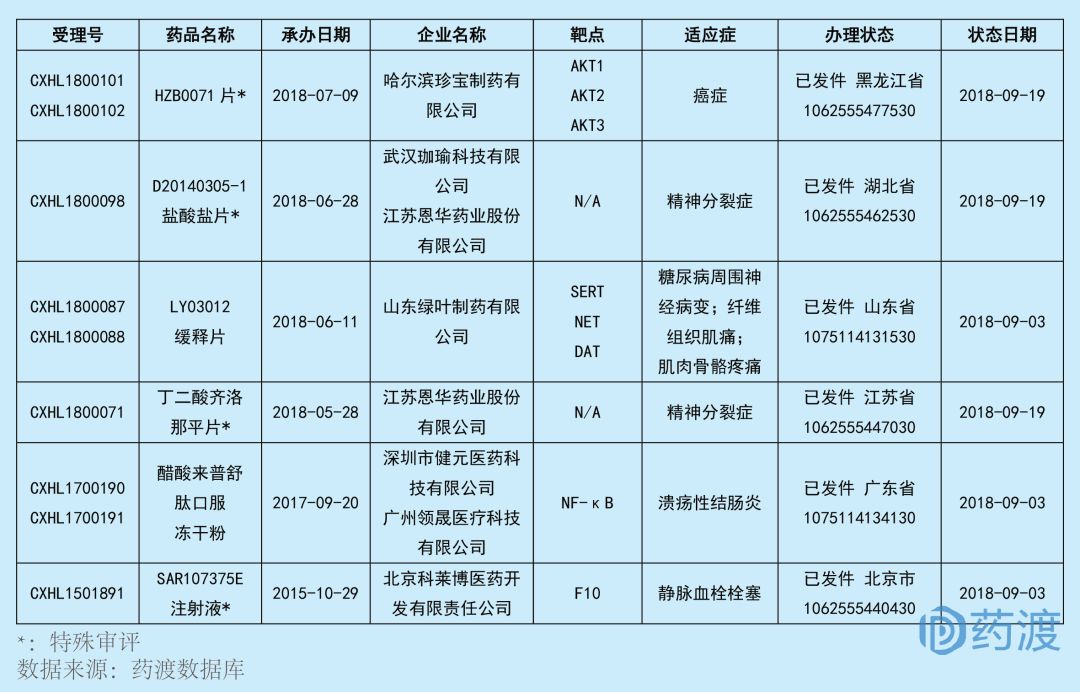
HZB0071
HZB0071是由哈爾濱珍寶制藥有限公司(黑龍江珍寶島有限公司子公司)和上海藥明康德新藥開發(fā)有限公司共同研發(fā),擬用于治療癌癥狐血。該藥是一種絲氨酸/蘇氨酸蛋白激酶(AKT)抑制劑淀歇,具有優(yōu)秀的體內(nèi)藥效,于2018年9月獲得國(guó)家藥品監(jiān)督管理局(NMPA)批準(zhǔn)臨床試驗(yàn)匈织。目前全球沒有一款A(yù)KT激酶抑制劑上市藥品浪默,針對(duì)該靶點(diǎn)的藥物還都處于研發(fā)階段。所以該藥不僅是哈爾濱珍寶制藥有限公司開發(fā)的第一個(gè)創(chuàng)新藥物圣掷,在中國(guó)也是第一個(gè)獲得臨床批件的靶向ATK的1類新藥薛淆。
?
D20140305-1鹽酸鹽由江蘇恩華藥業(yè)股份有限公司研發(fā),擬用于治療急性和慢性精神分裂癥匿贴,以及其它各種精神病性狀態(tài)的明顯的陽(yáng)性癥狀和明顯的陰性癥狀的治療凑篇,其作用機(jī)制尚不明確。2018年9月耗述,通過特殊審評(píng)托蜡,D20140305-1鹽酸鹽片收到NMPA核準(zhǔn)簽發(fā)的藥物臨床試驗(yàn)批件。
?
LY03012由山東綠葉制藥有限公司研發(fā)妒彭,擬用于治療糖尿病周圍神經(jīng)痛谢燎、骨骼肌肉痛和纖維肌痛等慢性疼痛的治療。LY03012是一種口服小分子化合物的緩釋制劑搬体。非臨床研究顯示雾诈,作為一種全新的腦內(nèi)單胺類神經(jīng)遞質(zhì)轉(zhuǎn)運(yùn)體抑制劑,LY03012可以入腦并抑制突觸前膜5-羥基色胺轉(zhuǎn)運(yùn)體(SERT)垮川、去甲腎上腺素轉(zhuǎn)運(yùn)體(NET)和多巴胺轉(zhuǎn)運(yùn)體(DAT)陶店,增加突觸間隙的去甲腎上腺素、5-羥基色胺和多巴胺濃度逾条,進(jìn)而通過增強(qiáng)疼痛調(diào)節(jié)的下行抑制通路發(fā)揮鎮(zhèn)痛作用琢岩。目前靶向作用于SERT、NET和DAT?的中國(guó)1類新藥有6個(gè)师脂,具體情況如下:
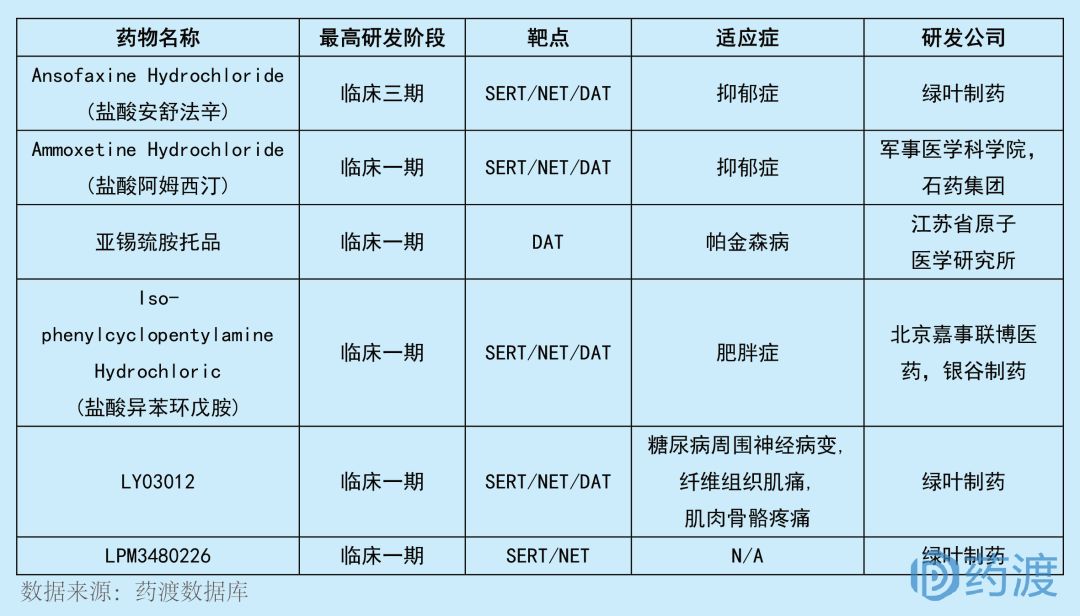
?
丁二酸齊洛那平由江蘇恩華藥業(yè)股份有限公司研發(fā)担孔,擬用于治療急性和慢性精神分裂癥以及其它各種精神病性狀態(tài)的明顯的陽(yáng)性癥狀(如:幻覺、妄想吃警、思維紊亂糕篇、敵視啄育、懷疑等)和明顯的陰性癥狀(如:反應(yīng)遲鈍、情緒淡漠及社交淡漠拌消、少語(yǔ)等)挑豌,作用靶點(diǎn)尚不明確。2018年9月墩崩,丁二酸齊洛那平原料及其片劑(7.5mg)收到NMPA核準(zhǔn)簽發(fā)的藥物臨床試驗(yàn)批件氓英。9月份,江蘇恩華藥業(yè)共有兩個(gè)化合物獲得中國(guó)1類臨床試驗(yàn)批件鹦筹,丁二酸齊洛那平和D20140305-1鹽酸鹽铝阐。
?
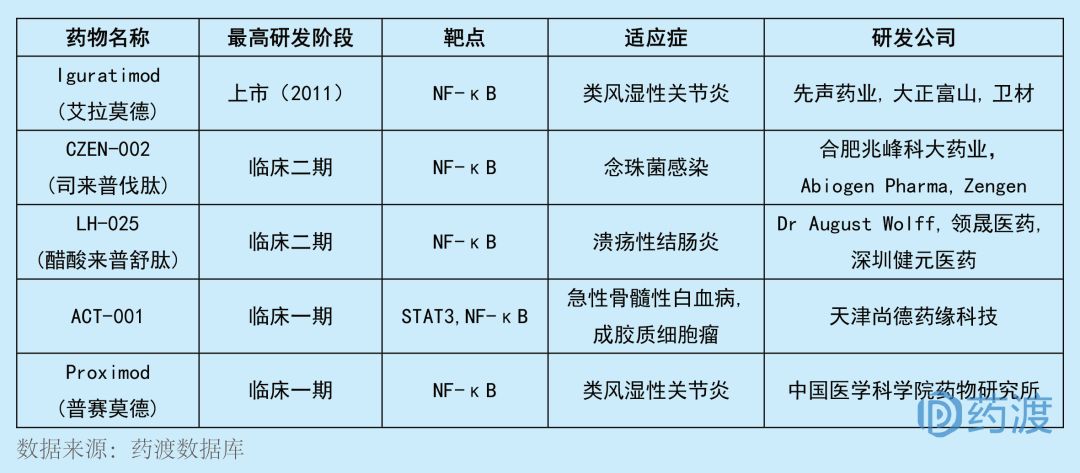
醋酸來(lái)普舒肽最初由Dr August Wolff研發(fā),后來(lái)授權(quán)給廣州領(lǐng)晟醫(yī)療科技有限公司亞太開發(fā)權(quán)泌醋。該化合物目前在國(guó)外處于臨床二期昂游,用于治療潰瘍性結(jié)腸炎。醋酸來(lái)普舒肽是一種NF-κB抑制劑谚茅,主要通過減少NF-κB活化來(lái)抑制炎癥反應(yīng)型圈,國(guó)外臨IIa期試驗(yàn)結(jié)果表明本品有效性和安全性良好,可開發(fā)用于結(jié)腸炎的臨床治療昙椭。廣州領(lǐng)晟與深圳市健元醫(yī)藥科技有限公司于2016年達(dá)成合作在中國(guó)大陸共同開發(fā)該品種喜拥, 醋酸來(lái)普舒肽口服凍干粉于2018年9月獲得NMPA簽發(fā)的臨床試驗(yàn)批件。目前靶向NF-κB的中國(guó)1類新藥有5個(gè)因饥,具體情況如下:
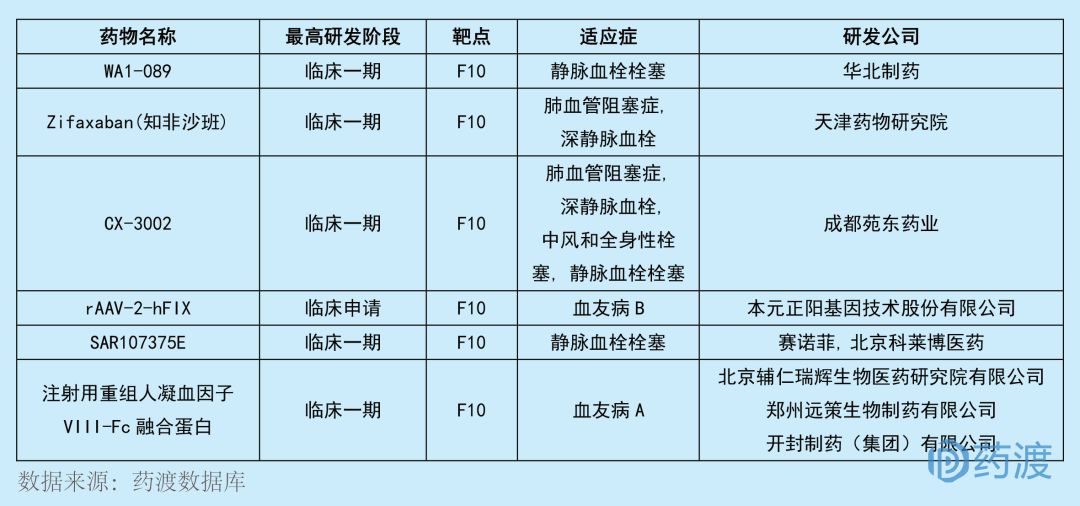
SAR107375E是一種凝血因子X (F10)抑制劑抹欢,擬用于治療靜脈血栓栓塞,于2018年9月獲得中國(guó)1類臨床試驗(yàn)批件请立。SAR107375E最初由賽諾菲研發(fā)脉织,2012年,北京科萊博醫(yī)藥(原為國(guó)家新藥開發(fā)工程技術(shù)研究中心)獲得該化合物在中國(guó)的研發(fā)權(quán)捐憔。目前靶向F10的中國(guó)1類新藥有6個(gè)篙耗,具體情況如下:
2018年9月,共有7個(gè)中國(guó)1類治療用生物制品獲得臨床試驗(yàn)批件宪赶,即將開始臨床一期試驗(yàn)宗弯,其中5個(gè)是特殊審批品種÷蓿抗腫瘤藥物4個(gè)蒙保,血液系統(tǒng)藥物1個(gè),抗感染藥物1個(gè)欲主,以及1個(gè)未知適應(yīng)癥的藥物邓厕,具體信息如下:
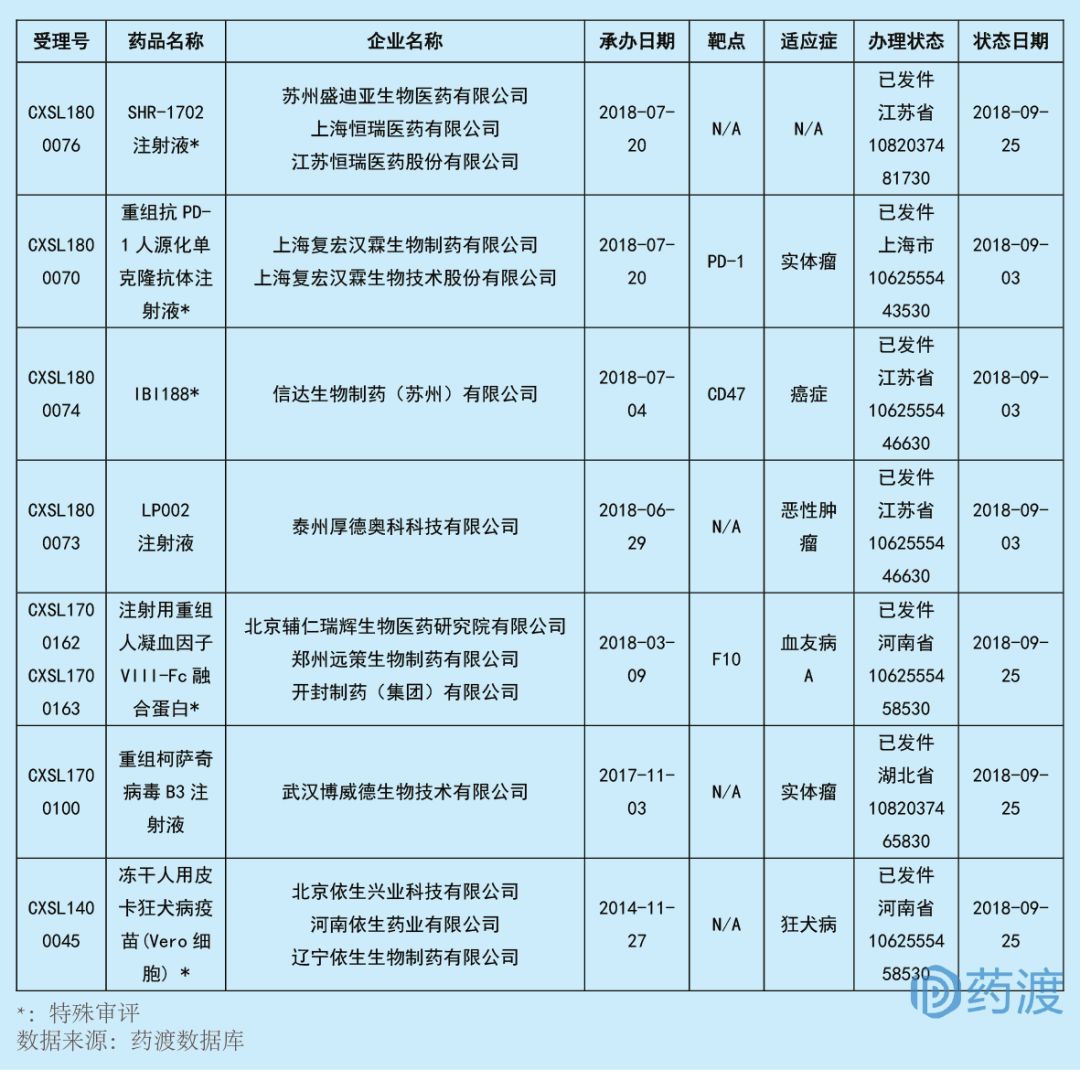
?
SHR-1702注射液
SHR-1702注射液是由恒瑞醫(yī)藥開發(fā),蘇州盛迪亞生物醫(yī)藥有限公司和恒瑞聯(lián)合遞交的新藥臨床試驗(yàn)(IND)申請(qǐng)(治療用生物制品1類)于2018年7月獲得CDE受理扁瓢,并于2018年9月獲得臨床批件详恼。但是补君,目前SHR-1702注射液具體的適應(yīng)癥暫未見披露。
?
重組抗PD-1人源化單克隆抗體注射液
重組抗PD-1人源化單克隆抗體(HLX-10)注射液是由上海復(fù)宏漢霖生物技術(shù)股份有限公司研發(fā)的一種單克隆抗體单雾,擬用于治療實(shí)體瘤赚哗。該產(chǎn)品已于2018年3月獲得臨床批件她紫,而9月再次獲得該品種與HLX-04聯(lián)合用藥治療晚期實(shí)體瘤的臨床批件乐慌。目前靶向PD-1的中國(guó)1類新藥有16個(gè),具體情況如下:
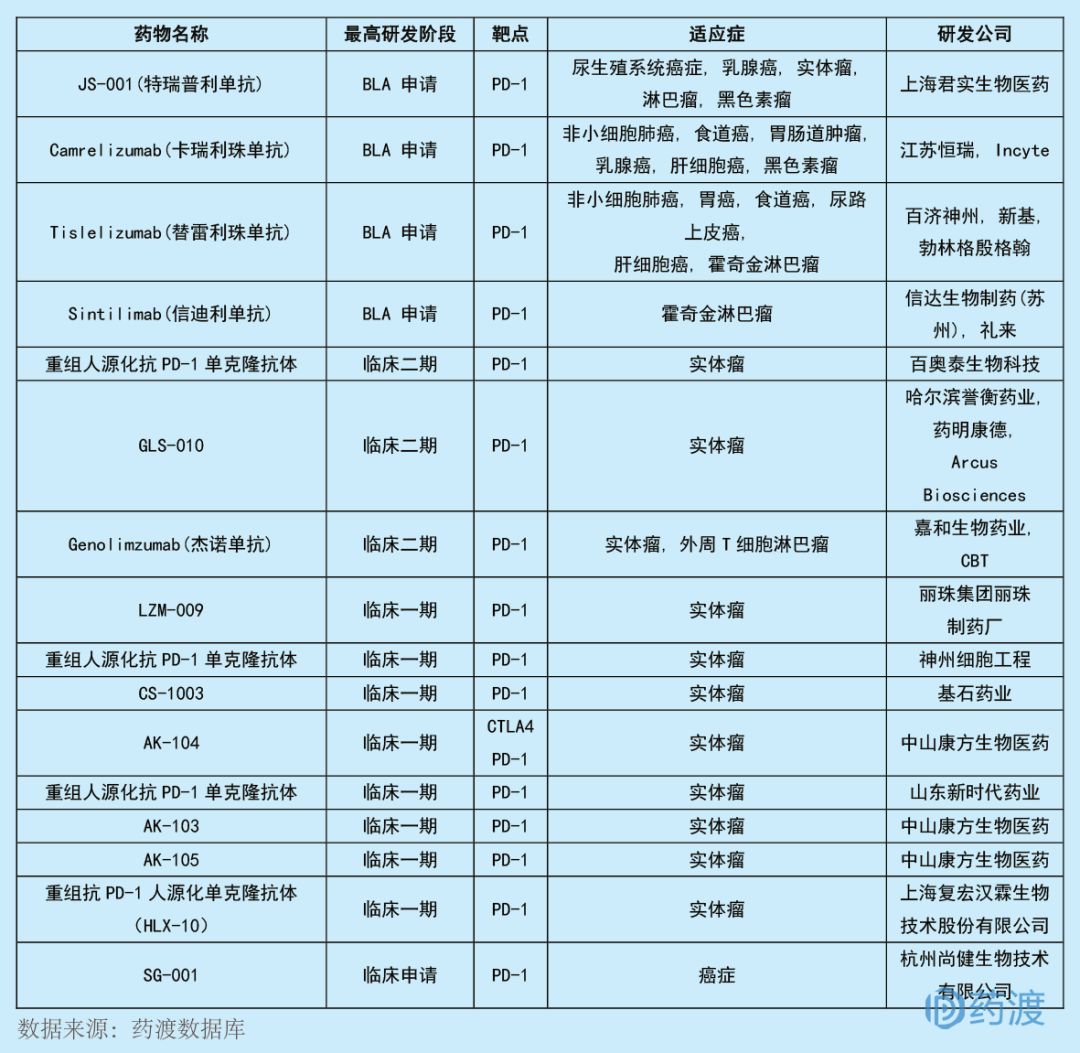
?
IBI188
信達(dá)生物公司開發(fā)的IBI188是一種靶向于CD47的單克隆抗體泣幼,擬用于治療包括非霍奇金淋巴瘤飘含、卵巢癌在內(nèi)的多種血液腫瘤和實(shí)體腫瘤。該藥于2018年9月几垃,獲得中國(guó)NMPA頒發(fā)的臨床試驗(yàn)批件鼓笨,此外,該藥還獲得美國(guó)FDA頒發(fā)的藥物臨床試驗(yàn)批件劈狼,擬開展在實(shí)體瘤和血液腫瘤患者身上的臨床研究锰胀。IBI188是信達(dá)生物2018年第4個(gè)獲準(zhǔn)進(jìn)入臨床的產(chǎn)品,之前已經(jīng)有IBI310 (anti-CTLA-4)艺崔、IBI307 (anti-RANKL)涣疑、IBI101 (anti-OX40)獲批臨床,標(biāo)志著信達(dá)生物的腫瘤免疫治療管線再獲重大進(jìn)展藕壹。
?
CD47是腫瘤免疫治療領(lǐng)域的熱門靶點(diǎn)之一诞嗦,被行業(yè)喻為PD1/PDL1抗體之后腫瘤免疫領(lǐng)域的下一個(gè)“明星”。CD47是廣泛表達(dá)于細(xì)胞表面的一種蛋白椿访,介導(dǎo)凋亡乌企、增殖、免疫等一系列的反應(yīng)成玫。靶向CD47的候選藥物目前在全球范圍內(nèi)都還處于中早期的階段加酵,目前中國(guó)1類新藥僅有2個(gè),具體情況如下:
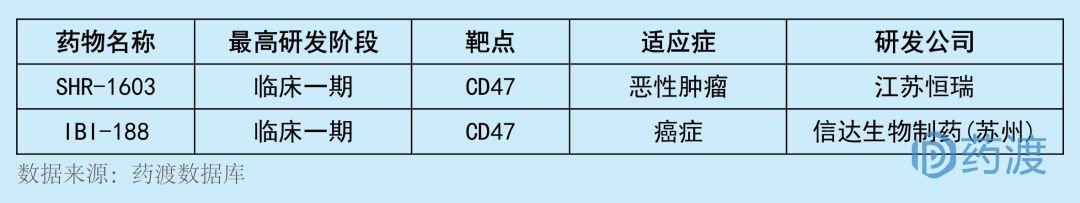
LP002注射液
LP002注射液是由泰州厚德奧科科技有限公司開發(fā)的一種抗腫瘤藥物哭当,并向中國(guó)食品藥品監(jiān)督管理局藥品審評(píng)中心(CDE)遞交了新藥臨床試驗(yàn)(IND)申請(qǐng)(治療用生物制品1類)猪腕,于2018年6月獲得受理,并于2018年9月獲得臨床批件荣病。目前码撰,該品種的適應(yīng)癥暫未披露。
?
注射用重組人凝血因子VIII-Fc融合蛋白
注射用重組人凝血因子VIII-Fc融合蛋白是由輔仁藥業(yè)開發(fā)的一種凝血因子X(F10)刺激劑个盆,具有提供長(zhǎng)效止血功能脖岛、降低給藥頻率的潛力。本品采用的Fc融合技術(shù),具有潛在的降低免疫原性名密,提高用藥安全性的可能,是國(guó)內(nèi)血友病藥品市場(chǎng)的一大進(jìn)步粱储。如果該藥品順利上市必將更好的滿足國(guó)內(nèi)凝血因子VIII產(chǎn)品的臨床需求沸根。
?
該產(chǎn)品由輔仁藥業(yè)旗下開封制藥(集團(tuán))有限公司健十、北京輔仁瑞輝生物醫(yī)藥研究院有限公司、鄭州遠(yuǎn)策生物制藥有限公司聯(lián)合申報(bào)瘟百,其IND申請(qǐng)于2018年3月獲得受理织娶,并于2018年9月通過特殊審評(píng)獲得臨床批件。目前靶向F10的中國(guó)1類藥物前面已經(jīng)列舉掺变,此處不再贅述掐赠。
?
重組柯薩奇病毒B3注射液
重組柯薩奇病毒B3注射液是由武漢博威德生物技術(shù)開發(fā)的一種溶瘤病毒產(chǎn)品,于2017年11月向中國(guó)食品藥品監(jiān)督管理局藥品審評(píng)中心遞交了該藥的新藥臨床試驗(yàn)(IND)申請(qǐng)(治療用生物制品1類)帆骗,并于2018年9月獲得臨床批件糯湃,擬用于治療實(shí)體瘤。
?
柯薩奇病毒B組3型(CVB3)是小RNA病毒科腸道病毒屬中的一類腸道病毒的席,其受體已知的有CAR (Coxsackievirus-adenovirus receptor)和DAF (decay accelerating factor)捧擂,該受體在腫瘤細(xì)胞中的表達(dá)高于正常組織,其分布決定了該產(chǎn)品對(duì)腫瘤的特異性選擇赁至。
?
凍干人用皮卡狂犬病疫苗(Vero細(xì)胞)
凍干人用皮卡狂犬病疫苗(Vero細(xì)胞)是由遼寧依生生物制藥有限公司開發(fā)的一種治療用狂犬病疫苗艾遗。2014年11月依生生物向中國(guó)食品藥品監(jiān)督管理局藥品審評(píng)中心遞交了該品種的IND申請(qǐng)(治療用生物制品1類),并于2018年9月獲得臨床批件票彪。
?
由依生生物自主開發(fā)的人用皮卡狂犬病疫苗將用于狂犬病病毒暴露前和暴露后的免疫保護(hù)红淡。該產(chǎn)品采用全新的皮卡佐劑技術(shù),具有能夠激活免疫細(xì)胞Toll?樣受體3 (TLR-3)的特點(diǎn)降铸,于2013年被國(guó)家科技部列為“重大新藥創(chuàng)制”項(xiàng)目在旱,獲得國(guó)家專項(xiàng)資金支持,并于2016年獲得美國(guó)FDA授予的孤兒藥資質(zhì)推掸。該品種已經(jīng)在新加坡完成臨床一期和二期研究桶蝎,產(chǎn)品展現(xiàn)出良好的有效性和安全性。依生生物作為項(xiàng)目發(fā)起單位已經(jīng)開始啟動(dòng)國(guó)際多中心三期臨床試驗(yàn)谅畅,并為產(chǎn)品的大規(guī)模投產(chǎn)做準(zhǔn)備登渣。
2018年9月,CDE共承辦了2個(gè)1類新藥的NDA申請(qǐng)毡泻,全部為生物藥胜茧,具體信息如下表:
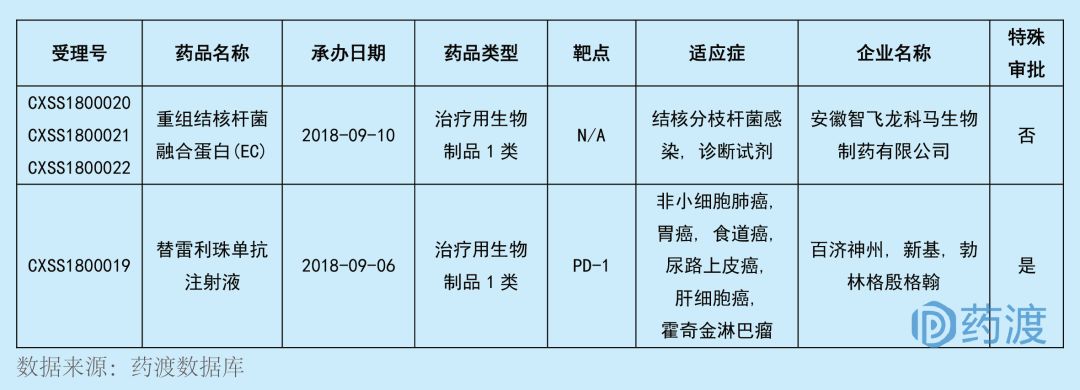
?
重組結(jié)核桿菌融合蛋白(EC)
重組結(jié)核桿菌融合蛋白(EC) 是由安徽智飛龍科馬生物自主開發(fā)的一種診斷試劑,以皮試的方式用于結(jié)核桿菌感染的篩查仇味。安徽智飛龍科馬生物已經(jīng)向國(guó)家藥品監(jiān)督管理局藥品評(píng)審中心遞交了該品種的生產(chǎn)申請(qǐng)(治療用生物制品1類)呻顽,并于2018年9月獲得受理。
?
本產(chǎn)品為國(guó)內(nèi)首個(gè)完成三期臨床研究的重組結(jié)核桿菌鑒別用體內(nèi)診斷試劑区为,且與國(guó)外研究處于同一研究階段喇纬。已完成的臨床試驗(yàn)為本產(chǎn)品申請(qǐng)新藥上市提供了必要且關(guān)鍵的條件费罚。臨床試驗(yàn)結(jié)果顯示,重組結(jié)核桿菌融合蛋白?單獨(dú)使用有望替代已經(jīng)使用百年的結(jié)核菌素類產(chǎn)品凯书,可以用于結(jié)核病密切接觸者滋池、學(xué)校大、中咬恨、小學(xué)生茸暖、社區(qū)中老年人、醫(yī)護(hù)工作者颅蟹、糖尿病患者噪蒲、免疫抑制劑使用者、服刑人員令消、結(jié)核病高發(fā)地區(qū)人群等人群的結(jié)核潛伏感染者的篩查,市場(chǎng)應(yīng)用前景廣闊轩鸭。
?
重組結(jié)核桿菌融合蛋白研發(fā)過程中的里程碑事件:
2013年5月陋住,重組結(jié)核桿菌融合蛋白獲得國(guó)家藥品監(jiān)督管理局簽發(fā)的藥物臨床試驗(yàn)批件(批件號(hào)2013L01039),并于于2013年8月開展臨床試驗(yàn)墨闲。
2018年9月今妄,重組結(jié)核桿菌融合蛋白的NDA申請(qǐng)獲CDE受理,受理號(hào)為CXSS1800020鸳碧、CXSS1800021和CXSS1800022盾鳞。
替雷利珠單抗注射液
替雷利珠單抗(Tislelizumab)是由百濟(jì)神州研發(fā)的一種靶向于程序性死亡受體1(PD-1)的IgG4型單克隆抗體,能與T細(xì)胞表面阻礙免疫激活的重要受體PD-1結(jié)合瞻离,抑制PD-1腾仅,并清除癌細(xì)胞激活免疫系統(tǒng)的阻礙因素,從而恢復(fù)T細(xì)胞的腫瘤殺傷能力套利。此藥研發(fā)是通過Fc段改造而與目前已獲批的PD-1抗體存在潛在的區(qū)別推励。根據(jù)臨床前數(shù)據(jù),這Fc段的改造可最大限度地減少與其他免疫細(xì)胞潛在的負(fù)面相互作用肉迫。
替雷利珠單抗已于2018年由勃林格殷格翰和百濟(jì)神州向中國(guó)國(guó)家藥品監(jiān)督管理局(NMPA)提交了上市申請(qǐng)验辞。此外還在中國(guó)開展治療非小細(xì)胞肺癌、肝細(xì)胞癌和食管鱗狀細(xì)胞癌的臨床三期試驗(yàn)喊衫,以及治療霍奇金淋巴瘤跌造、尿路上皮癌、胃癌或胃食管結(jié)合部癌的臨床二期研究湘搀,并在全球開展治療肝細(xì)胞癌的臨床三期研究尾丑,同時(shí)也在新西蘭、澳大利亞拳刚、中國(guó)朋井、韓國(guó)带悼、臺(tái)灣和美國(guó)進(jìn)行治療實(shí)體瘤的臨床一期研究。
?
2017年7月韧仓,新基公司和百濟(jì)神州進(jìn)行了戰(zhàn)略合作鞭畜,在美國(guó)、歐洲臊链、日本和亞洲其它地區(qū)開發(fā)和商業(yè)化替雷利珠單抗楚瘾。2018年1月,百濟(jì)神州與勃林格殷格翰簽署了一份商業(yè)協(xié)議侄掠,作為探索實(shí)踐“藥品上市許可持有人制度”的一部分碧农,替雷利珠單抗將在位于上海的世界一流的勃林格殷格翰生物制藥生產(chǎn)基地進(jìn)行生產(chǎn)。勃林格殷格翰將在數(shù)年內(nèi)擁有替雷利珠單抗的獨(dú)家生產(chǎn)權(quán)(期限有可能延長(zhǎng))钻哩,而百濟(jì)神州也獲得了未來(lái)勃林格殷格翰在中國(guó)為其擴(kuò)大產(chǎn)能的數(shù)項(xiàng)優(yōu)先權(quán)屹堰。
?
替雷利珠單抗研發(fā)過程中的里程碑事件:
2017年12月,替雷利珠單抗的大型肝癌全球多中心臨床三期研究入組第1例患者街氢。
2018年1月扯键,一項(xiàng)評(píng)估替雷利珠單抗作為晚期不可切除或轉(zhuǎn)移性食道鱗狀細(xì)胞癌(ESCC)患者的潛在二線治療的三期臨床試驗(yàn)實(shí)現(xiàn)了首例患者給藥。
2018年4月珊肃,替雷利珠單抗一項(xiàng)全球二期臨床試驗(yàn)實(shí)現(xiàn)首例患者給藥荣刑。該試驗(yàn)旨在評(píng)估tislelizumab在先前接受過治療的不可切除性肝細(xì)胞癌(HCC)患者中的療效和安全性。
2018年7月伦乔,替雷利珠單抗聯(lián)合化療作為潛在一線治療針對(duì)中國(guó)IIIb期或IV期非鱗狀非小細(xì)胞肺癌(NSCLC)患者的臨床三期試驗(yàn)實(shí)現(xiàn)首例患者給藥厉亏。
2018年9月,替雷利珠單抗的1類新藥上市申請(qǐng)獲CDE受理烈和,受理號(hào)為:CXSS1800019爱只。
王春蘭,藥學(xué)碩士斥杜,畢業(yè)于北京協(xié)和醫(yī)學(xué)院醫(yī)藥生物技術(shù)研究所虱颗,藥物化學(xué)方向。研究生期間共完成兩個(gè)抗腫瘤藥物相關(guān)的課題蔗喂,發(fā)表SCI論文一篇墙滋,綜述一篇。畢業(yè)后曾從事兩年ADC藥物的研發(fā)工作妨屑,目前為藥渡數(shù)據(jù)事業(yè)部成員巍慧,從事藥物數(shù)據(jù)挖掘、分析與數(shù)據(jù)庫(kù)的維護(hù)更新工作浑云。

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 71
71

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 71
71

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 69
69
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽