
 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2018-11-30
2018-11-30
 6164
6164
昨日怨拍,美國FDA宣布,批準Catalyst Pharmaceuticals公司的Firdapse(amifampridine)上市,用于治療成人Lambert-Eaton肌無力綜合征(LEMS)患者汁匪。LEMS是一種罕見的影響神經(jīng)肌肉接頭傳導(dǎo)功能的自身免疫性疾病。這是FDA批準的第一款治療LEMS的療法鹿吴。在批準治療急性骨髓性白血病的Xospata之后终太,F(xiàn)DA同一天內(nèi)再度刷新紀錄,將年度批準的新藥數(shù)目提高到55趣闻。
?
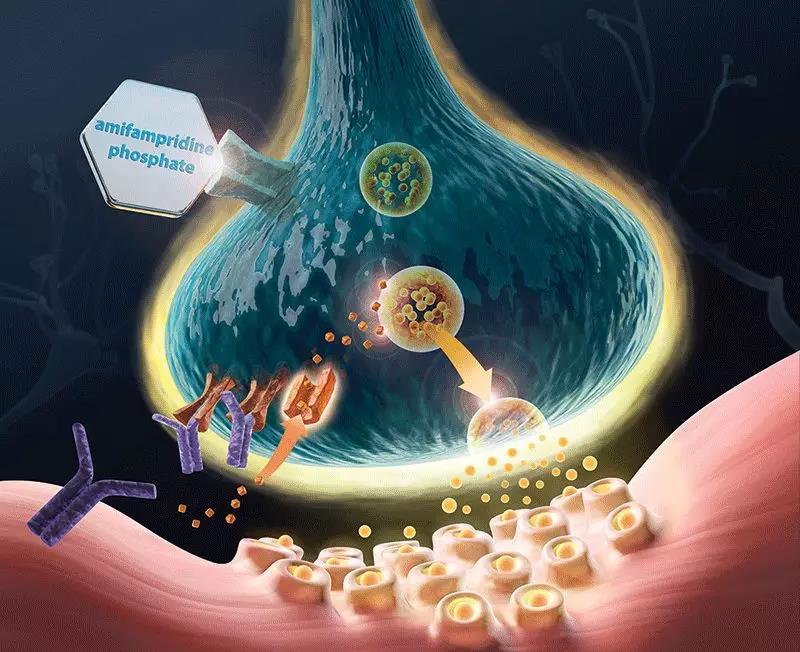
LEMS患者自身的免疫系統(tǒng)會攻擊神經(jīng)肌肉接頭(neuromuscular junction)啰蕴,這會阻礙神經(jīng)細胞將信號傳導(dǎo)給肌肉的能力〈嫜В患者的主要臨床表現(xiàn)為肌無力码承,如果肌無力影響到呼吸肌則可能危及生命。LEMS也可能與其它自身免疫性疾病相關(guān)优生,他們在癌癥患者中更常出現(xiàn)城离,例如小細胞肺癌患者。在癌癥患者中泪确,LEMS可能在癌癥確診時或確診之前發(fā)生娜食。據(jù)估計,目前LEMS的全球發(fā)病率為每100萬人中有3例敞峭。
?
Firdapse是Catalyst公司開發(fā)的口服苫耸、非特異性電壓門控性鉀離子通道阻滯劑。它能夠?qū)е峦挥|前細胞膜的去極化儡陨,從而打開電壓門控性鈣離子通道褪子,觸發(fā)乙酰膽堿(ACh)囊泡的釋放。這能夠增強神經(jīng)肌肉信號傳導(dǎo)骗村,改善肌肉功能嫌褪。Firdapse曾獲得FDA授予的突破性療法認定,孤兒藥資格和優(yōu)先審評資格胚股。
?
?
?
本次批準是基于Firdapse在兩項包含64名成人患者的3期臨床試驗中的表現(xiàn)笼痛。接受Firdapse治療患者的肌肉功能得到了迅速、顯著和持續(xù)的改善琅拌。與安慰劑組相比缨伊,患者肌無力和疲憊癥狀顯著減少。
?
“FDA的這一批準意味著這一罕見嚴重疾病的患者終于等到了一款‘first-in-class’的療法进宝,他們之前的治療選擇非常有限刻坊,”Catalyst公司首席醫(yī)學(xué)官兼監(jiān)管事務(wù)負責(zé)人Gary Ingenito博士說:“我們向參與Firdapse臨床試驗的患者枷恕,他們的家人和醫(yī)護人員致以最高的敬意。我們也感謝從事這項研究的研究人員和臨床試驗人員的不懈努力易祖,他們讓這一里程碑成為可能遵艰。”
?
Catalyst公司預(yù)計將在2019年第一季度將這款新藥帶給患者悍写。

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 64
64

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 64
64

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 62
62