
 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2019-02-11
2019-02-11
 7793
7793
藥時代寄語:
2018年1月坷檩,由張力教授領銜呀邢,中國腫瘤學I期臨床試驗聯(lián)盟對中國大陸2017年腫瘤學領域的I期臨床試驗現(xiàn)狀進行了全面調查纽帖,并撰寫了《中國腫瘤學I期臨床試驗年度報告》瓣颅。該報告的主要內容于2019年2月初發(fā)表在《The Lancet Oncology》上恨闪,張力教授和北京大學腫瘤醫(yī)院的沈琳教授為報告的共同通訊作者肯铣,中山大學腫瘤防治中心趙珅博士域曼、科文斯公司呂承和北京大學腫瘤醫(yī)院龔繼芳副教授為共同第一作者。2019月2月10日粉簇,藥時代轉載推薦了腫瘤資訊的報道文章绎术,【開年大吉】張力教授領銜在《柳葉刀》雜志發(fā)表《中國抗腫瘤藥物研發(fā)的挑戰(zhàn)與改變:腫瘤學I期臨床試驗年度報告》刨吸。
藥時代團隊非常喜歡這篇綜述文章蛀膊,利用假期時間進行了編譯,現(xiàn)在和感興趣的同藥們分享底挫。水平恒傻、時間有限,錯誤難免,歡迎大家批評指正盈厘!
我們對張力教授睁枕、沈琳教授等文章作者表示真誠的敬意和謝意!

中國創(chuàng)新藥物的可及性長期受到所謂的藥品滯后(drug lag)的影響沸手,其中藥物審評過程漫長外遇,本土開發(fā)的創(chuàng)新藥物稀缺,臨床試驗申請的監(jiān)管政策過于嚴格契吉,進口藥品注冊都阻礙了藥物創(chuàng)新跳仿。為解決這一難題,中國政府自2017年起對藥品管理實施了一系列的改革捐晶》朴铮《中國腫瘤學I期臨床試驗年度報告》總結了中國藥物研發(fā)(R&D)的不斷變化的格局。
該報告顯示惑灵,2017年中國大陸進行了180項1期腫瘤學臨床試驗山上,在1期腫瘤學試驗數目方面僅次于歐洲的241項,排名全球第二私舱。然而畦肉,盡管1期臨床研究蓬勃發(fā)展,中國依據缺乏經驗豐富且設備齊全的研究機構帮伙,中國各地開展的研究的地理分布嚴重不平衡航娩。承接這180項1期試驗的機構只有18家(圖A),其中的107項(占比59%)由5個機構完成鹰党,132項(占比73%)集中在北京炫茄、上海或廣州這三個中國最大的城市钓藏。其余的研究也是在中國的主要城市進行状奴。1期研究機構的這種不平衡分布部分反映了中國各地區(qū)醫(yī)療資源的差異。
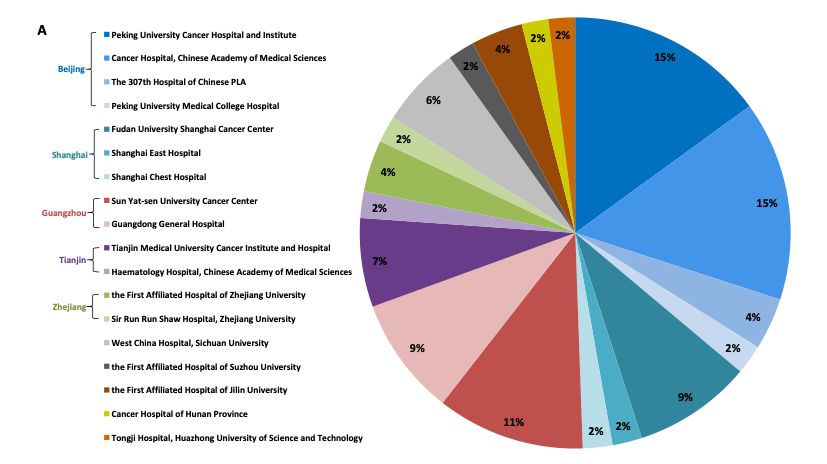
圖A. I期臨床試驗研究機構分布
不同研究機構精臭、申辦方和合同研究組織(CRO)之間的協(xié)作和溝通很難耗憨,也很少。對于多中心2期摇祖、3期研究眷篇,建立一個協(xié)作組織的策略已經被證明頗有成效。例如荔泳,中國胸部腫瘤研究協(xié)作組(the China Thoracic Oncology Group蕉饼,CTONG)成立于2007年,是致力于開展肺癌2期玛歌、3期研究的組織昧港,為OPTMAL試驗和INFORM試驗做出了貢獻擎椰,這兩項多中心隨機3期研究曾分別為晚期EGFR突變陽性非小細胞肺癌患者建立了標準的一線療法和維持療法。然而创肥,之后的十多年达舒,中國沒有類似的針對1期臨床研究的協(xié)作組織。
1期試驗中研究設計的重復是可能影響中國成為藥物創(chuàng)新全球引擎這一進程的另一個問題叹侄。在2017年完成的180項1期試驗中巩搏,21項(占比12%)是仿制藥的生物等效性或生物利用度研究,67項(占比37%)是藥代動力學或藥效動力學研究趾代,76項(43%)研究藥物耐受性塔猾,僅16項( 占比9%)是創(chuàng)新療法的首次人體研究。由跨國生物制藥公司發(fā)起的試驗均為藥代動力學或藥效動力學研究稽坤,旨在表征該藥物對中國人群的藥代動力學和藥效學特征永炭。跨國制藥公司發(fā)起的19項試驗中有9項是藥代動力學或藥效動力學橋接研究土嚼,僅用于加速中國的監(jiān)管審批魏桅。橋接研究是相對小規(guī)模的研究,研究一個藥物的藥代動力學缓缝、藥效學和臨床特性方面的差異钳葬。通過這些研究,國外臨床數據可被用于支持藥品在中國的審批赂品,從而加快注冊過程翩腹。至于患者選擇,中國的大多數1期試驗只是模仿國外的研究誓豺,未能考慮中國人的特征刷裂。例如,盡管中國乙肝病毒(HBV)負擔沉重吏恃,但在針對程序性死亡-1(PD-1)或程序性死亡配體-1(PD-L1)抑制劑的29項研究中米萝,只有一項試驗(CTR20171020)招募HBV檢測結果為陽性的患者。
在腫瘤類型方面代虾,胃癌进肯、肝細胞癌、食管癌和鼻咽癌是中國四種常見的惡性腫瘤棉磨,中國人占這些癌癥的全球發(fā)病率和全球死亡率的至少50%江掩。然而,在針對特定腫瘤類型的116項1期試驗中(圖B)乘瓤,僅有2項試驗(占比2%)針對胃癌环形,5項(占比4%)靶向肝細胞癌,2項(占比2%)靶向胃癌或胃食管癌馅扣, 3項(占比3%)靶向鼻咽癌斟赚。在1期試驗中研究最多的腫瘤類型仍然是肺癌(36項,占比31%)差油、血液系統(tǒng)惡性腫瘤(23項拗军,占比20%)、乳腺癌(n = 18項蓄喇,占比16%)和結直腸癌 (8項发侵,占比7%)。
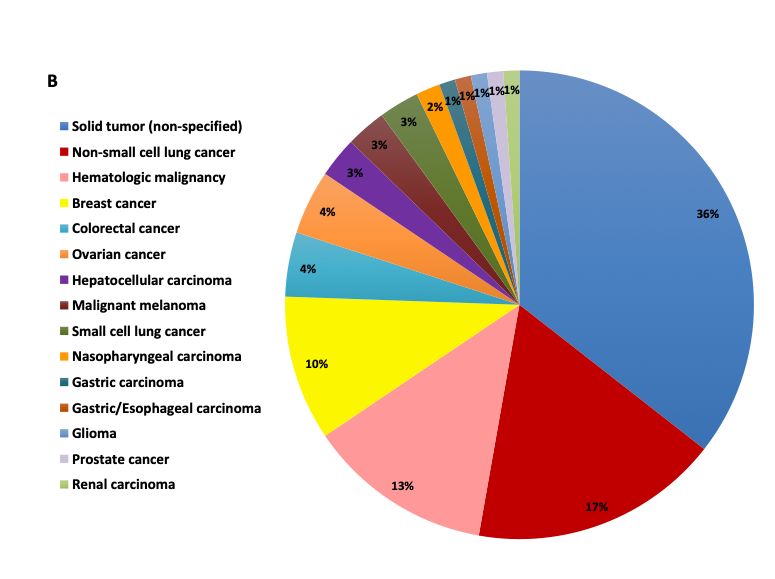
圖B.?I期臨床試驗研究癌種分布
中國1期研究中缺乏新的分子實體也令人擔憂偷真。盡管每年大量的研究性新藥被國家藥品審評中心(CDE)分類為所謂的1類創(chuàng)新藥闲招,大多數是基于現(xiàn)有分子實體進行改構的藥物。在研究小分子靶向藥物的115項臨床試驗中(圖C)熙同,21項(占比18%)針對EGFR通路蒿疲。目前,至少有18個本土開發(fā)的EGFR酪氨酸激酶抑制劑锻刹,所有這些都被歸類為1類創(chuàng)新藥棉玻。然而,它們中只有兩個是全新的分子實體壕矿。同樣坝亿,29項(占比16%)1期研究針對PD-1/PD-L1通路。到目前為止李荚,已有15家中國生物制藥公司在開發(fā)12個PD-1抑制劑和8個PD-L1抑制劑灰囤。鑒于發(fā)現(xiàn)新分子實體的高成本和高風險,大多數中國生物制藥公司鸥层,即使是那些具有研究能力和充足資金的公司锐拟,往往會避開這些風險,而是專注于具有最佳潛力的仿創(chuàng)(follow-on)藥物慧邮。這些策略气忠,雖然可被理解,但從長遠來看可能不會促進創(chuàng)新藥物的研發(fā)赋咽。為了中國擁有真正的創(chuàng)新旧噪,需要在改進和發(fā)明之間劃一條清晰的界限。
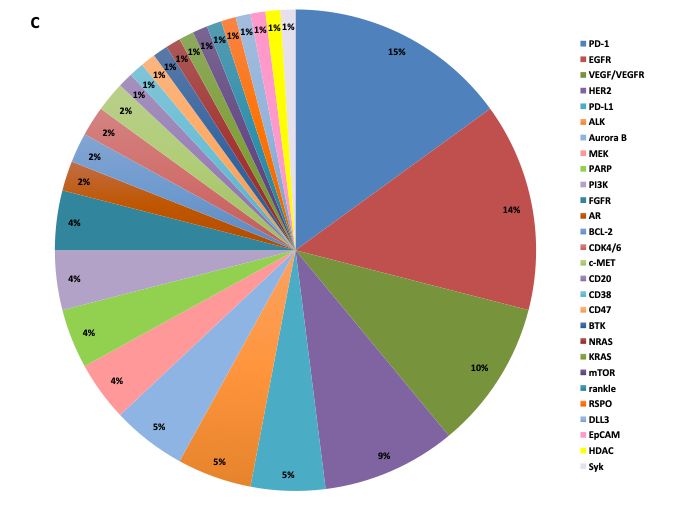
圖C.?I期臨床試驗靶點/生物標記物分布
盡管如此脓匿,2017年中國的抗癌藥物研發(fā)也發(fā)生了幾次令人振奮的變化淘钟。為應對臨床試驗機構不足這一問題,中國食品藥品監(jiān)督管理局(CFDA)計劃取消當時的臨床試驗機構認證制度陪毡。在新的管理體系下米母,醫(yī)療機構可以避免漫長的臨床試驗申請審批過程,只需要在官網站上注冊即可獲得臨床試驗的批準毡琉。為了培養(yǎng)對創(chuàng)新更友好的藥物研發(fā)生態(tài)系統(tǒng)铁瞒,國家藥監(jiān)局將其臨床試驗監(jiān)管政策從嚴入寬出轉變?yōu)?/span>寬入嚴出妙色。目前的政策更多關注試驗的質量控制和上市后藥物警戒,而不是過分強調臨床試驗申請的批準』鬯#現(xiàn)在身辨,臨床試驗數據偽造是可被監(jiān)禁至少3年的重罪。已采用為期60日的研究性新藥申請系統(tǒng)(60天默示許可制)了赖,以放寬對臨床試驗申請的限制√怖現(xiàn)在,如果在申請后60個工作日內藥監(jiān)局未給出負面評價意見笆滓,即可認為這些申請獲得批準槽顶。2018年11月5日,新的系統(tǒng)下獲批用于臨床試驗的第一批藥物在藥監(jiān)局網站上發(fā)布初肥,標志著這一歷史性改革的實施昭淋。
國家藥監(jiān)局為克服藥品滯后所做的另一項舉措是調整2017年10月10日頒布的進口藥品注冊管理的規(guī)定。現(xiàn)在午螺,進口藥品的1期臨床研究可以中外同步射愧,國外臨床試驗數據可以被直接使用以支持在中國的注冊。為了促進藥物創(chuàng)新户虐,已經啟用了更嚴格的創(chuàng)新藥物定義和無燈卓俱、綠燈、紅燈紊荞、黃燈這四燈審評審批策略庶艾,根據藥物的創(chuàng)新程度來確定藥物審評的優(yōu)先順序。在四燈策略中擎勘,無燈藥物(最高優(yōu)先級)是未在世界上任何其它國家上市的創(chuàng)新藥物咱揍;綠燈藥物是其它國家已上市但中國尚未上市的急需藥物;黃光藥物是中國已有上市藥物的仿制藥棚饵;紅燈藥物(不太可能被批準)是面向限制類審批目錄中那些適應癥的藥物煤裙。創(chuàng)新藥的定義已經從中國新藥物(未在中國上市的藥物)縮小到全球新藥物(未在全球任何其它國家上市的藥物)。根據先前的定義噪漾,新分子實體和從現(xiàn)有分子實體修飾而得的藥物都被歸類為創(chuàng)新藥物并且接受相同的待遇硼砰,因此,大多數生物制藥公司傾向于關注后者以降低其藥物研發(fā)過程的風險欣硼。根據新定義题翰,從現(xiàn)有分子實體修改而得的藥物不再被認為具有創(chuàng)新性,不再享受優(yōu)惠待遇诈胜。預計國家藥品審評中心的規(guī)模也將大幅擴大豹障,以加速藥物審評進程。2018年8月29日,CFDA正式更名為國家藥品監(jiān)督管理局(National Medical Products Administration称侣,NMPA)嘹挨。這種變化使得該管理部門不僅可以專注于藥品監(jiān)管,還可以將其管轄范圍擴展到所有生物醫(yī)藥相關產品赁挚,包括計算機軟件逮弛。
為促進研究機構、申辦方和CRO之間的合作聂突,中國腫瘤學I期臨床試驗聯(lián)盟(Chinese Phase 1 Oncology Trial Consortium)于2017年6月成立。通過聯(lián)手中國頂級癌癥中心应攘、主要CRO公司以及國際言刨、國內制藥公司,該聯(lián)盟提供了分享經驗和專業(yè)知識的平臺轧翘。對于針對不太常見的致癌突變的研究焦伸,該聯(lián)盟通過將具有特定突變的患者轉診至相應的臨床機構來提供患者招募方面的幫助。該聯(lián)盟每6個月舉辦一次峰會曙辑,討論當前1期臨床試驗中存在的問題服筋,并與CDE的專家一起探討抗癌藥物研發(fā)的最新進展。
在這種環(huán)境下母债,中國的生物制藥公司已開始將重點從仿制藥轉向創(chuàng)新藥的研發(fā)午磁,使得CDE的研究性新藥申請(IND)的數量翻了三番。2017年毡们,161項(占比89%)的1期研究由中國生物制藥公司發(fā)起迅皇。最近,兩項研究本土研發(fā)的PD-1抑制劑SHR-1210的1期試驗的結果發(fā)表衙熔,這些試驗研究單獨使用SHR-1210或與吉西他濱登颓、順鉑聯(lián)合使用治療鼻咽癌,可能帶來這種惡性腫瘤治療模式的改變红氯。
創(chuàng)新的研究設計和藥物也在不斷涌現(xiàn)框咙。180項1期研究中有49項(占比27%)確定采用基于生物標志物來選擇患者。這一比例高于Schawaederle及其同事在他們的研究中描述的351項研究中的58項(占比17%)痢甘,這項研究調查了生物標記物策略在1期腫瘤學試驗中的作用喇嘱。ML-007是一種EGFR T790M酪氨酸激酶抑制劑,在動物模型中顯示出穿透血腦屏障的潛力塞栅。因此婉称,與其它EGFR T790M酪氨酸激酶抑制劑的1期研究不同,ML007(CTR20180977)的首次人體研究包括未經治療的有腦轉移癥狀的患者构蹬。在免疫腫瘤學領域甩幔,中國也在趕上世界其它國家和地區(qū)。在2017年開始的16項首次人體研究中祠喻,5項研究是關于細胞療法栽乘,4項研究了組合免疫療法芽贫,2項研究了抗體藥物偶聯(lián)物(ADC)。在2018年全球免疫腫瘤學領域的報告中挚粱,中國的三家企業(yè)從全球655個機構中脫穎而出吴爵,進入了的免疫腫瘤學前15名單。
藥時代備注:
這三家中國企業(yè)分別是:深圳市免疫基因治療研究院(Shenzhen Geno-Immune Medical Institute)惊柱,中國人民解放軍總醫(yī)院(China PLA General Hospital)错猬,以及第三軍醫(yī)大學第一附屬醫(yī)院(Third Military Medical University Hospital One)
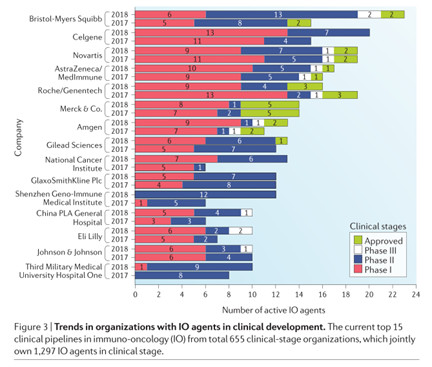
要實現(xiàn)醫(yī)療保健和生物醫(yī)藥創(chuàng)新的目標,中國還有很長的路要走樱凄。中國的創(chuàng)新藥物研發(fā)仍處于發(fā)展階段标炭,但如果我們以創(chuàng)新友好的方式繼續(xù)培育,中國的研發(fā)管線最終必將開花結果戈弧。
參考資料:
Challenges in anticancer drug R&D in China
【開年大吉】張力教授領銜在《柳葉刀》雜志發(fā)表《中國抗腫瘤藥物研發(fā)的挑戰(zhàn)與改變:腫瘤學I期臨床試驗年度報告》
Trends in the global immuno-oncology landscape
時間斑卤、水平有限,錯誤難免潭千,歡迎批評指正谱姓!
圖片取自參考資料原文。版權歸擁有者刨晴。衷心感謝屉来!

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 59
59

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 58
58

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 57
57