
 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2019-10-14
2019-10-14
 4496
4496
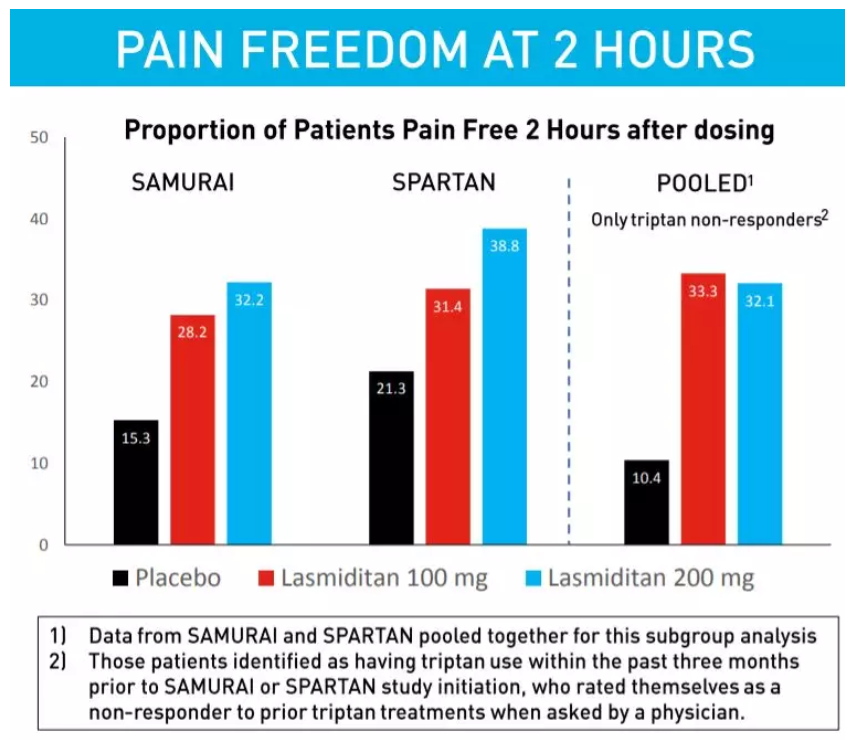
參考資料:
[1] FDA approves new treatment for patients with migraine. Retrieved October 11, 2019, from https://www.prnewswire.com/news-releases/fda-approves-new-treatment-for-patients-with-migraine-300937273.html
[2] Lilly's REYVOW? (lasmiditan), The First and Only Medicine in a New Class of Acute Treatment for Migraine, Receives FDA Approval. Retrieved October 11, 2019, from https://www.prnewswire.com/news-releases/lillys-reyvow-lasmiditan-the-first-and-only-medicine-in-a-new-class-of-acute-treatment-for-migraine-receives-fda-approval-300937322.html
版權(quán)說明:本文來自藥明康德內(nèi)容團隊沐祷,歡迎個人轉(zhuǎn)發(fā)至朋友圈嚷闭,謝絕媒體或機構(gòu)未經(jīng)授權(quán)以任何形式轉(zhuǎn)載至其他平臺。轉(zhuǎn)載授權(quán)請在「藥明康德」微信公眾號回復(fù)“轉(zhuǎn)載”赖临,獲取轉(zhuǎn)載須知胞锰。

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 32
32

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 32
32

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 28
28