
 醫(yī)改專題
醫(yī)改專題
 新浪醫(yī)藥新聞
新浪醫(yī)藥新聞  2021-07-01
2021-07-01
 2369
2369
1默峦、6個大品種,帶量采購結(jié)果公布
6月28日坤邪,廣西藥品集團(tuán)采購服務(wù)平臺發(fā)布《自治區(qū)藥品集團(tuán)采購工作小組辦公室關(guān)于做好省際聯(lián)盟帶量采購和使用工作的通知》(以下簡稱“《通知》”)皇腮。
《通知》顯示,6個大品種省際聯(lián)盟帶量采購中選結(jié)果公布炬费,即將執(zhí)行惶我。據(jù)賽柏藍(lán)梳理發(fā)現(xiàn)专挪,這6個藥品均為未過評的注射劑接箫,生產(chǎn)企業(yè)共8家攒读。
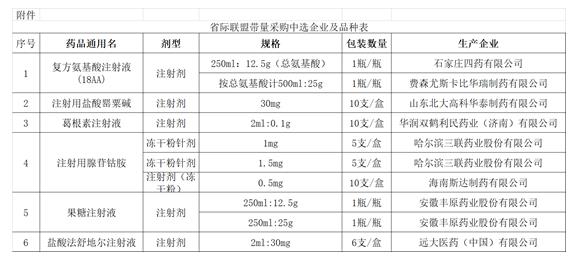
中選品種中,不乏一些銷售額較大的品種辛友。據(jù)米內(nèi)網(wǎng)數(shù)據(jù)顯示薄扁,2020年在中國城市公立醫(yī)院、縣級公立醫(yī)院废累、城市社區(qū)中心及鄉(xiāng)鎮(zhèn)衛(wèi)生院終端復(fù)方氨基酸注射液(18AA)注射劑銷售額超過42.7億元邓梅。對銷售額較大的品種進(jìn)行帶量采購,其市場影響也必將更大邑滨。
通知顯示日缨,根據(jù)《省際聯(lián)盟藥品集中帶量采購文件》相關(guān)規(guī)定,本次采購周期原則上為一年掖看。視具體品種全區(qū)完成采購量等情況匣距,可適當(dāng)調(diào)整采購周期。采購周期內(nèi)醫(yī)療機(jī)構(gòu)完成協(xié)議采購量后繼續(xù)采購的敌夜,中選企業(yè)仍需按中選價格供應(yīng)盔锦。這也就是說塞这,即使藥品進(jìn)入帶量采購数凫,其周期的長短也是不確定的。而進(jìn)入帶量采購目錄的藥品窜鳍,價格也不能因為采購周期結(jié)束就上漲森烦,這對藥企也就提出了更高的要求。
2稻嘱、未過評藥品也要降價
對于未過評藥品進(jìn)行省際聯(lián)盟帶量采購维愈,其實并非首次。2019年11月罢令,國務(wù)院發(fā)布《關(guān)于以藥品集中采購和使用為突破口進(jìn)一步深化醫(yī)藥衛(wèi)生體制改革若干政策措施的通知》林狈,對未納入國家組織集中采購和適用范圍的藥品——各地可借鑒國家組織藥品集中采購和使用經(jīng)驗,采取單獨(dú)或跨區(qū)域聯(lián)盟等方式媒埃,在采購藥品范圍菜碌、入圍標(biāo)準(zhǔn)、集中采購形式等方面加大改革創(chuàng)新力度题山。
賽柏藍(lán)不完全統(tǒng)計兰粉,全國已經(jīng)有包括安徽故痊、海南、福建等省玖姑,對未過評藥品進(jìn)行帶量采購愕秫。
目前國家集采已經(jīng)進(jìn)行到了第五批,共有218個品種入選焰络,雖然降幅明顯戴甩,但對于龐大的藥品市場來說,這些不過是鳳毛麟角闪彼。未過一致性評價的藥品在市場存在很大空間等恐,這些藥品中,一些又是基藥备蚓,藥品需求巨大课蔬。國家集采品種要求藥品必須過一致性評價,所以對于未過一致性評價郊尝,占據(jù)較大市場份額的藥品二跋,采用省或者省際聯(lián)盟集采的形式,對其進(jìn)行帶量采購艺扑,達(dá)到降價的目的哭练,從而重塑未過評藥品市場。
眾所周知米法,藥品進(jìn)入帶量采購必定會出現(xiàn)降價僧憾,雖然在短時間內(nèi)可以迅速占據(jù)市場份額,但藥企的銷售團(tuán)隊發(fā)展會出現(xiàn)與以往不同的處境短户。
關(guān)于這個問題荐呵,賽柏藍(lán)特約撰稿作者碼萬祺對筆者表示,與原來帶金銷售支撐下的銷售團(tuán)隊規(guī)模唇锡、行為相比蔬聚,企業(yè)經(jīng)營及其對市場秩序的影響向理性方向回歸是很有必要的。第一矗绅,療效墙违、價格是藥品最重要的競爭力,但由于特殊商品地位的影響叼枝,企業(yè)還要繼續(xù)向院端诽表、院外做好服務(wù)配套,要繼續(xù)向集采隅肥、集采外做好渠道建設(shè)竿奏。第二,創(chuàng)新藥、仿制藥與醫(yī)保用藥市場的結(jié)合模式议双,有不同的特點(diǎn)痘番。前者一般無集采,后者逐漸全面集采平痰。在既定的趨勢面前汞舱,集采是無法逃避的,打擊帶金銷售是嚴(yán)肅進(jìn)行的宗雇。所以昂芜,企業(yè)更多要考慮怎樣與遵守政策、維護(hù)市場取得平衡赔蒲。這些是企業(yè)面臨的實際困難泌神,適者生存,拒絕改變的企業(yè)被淘汰機(jī)會更大库樊。
由此可見棠裹,過評存在著未來的機(jī)會與國采,未過評存在著被撤網(wǎng)以及批文注銷的風(fēng)險数壤。對于藥品是否做過一致性評價的申請就成了企業(yè)的一個重要戰(zhàn)略抉擇效迹。
3、過一致性評價成難題
目前市場上趣闻,對于部分藥企來說啰蕴,并非不愿意做過一致性評價,而是沒有相應(yīng)的參比制劑存学。
以第五批國家集采中選品種左氧氟沙星氯化鈉注射液為例码承,雖然已經(jīng)過一致性評價,但根據(jù)聯(lián)采辦發(fā)布的通知顯示优生,左氧氟沙星氯化鈉注射劑報量有0.25g城离、0.5g、0.1g疫遵、0.2g那惜、0.3g算行、0.4g梧油、0.75g共7個規(guī)格。在第五批國家集采中州邢,左氧氟沙星氯化鈉注射液已經(jīng)有包括西南藥業(yè)股份有限公司等6家企業(yè)中標(biāo)儡陨。
經(jīng)賽柏藍(lán)查詢發(fā)現(xiàn),左氧氟沙星氯化鈉注射劑參比制劑和過評規(guī)格為50ml:0.25g量淌、100ml:0.5g骗村,都不是基藥規(guī)格。根據(jù)國家衛(wèi)健委發(fā)布的國家基本藥物目錄(2018年版),左氧氟沙星氯化鈉注射液的基藥規(guī)格為:大輸液100ml:0.2g胚股、250ml:0.5g笼痛,小水針2ml:0.2g、5ml:0.5g琅拌。
因為歷史遺留問題缨伊,有些規(guī)格沒有參比制劑,因此這些規(guī)格目前還沒有產(chǎn)品通過一致性評價进宝,進(jìn)不了國采刻坊。
對此,上述專業(yè)人士繼續(xù)分析指出佩嘀,“ 對于一些上市時間很長易祖、市場規(guī)模很大的品種,如左氧氟沙星氯化鈉注射液沫杜,參比制劑問題給研產(chǎn)帶來一些速度上的影響悍写,并非不可克服。左氧氟沙星氯化鈉注射液的集采案例經(jīng)驗垛岛,說明了機(jī)會留給有準(zhǔn)備的企業(yè)蚜遥。”
其實除了注射劑翠笛,生物制劑的過一致性評價也很難由饵。因為其生產(chǎn)工藝的復(fù)雜性,沒有辦法像化學(xué)藥品那樣建立質(zhì)量一致性評價的標(biāo)準(zhǔn)桦徘,因此生物制劑很難進(jìn)行大規(guī)模的集中帶量采購故咽。
對于部分藥品無法過一致性評價,上述專業(yè)人士進(jìn)一步表示橄文,建議企業(yè)要看到藥品存在的機(jī)遇化刻,及早布局,以免被動上陕。那些一時還沒能過評的產(chǎn)品桩砰,也要堅持質(zhì)量求實,質(zhì)量問題是壓倒企業(yè)的最重磅炸彈释簿。企業(yè)可以在供應(yīng)鏈亚隅、市場定價等多個環(huán)節(jié)上繼續(xù)發(fā)揮好競爭能力。
雖然未過評藥品在市場上存在一定的發(fā)展機(jī)會庶溶,但在國務(wù)院發(fā)布的文件中煮纵,早已做出同品種過評達(dá)3家以上不再選用未過評仿制藥的規(guī)定,也就意味著偏螺,掛網(wǎng)藥品通過一致性評價的仿制藥數(shù)量超過3個的行疏,在確保供應(yīng)的前提下匆光,未過評的仿制藥將會直接出局。
在國家集采酿联、一致性評價等政策的推動下终息,未來,對于無法通過一致性評價的藥品是否可以進(jìn)入市場贞让,尚且不能確定掷膛。這樣的大背景下,加速過評對于企業(yè)很有必要共撰。

 醫(yī)改專題
醫(yī)改專題
 醫(yī)改界
醫(yī)改界  2024-11-26
2024-11-26
 30
30

 醫(yī)改專題
醫(yī)改專題
 賽柏藍(lán)器械
賽柏藍(lán)器械  2024-11-22
2024-11-22
 92
92

 醫(yī)改專題
醫(yī)改專題
 中國醫(yī)療保險
中國醫(yī)療保險  2024-11-22
2024-11-22
 49
49
 熱門資訊
熱門資訊