
 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2021-12-06
2021-12-06
 2184
2184
2021年11月30日肪躯,Atara Biotherapeutics公司宣布钝侠,歐洲藥品管理局(EMA)已經(jīng)接受了T細(xì)胞免疫療法tabelecleucel(tab-cel)的上市許可申請(qǐng)(MAA)佣蓉,用于治療EB病毒(EBV)相關(guān)的移植后淋巴增殖性疾病(EBV+PTLD)垒棋。新聞稿指出卒煞,這是全球首款接受監(jiān)管機(jī)構(gòu)審評(píng)的即用型同種異體T細(xì)胞療法。

EBV+PTLD是淋巴瘤的一種類(lèi)型叼架,是一種嚴(yán)重的血液癌癥畔裕,可能在實(shí)體器官移植(SOT)或同種異體造血細(xì)胞移植(HCT)后發(fā)生。一線治療失敗的HCT后EBV+PTLD患者的中位總生存期為16-56天乖订,而SOT后高危EBV+PTLD患者的1年和2年生存率分別為36%和0%扮饶。
Tab-cel是一款即用型同種異體T細(xì)胞免疫療法。該療法除了針對(duì)利妥昔單抗治療失敗的移植后EBV+PTLD患者乍构,還計(jì)劃用于治療包括鼻咽癌在內(nèi)的其他EBV相關(guān)血液癌癥和實(shí)體瘤惜肃。2015年2月,美國(guó)FDA授予tab-cel用于治療HCT后EBV+PTLD的突破性療法認(rèn)定仓近。
本次申請(qǐng)基于一項(xiàng)正在進(jìn)行的3期臨床試驗(yàn)獲得的積極數(shù)據(jù)盲狈,截至2021年5月,38例可評(píng)估患者(24例SOT后肌蛮,14例HCT后)觀察到的平均ORR為50%(19/38螺矮,95% CI:33.4,66.6)忍猛,包括完全緩解(CR畅型;n=5,SOT掐股;n=5乘澈,HCT)和部分緩解(PR笤敞;n=7,SOT尝鬓;n=2瞻绝,HCT)。在19例獲得緩解的患者中秸讹,11例緩解持續(xù)時(shí)間(DOR)超過(guò)6個(gè)月胁后,中位DOR尚未達(dá)到。安全性方面與之前發(fā)表的數(shù)據(jù)一致嗦枢,未報(bào)告新的信號(hào)或問(wèn)題。未發(fā)生移植物抗宿主餐投稀(GvHD)文虏、器官排斥、輸注反應(yīng)或與tab-cel相關(guān)的細(xì)胞因子釋放綜合征等不良反應(yīng)殖演。
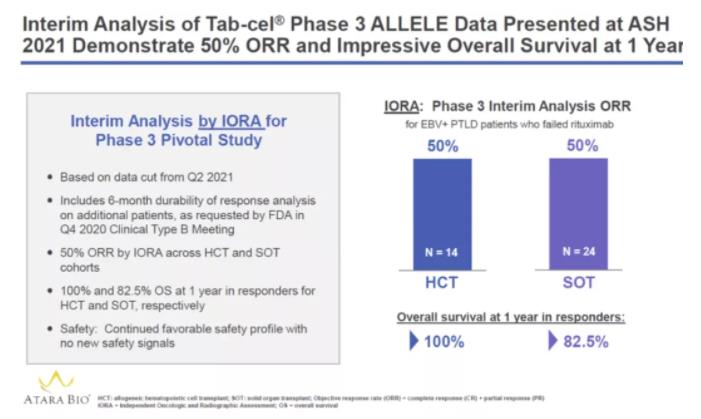
▲Tab-cel的3期臨床試驗(yàn)結(jié)果(圖片來(lái)源:Atara Biotherapeutics公司官網(wǎng))
Atara執(zhí)行副總裁兼全球研發(fā)負(fù)責(zé)人Jakob Dupont博士表示:“EBV+PTLD是一種罕見(jiàn)的侵襲性癌癥氧秘,患者在治療失敗后僅有數(shù)周至數(shù)月的生存期,沒(méi)有獲批的治療選擇趴久。Tab-cel是首個(gè)由監(jiān)管機(jī)構(gòu)審評(píng)的即用型同種異體T細(xì)胞療法丸相,我們期待著與EMA合作,繼續(xù)評(píng)估tab-cel的變革潛力彼棍∶鹬遥”
英文原文鏈接:https://www.businesswire.com/news/home/20211130005204/en

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 299
299

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 274
274

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時(shí)間
醫(yī)藥時(shí)間  2024-11-18
2024-11-18
 61
61
 熱門(mén)資訊
熱門(mén)資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽