
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2022-03-07
2022-03-07
 2770
2770
2月28日瞻讽,傳奇生物靶向B細(xì)胞成熟抗原(BCMA)的CAR-T療法西達(dá)基奧侖賽(cilta-cel)的生物制品許可申請(qǐng)(BLA)正式獲FDA批準(zhǔn)防偿,用于治療復(fù)發(fā)/難治性多發(fā)性骨髓瘤(r/r MM)患者掰腌。這是首款獲得FDA批準(zhǔn)的國(guó)產(chǎn)CAR-T細(xì)胞療法。這款藥物的獲批也是繼百濟(jì)神州澤布替尼之后中國(guó)創(chuàng)新藥國(guó)際化取得的新里程碑和新突破敦间。
多發(fā)性骨髓瘤(MM)是骨髓中漿細(xì)胞惡性增殖引起相關(guān)器官或組織損傷的一種血液系統(tǒng)惡性腫瘤瓶逃,在很多國(guó)家是血液系統(tǒng)第2大常見(jiàn)惡性腫瘤,多發(fā)于老年廓块。盡管近些年在治療上取得了進(jìn)步厢绝,但MM仍然是一種以緩解和復(fù)發(fā)為特征的不治之癥。大多數(shù)患者在初始治療后復(fù)發(fā)带猴,治療產(chǎn)生應(yīng)答的程度昔汉、持續(xù)時(shí)間以及生存結(jié)果隨著每次連續(xù)治療而降低。暴露于免疫調(diào)節(jié)劑拴清,蛋白酶體抑制劑和抗CD38抗體三種主要藥物類別的復(fù)發(fā)性或難治性MM患者臨床預(yù)后較差挤庇,應(yīng)答率僅為20%-30%,應(yīng)答時(shí)間僅有2-4個(gè)月贷掖,生存率非常低。 B細(xì)胞成熟抗原(BCMA)是一種跨膜糖蛋白渴语,屬于腫瘤壞死因子(TNF)受體超家族苹威,又被稱為T(mén)NFRSF17或CD269。BCMA在漿細(xì)胞上自然表達(dá)驾凶,但是在惡性漿細(xì)胞上持續(xù)高水平表達(dá)阿魏,同時(shí)它在正常組織中的表達(dá)非常有限。由于BCMA在漿細(xì)胞分化過(guò)程中被選擇性誘導(dǎo)氛灸,因此在幼稚和記憶B細(xì)胞中幾乎不存在耘泰。這一特性使它成為多發(fā)性骨髓瘤良好的診斷標(biāo)志物和治療靶點(diǎn)。
Cilta-cel由金斯瑞旗下子公司傳奇生物自主研發(fā)剑碌,是一種結(jié)構(gòu)差異化的CAR-T細(xì)胞療法嘀醋,包含一個(gè)4-1BB共刺激結(jié)構(gòu)域和兩個(gè)旨在提高親和性的BCMA靶向單域抗體。
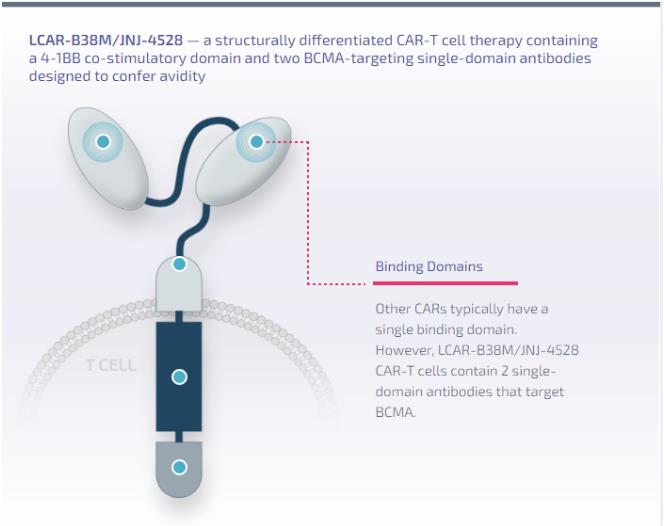
Cilta-cel結(jié)構(gòu)(來(lái)源:傳奇生物官網(wǎng))
該款藥物已經(jīng)先后獲得了FDA授予的突破性療法認(rèn)定孟溯、優(yōu)先審評(píng)資格讲侵,EMA授予的優(yōu)先藥物資格,同時(shí)也是中國(guó)首個(gè)獲得突破性療法資格的藥物。
2017年12月耸壮,楊森(強(qiáng)生旗下公司)與傳奇生物達(dá)成一項(xiàng)許可協(xié)議粤街,兩家公司將在全球共同開(kāi)發(fā)和推廣cilta-cel。根據(jù)協(xié)議笑驶,傳奇生物獲得了3.5億美元的預(yù)付款职颜,并有權(quán)在開(kāi)發(fā)、生產(chǎn)嫌变、監(jiān)管和銷售方面達(dá)到里程碑進(jìn)展時(shí)獲得額外付款吨艇。在除大中華區(qū)以外的全球市場(chǎng)中,傳奇生物和楊森公司的成本和利潤(rùn)分?jǐn)偙壤秊?0/50初澎,在大中華區(qū)該分?jǐn)偙壤秊?0/30(傳奇生物/楊森公司)秸应。
今年2月11日,傳奇生物宣布碑宴,與楊森簽訂的關(guān)于Cilta-cel的合作協(xié)議已達(dá)成兩項(xiàng)里程碑付款软啼,金額高達(dá)5,000萬(wàn)美元。包括上述付款在內(nèi)延柠,傳奇生物于合作期間已達(dá)成合計(jì)2.5億美元里程碑付款祸挪。
FDA此次批準(zhǔn)是基于一項(xiàng)關(guān)鍵性Ib/II期CARTITUDE-1研究結(jié)果,該研究評(píng)估了cilta-cel在復(fù)發(fā)/難治性多發(fā)性骨髓瘤患者中的療效和安全性贞间。招募的97例受試者中贿条,99%接受末線治療無(wú)效,其中88%既往接受過(guò)包括免疫調(diào)節(jié)劑增热、蛋白酶體抑制劑整以、抗CD-38抗體至少3線治療后無(wú)應(yīng)答。 研究結(jié)果顯示嗤矾,中位隨訪12.4個(gè)月時(shí)勒蜘,獨(dú)立委員審查的客觀緩解率(ORR)為97%,包括67%的sCR(嚴(yán)格的完全緩解)拒牡,92.8%的患者獲得了非常好的部分緩解(VGPR)及以上炊惊。≥3級(jí)細(xì)胞因子綜合征(CRS)發(fā)生率為4%随去,≥3級(jí)神經(jīng)毒性發(fā)生率為9%亮钩。
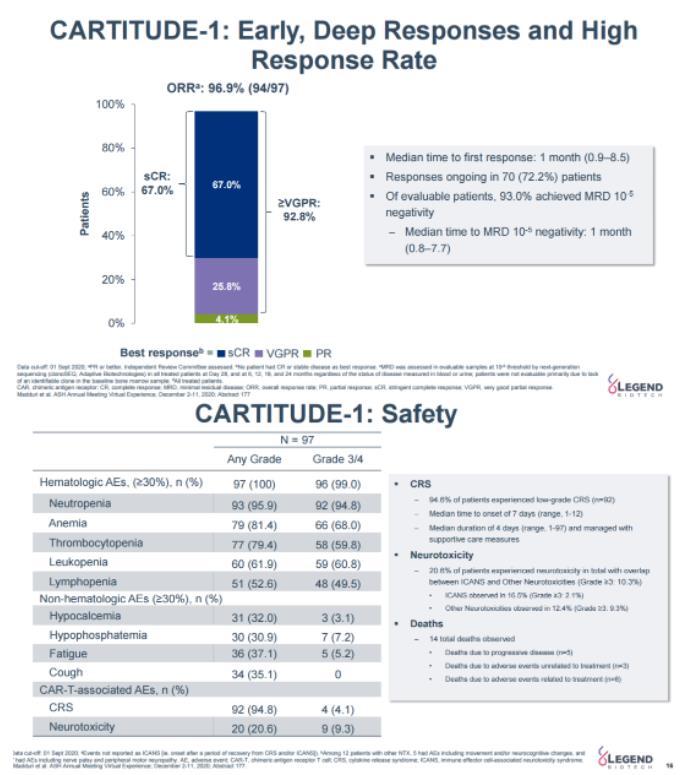
CARTITUDE-1研究12.4個(gè)月隨訪數(shù)據(jù)(傳奇生物官網(wǎng))
2021年第63屆美國(guó)血液學(xué)會(huì)(ASH)年上公布的21.7個(gè)月隨訪最新數(shù)據(jù)顯示,83%的患者達(dá)到了sCR扔泵,95%的患者獲得了VGPR及以上巢驶。PFS和OS尚未達(dá)到,2年P(guān)FS為61%(95%CI荡担,48.5-70.4)品客,2年OS為74%(95%CI榴弧,61.9-82.7)。
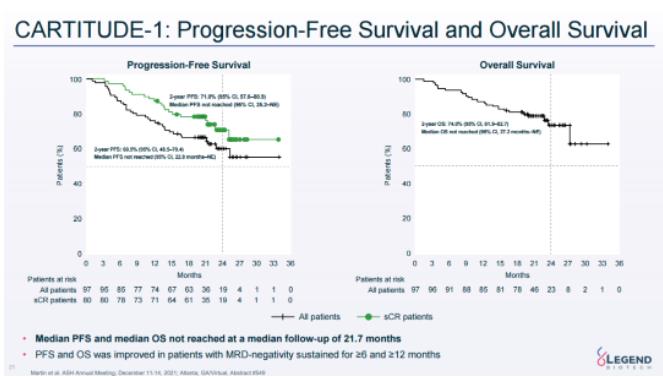
CARTITUDE-1研究21.7個(gè)月隨訪數(shù)據(jù)(來(lái)源:傳奇生物官網(wǎng))
傳奇生物還在ASH年會(huì)上公布一項(xiàng)正在進(jìn)行的II期多隊(duì)列CARTITUDE-2研究粟翔。A隊(duì)列包括了既往接受過(guò)1–3線治療后疾病進(jìn)展的MM患者桅狠,這些患者對(duì)來(lái)那度胺耐藥,并且之前沒(méi)有接觸過(guò)靶向BCMA的藥物轿秧。B隊(duì)列包括初始治療(包含蛋白酶體抑制劑和免疫調(diào)節(jié)劑)后早期復(fù)發(fā)的患者中跌,主要目標(biāo)為微小殘留病 (MRD)陰性患者的比例。
A隊(duì)列共納入20名患者菇篡,最新數(shù)據(jù)顯示漩符,在更長(zhǎng)的14.3個(gè)月中位隨訪中,ORR達(dá)95%驱还,其中85%的患者達(dá)到CR及以上嗜暴,90%的患者達(dá)到VGPR及以上。6個(gè)月和12個(gè)月的PFS率分別為95%和84%议蟆,在13名MRD可評(píng)估患者中闷沥,92%呈現(xiàn)10-5MRD陰性。
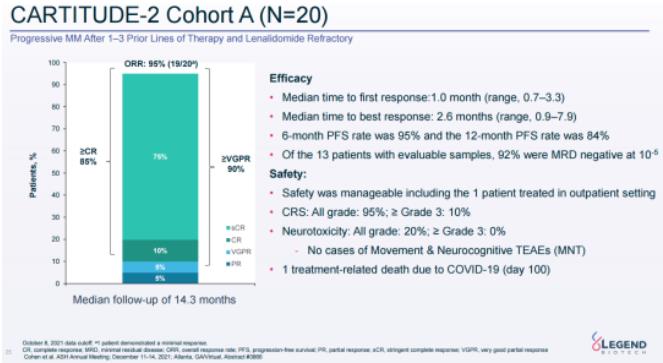
CARTITUDE-2試驗(yàn)隊(duì)列A最新數(shù)據(jù)(來(lái)源:傳奇生物官網(wǎng))
B隊(duì)列共納入19名患者咐容,在10.6個(gè)月的中位隨訪中舆逃,ORR達(dá)95%,其中79%的患者達(dá)到CR及以上戳粒,90%達(dá)到VGPR及以上路狮。6個(gè)月和12個(gè)月的PFS率分別為90%和84%。在13名MRD可評(píng)估的患者中恼芙,92%呈現(xiàn)10-5MRD陰性结晒。
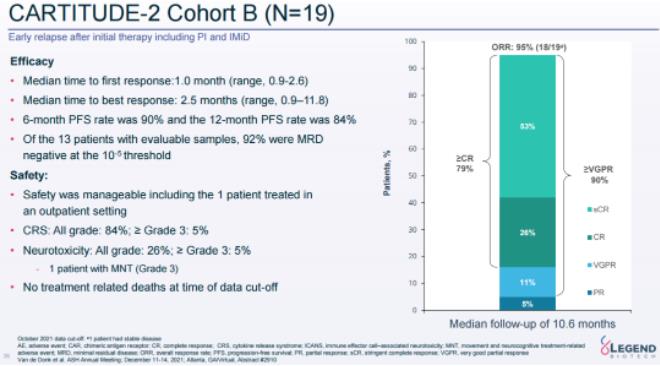
CARTITUDE-2試驗(yàn)隊(duì)列B最新數(shù)據(jù)(來(lái)源:傳奇生物官網(wǎng))
A隊(duì)列和B隊(duì)列的安全性與之前CARTITUDE-1報(bào)告的數(shù)據(jù)一致。隊(duì)列A中95%的患者發(fā)生細(xì)胞因子釋放綜合征(CRS)龟冻,B隊(duì)列中84%的患者發(fā)生細(xì)胞因子釋放綜合征(CRS)汤史,主要為1/2級(jí),中位發(fā)病時(shí)間為7-8天卒粮,中位持續(xù)時(shí)間約4天。
此外骨惫,傳奇生物還計(jì)劃開(kāi)展全球钱挺、隨機(jī)、注冊(cè)性III期CARTITUDE-4和CARTITUDE-5研究蜀勃,前者用于評(píng)估cilta-cel vs DPd或PVd在接受過(guò)1~3線既往治療且來(lái)那度胺難治性r/r MM患者中的療效辣沧,后者將用于評(píng)估VRd之后使用cilta-cel 維持治療vs VRd繼以Rd維持治療在新診斷的、不計(jì)劃將ASCT(自體造血干細(xì)胞移植)作為初始治療的MM患者中的療效驼鳞。
除了西達(dá)基奧侖賽哀铡,傳奇生物管線中還有8款進(jìn)入臨床的CAR-T細(xì)胞療法產(chǎn)品,包括LB1901(CD4) ?、LB1902(MSLN)抒痒、LB1904( Claudin 18.2)幌绍、LB1905(CD20)、LB1908(Claudin 18.2)LB1909(CD19xCD22)故响、LB1910(CD33xCLL-1 )以及抗-CD123 CAR-T傀广,其中LB1902、LB1904和LB1908正探索在實(shí)體瘤中的療效彩届。
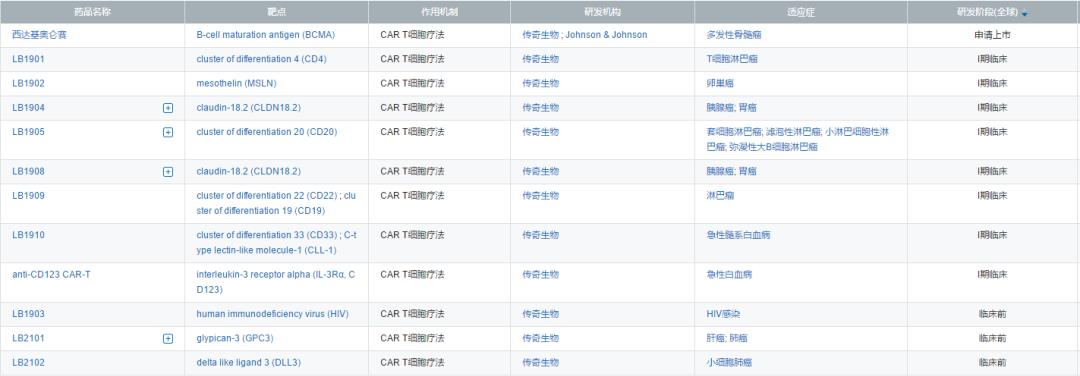
傳奇生物在研管線(來(lái)源:醫(yī)藥魔方NextPharma)
全球范圍內(nèi)伪冰,BMS和Bluebird聯(lián)合開(kāi)發(fā)的Abecma(idecabtagene vicleucel , bb2121)于2021年3月獲FDA批準(zhǔn)用于既往接受過(guò)4線及以上療法的r/r MM成人患者,是全球首個(gè)獲批上市的靶向BCMA的CAR-T療法樟蠕。 Abecma定價(jià)為41.95萬(wàn)美元贮聂,行業(yè)內(nèi)預(yù)計(jì)其銷售峰值為6.29億美元。這一預(yù)估基于Abercma作為治療MM的5線療法寨辩,適用人群十分有限吓懈。也為強(qiáng)生/傳奇生物的BCMA CAR-T療法留下較大的空間,即通過(guò)更前線的適應(yīng)癥搶占BCMA CAR-T市場(chǎng)捣染。
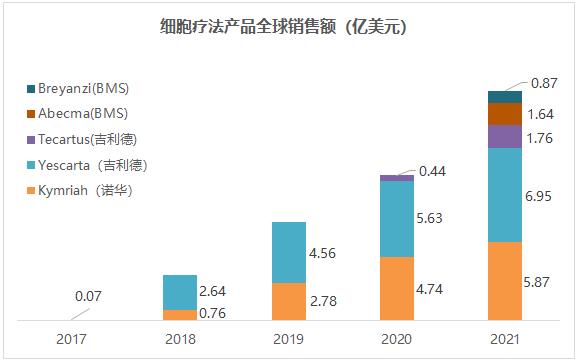
全球上市CAR-T銷售額(來(lái)源:各公司財(cái)報(bào))

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 291
291

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 268
268

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時(shí)間
醫(yī)藥時(shí)間  2024-11-18
2024-11-18
 59
59
 熱門(mén)資訊
熱門(mén)資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽