
 研發(fā)追蹤
研發(fā)追蹤
 Insight數(shù)據(jù)庫
Insight數(shù)據(jù)庫  2022-04-29
2022-04-29
 2192
2192
4 月 27 日,阿斯利康和第一三共共同宣布 HER2 ADC 藥物 Enhertu 已獲得 FDA 突破性療法認(rèn)定(BTD)谊迄,用于既往接受過至少一種全身治療后在輔助治療六個(gè)月內(nèi)復(fù)發(fā)或進(jìn)展的 HER2 低表達(dá)(IHC 1+ or IHC 2+/ISH-陰性)不可切除或轉(zhuǎn)移性乳腺癌患者闷供。
這是 Enhertu 在乳腺癌中的第三個(gè) BTD。Enhertu 此前曾在 2021 年和 2017 年獲得針對(duì)二線 HER2 陽性轉(zhuǎn)移性乳腺癌和后線 HER2 陽性轉(zhuǎn)移性乳腺癌的突破性療法認(rèn)定鳞上。
來自:阿斯利康官網(wǎng)
DESTINY-Breast04 是一項(xiàng)隨機(jī)这吻、開放標(biāo)簽、全球多中心注冊(cè) III 期臨床篙议,評(píng)估 Enhertu(5.4 mg/kg)與醫(yī)生選擇的化療(卡培他濱唾糯、艾日布林、吉西他濱鬼贱、紫杉醇或白蛋白紫杉醇)在 HR 陽性 (n=480) 或 HR 陰性 (n=60) 的 HER2 低表達(dá)不可切除和/或轉(zhuǎn)移性乳腺癌患者中的療效和安全性移怯,這些患者之前接受過一種或兩種化療方案≌饽眩患者按 2:1 隨機(jī)分組舟误,分別接受 Enhertu 或化療。主要終點(diǎn)為 BICR 評(píng)估的 HR 陽性患者的 PFS躲窜,關(guān)鍵次要終點(diǎn)包括 BICR 評(píng)估的所有患者 PFS沃羽、HR 陽性患者及所有患者的 OS。
結(jié)果顯示咧笔,DESTINY-Breast04 達(dá)到了其主要終點(diǎn)鉴膝,與 SOC 相比,Enhertu 在既往經(jīng)治的 HR 陽性 HER2 低表達(dá)轉(zhuǎn)移性乳腺癌患者中表現(xiàn)出更優(yōu)的 PFS垂票。同時(shí)李晾,該試驗(yàn)也達(dá)到了所有關(guān)鍵次要終點(diǎn),無論 HR 表達(dá)狀態(tài)如何育需,均顯著提高了患者 PFS 和 OS恕且。安全性方面與既往臨床試驗(yàn)一致,未發(fā)現(xiàn)新的安全信號(hào)阎揪。
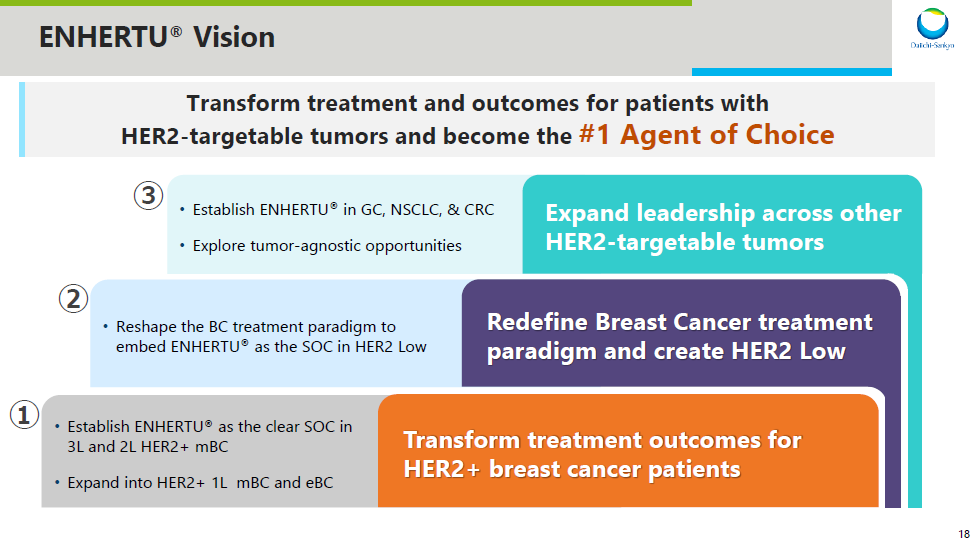
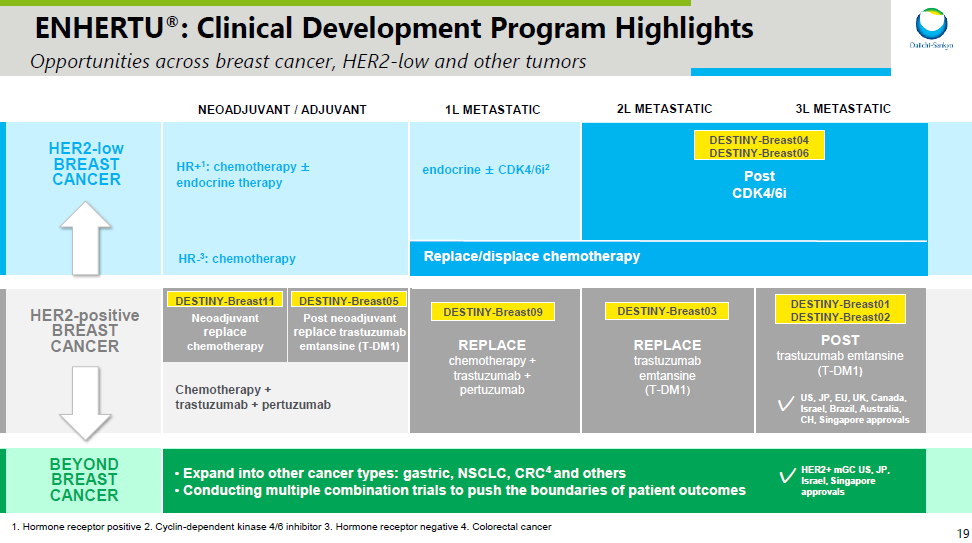
DESTINY-Breast04 研究的突破吩欣,有望助推阿斯利康和第一三共利用領(lǐng)先 ADC 藥物覆蓋乳腺癌治療的全領(lǐng)域,包括在不同 HER2 表達(dá)狀態(tài)和不同 HR 表達(dá)狀態(tài)中的探索海庆。同時(shí)在廣覆蓋之余仑萧,第一三共和阿斯利康還在推進(jìn)這些療法向更前線開發(fā)(詳見下圖)。在乳腺癌之后枷遂,還將探索 Enhertu 在胃癌(GC)、非小細(xì)胞肺癌(NSCLC)、結(jié)直腸癌(CRC)中的療效(PPT 資料來自第一三共酒唉,可在公眾號(hào)中回復(fù)「第一三共 2021」下載)矩桂。
Enhertu(HER2)乳腺癌開發(fā)計(jì)劃

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 289
289

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 265
265

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時(shí)間
醫(yī)藥時(shí)間  2024-11-18
2024-11-18
 59
59
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽