
 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2022-05-30
2022-05-30
 2843
2843
今日氓仲,Dermavant Sciences公司宣布,美國FDA已批準Vtama(1% tapinarof湿颅,每日一次)乳膏上市,用于外用治療斑塊狀銀屑病成人患者渠余。新聞稿指出斟策,這一批準包括所有銀屑病患者,不論嚴重程度如何采散,并且標簽上沒有使用持續(xù)時間和使用身體部位的限制胡傅。這是美國25年來獲批治療銀屑病的首款外用新分子實體,代表了一種非類固醇的創(chuàng)新外用治療類型猩琳。值得一提的是母烘,這款創(chuàng)新療法在2019年首先在中國獲批上市,名為本維莫德(benvitimod)乳膏侈兄。
銀屑病又名牛皮癬惨侵,是一種常見的慢性,自身免疫性炎癥性皮膚病饺斧。全世界約有1.25億銀屑病患者二谤,中國患者人數(shù)約800萬。對于癥狀較嚴重的患者來說读囤,銀屑病對他們的生活質量造成重大影響继射。目前銀屑病首選外用治療方案大多為糖皮質激素和維生素D衍生物,糖皮質激素雖然見效快挎袜,但停藥后病情容易反復顽聂,并且長期使用有安全性風險,因此通常不能持續(xù)使用盯仪。
Tapinarof是一種“first-in-class”的芳香烴受體調節(jié)劑紊搪。它是一種從土壤線蟲的共生細菌代謝產物中分離出的天然化合物蜜葱。最初由Welichem Biotech公司進行開發(fā)。此后耀石,這款藥物大中華區(qū)以外的研發(fā)權益幾經轉手牵囤,在2018年由Dermavant獲得。Tapinarof作為一種非激素類小分子藥物滞伟,分子量只有254 Da揭鳞,具有良好的皮膚滲透性。
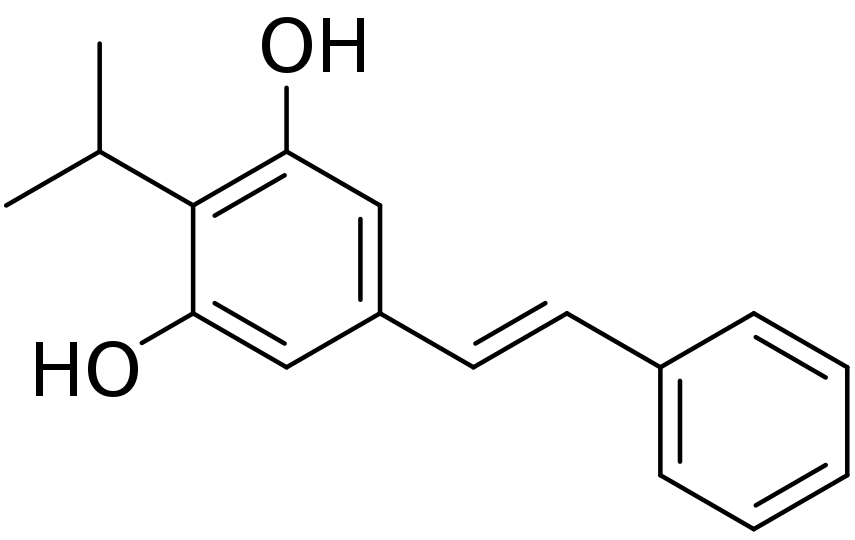
▲Tapinarof的分子結構式(圖片來源:Edgar181, Public domain, via Wikimedia Commons)
芳香烴受體在調節(jié)自身免疫反應方面具有重要的作用梆奈。Tapinarof通過調節(jié)芳香烴受體的功能野崇,能夠抑制IL-17介導的炎癥反應。IL-17信號通路可以說是治療銀屑病的“明星通路”亩钟,靶向IL-17的銀屑病療法包括諾華(Novartis)公司開發(fā)的Cosentyx(可善挺)乓梨,優(yōu)時比(UCB)公司開發(fā)的Bimzelx,以及禮來公司開發(fā)的Taltz林慷。
在兩項關鍵性3期臨床試驗中浓蜈,tapinarof達到所有的主要和次要終點,名為PSOARING 1的臨床試驗中否胸,36%接受tapinarof治療的患者達到皮膚癥狀清除或接近清除的標準阔踢,對照組這一數(shù)值為6%。在另一項3期臨床試驗中沫十,這兩個數(shù)值分別為40%和6%(p<0.0001)。
在長期擴展研究中宵绒,獲得皮膚癥狀完全清除的患者在停藥之后可平均維持皮膚光潔或接近光潔4個月建淘。
為期52周的長期療效數(shù)據顯示,接受tapinarof乳膏治療的成人斑塊狀銀屑病患者浴恐,在療效結果咪枷、生活質量方面均獲得持久改善,未出現(xiàn)療法失效的情況总枢。長期擴展試驗的患者滿意度數(shù)據顯示打恕,81.7%的患者認為這款療法比以前用過的外用療法更為有效。
“我們很高興FDA批準Vtama上市渠缕。它可以用于治療所有銀屑病患者鸽素,不論疾病嚴重程度如何,而且沒有使用時間限制亦鳞♀珊觯”Dermavant首席執(zhí)行官Todd Zavodnick先生表示,“在Dermavant燕差,我們致力于推動以患者為中心的創(chuàng)新遭笋。我們很自豪能夠開發(fā)出一款外用療法,不但在52周里保持療效,而且可以用于所有身體部位瓦呼,包括多種敏感區(qū)域喂窟。我們相信Vtama具有成為銀屑病首選外用療法的潛力⊙氪”
在治療銀屑病之外磨澡,tapinarof目前正在3期臨床試驗中接受檢驗,治療特應性皮炎蹋辅,預計在明年上半年獲得頂線結果阅权。

 研發(fā)追蹤
研發(fā)追蹤
 藥研網
藥研網  2024-11-18
2024-11-18
 285
285

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 261
261

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時間
醫(yī)藥時間  2024-11-18
2024-11-18
 59
59