
 研發(fā)追蹤
研發(fā)追蹤
 2017-01-04
2017-01-04
 5922
5922
來源:LinkDoc視界 ???2017-01-04
有專家稱礁姿,真實世界研究(Real-World Study,以下簡稱RWS)將是未來研究的趨勢铆韭,相對隨機對照試驗(Randomized Controlled Trial丘隙,以下簡稱RCT)而言,RWS的研究范圍更廣盅力,更具有代表性妻行,能夠真實地反映研究的情況舆焕。
RWS代表未來研究趨勢?
RWS是起源于實用性的臨床試驗汉疮,屬于藥物流行病學的范疇棍详。是基于臨床真實的情況采取的一種非隨機、開放性丛剿、不使用安慰劑的研究冒萄,因此其得出的結果具有很高的外部有效性。目前RWS已得到很多醫(yī)學領域的重視橙数,有些學科已經建立了較為完整的觀察性隊列尊流、登記和管理型數據庫。
RWS是以患者為中心的結局研究灯帮,具有以下特點:研究的實施地點以及干預條件為真實的臨床實踐環(huán)境崖技;受試者的選擇一般不加特別的限制條件;干預措施也如臨床實際钟哥,并可由患者和醫(yī)師進行交流而改變干預方法迎献。真實世界研究環(huán)境無盲法,無隨機對照腻贰,無安慰劑治療吁恍,研究的結論可直接推之于臨床實踐。
實際上播演,中國臨床科研里程碑式的跨越也都源于對真實世界的數據研究冀瓦,從2004年發(fā)起的中國慢性病前瞻性研究(KSCDC),到2015年中國癌癥統(tǒng)計數據登上世界殿堂級學術期刊CA(IF:144.8)這都是開展真實世界研究的典型范例写烤,而伴隨這些研究也產生大量高水平的研究成果秘舅。
真實世界研究不僅可以減少傳統(tǒng)研究的限制,而且還可以反映真實世界中治療藥物的臨床療效培车,為臨床選擇使用新藥及新型設備提供客觀的對比依據侦滩。通過真實世界數據證據,充分了解指南與實踐的差距唬研,為指南的制定與規(guī)范提供參考,而且還能平衡臨床療效和成本效益靡庵。
RWS也有“窘境”
雖然真實世界研究有那么多好處尼削,但是也存在一些難題:真實世界研究一般不是以藥品為中心,而是以患者為中心燕汗,藥企是否愿意投入是其中一個問題静瞄;真實世界研究需要大量的研究樣本,甚至多中心事件枣惨,收集數據難度高蓄惫,工作量龐大;數據異質性強,對統(tǒng)計方法的要求比傳統(tǒng)研究更高萨驶;多屬于回顧性分析或事后分析歉摧,研究證據等級受到挑戰(zhàn)。面對如此多的問題腔呜,RWS似乎顯得舉步維艱叁温,這些急需解決的問題需要后來者解決,以推動RWS的發(fā)展核畴。
就在上個月膝但,美國國會在官方網站上公布了《21世紀治愈法案(21st Century Cures Act)》(以下簡稱法案)最終版本, 該法案從提出到一次次修改谤草,再到這次最終版推出跟束,歷經兩年多時間,終于讓這一推動美國未來10年或更長時間內生物醫(yī)學創(chuàng)新研發(fā)丑孩、疾病治療及大健康領域發(fā)展的法案落地生根冀宴。
而法案中關于利用“真實世界證據”取代傳統(tǒng)臨床試驗進行擴大適應癥的批準,更是牽動了業(yè)界的神經嚎杨,對此花鹅,業(yè)內人士認為會加快藥品獲批速度,但也擔憂這降低了審評的科學性枫浙,預示著不良趨勢的開端呐缸,甚至認為是好不容易建立起來的科學審評的倒退,21世紀法案簡直是重回20世紀以前尼缨。
為此疫谱,FDA在《新英格蘭醫(yī)學》上發(fā)表了一篇文章《真實世界證據——它是什么以及它能告訴我們什么?》(Real-World Evidence — What Is It and What Can It Tell Us综货?)嚣惭,呼應法案的同時向外界展示FDA自己的考量。
而此次FDA在《新英格蘭醫(yī)學》發(fā)文也意在澄清兩個問題:一是真實世界證據(Real-World Evidence螃势,以下簡稱RWE)并不等于不采用干預性試驗和隨機化的試驗設計罕擒;二是RWE用于審批仍要遵循嚴格的科學基礎。
這篇文章在糾正目前對于RWE這一概念的誤讀距档,認為它與傳統(tǒng)臨床試驗等其他科學證據的區(qū)別不在于類似隨機對照試驗(RCT)的設計氧液,而在于獲取數據的環(huán)境界定。
而RWE最終用于支持審評審批囱悴,仍要通過科學的研究方法沧仿,對獲得的數據進行合理的組織和解讀,形成有效的結論甫题,而這些研究方法既可以包括干預性甚至隨機對照的設計馁筐,也可以是觀察性的涂召。據此FDA認為,RWE要從兩個維度進行考量敏沉,即數據獲得和研究方法果正。
RWE vs. RCT
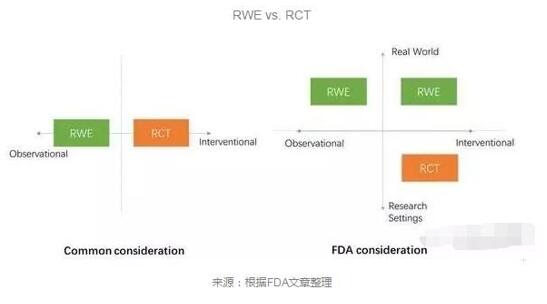
RWS vs RCT :數據的獲得方式及研究方法
RCT以其對無關變量的控制、極其標準化的結果生成形式和專業(yè)化人員的持續(xù)監(jiān)察赦抖,在產生科學證據方面擁有巨大優(yōu)勢舱卡。相對而言,人們往往認為RWE是對于現有臨床實踐證據的總結队萤、分析和解讀轮锥,而這些證據由于缺乏預先設計,難以排除諸多干擾因素要尔,也就難以得出更為真實的結論舍杜。
但在FDA看來,RCT也有其本質上的缺陷赵辕。從科學的角度來說既绩,RCT通過一系列入選排除標準選取一定樣本的特定人群,無法確定在真實臨床實踐中的可推廣性膘掀,另外出于控制變量的設計殿腺,RCT很少獲得關于伴隨疾病和伴隨治療的信息,并且為了依從研究方案往往采取較多的干預措施既倾,這在臨床實踐中也不太現實瓮窑。
從成本角度來說,大型傳統(tǒng)臨床試驗的費用水漲船高队屋,但由此獲得的臨床證據卻沒有得到相應程度的積累拱屈,也就是說,每次審批決策都要重新開展規(guī)模相似的臨床試驗卵手,這意味著成本經濟性較差鸦贩。
相反,RWE植根于真實的臨床實踐诫列,來源相當廣泛垄怯,可以包括電子病歷、醫(yī)保數據庫剂东、電子設備和app诈火、患者登記項目,甚至社交媒體状答。FDA認為,這些資源的合理使用可以產生一些新的價值刀崖。
當然惊科,FDA承認這里存在的問題很多拍摇,比如非研究目的產生的數據如何標準化,并且保證其準確性和可靠性馆截,此外不經過嚴格的知情同意也會帶來數據隱私暴露的風險充活。
但FDA認為這些問題是可以嘗試解決的,包括建立大規(guī)模研究網絡蜡娶,并構建計算化的模型混卵,直接從復雜的數據來源中提取所需的臨床特征數據。最終目的是讓研究人員能夠利用這些特征數據窖张,按照自己的目的識別和構建研究隊列幕随。
大數據將助力RWS
或許未來我們可以看到,通過大數據是可以助力真實世界研究的宿接,因為大數據能幫RWS充分掌握研究背景 赘淮,提出有創(chuàng)新性的研究設想和完善的研究設計。大數據可以提供可利用的多源數據和強大的統(tǒng)計分析醇盏,保證了數據的多元性腔族、重要性和時效性。對于數據的分析可以采用一體化的數據管理模式秘乍,避免原始數據的錯誤羽折,提高數據處理效率和準確性。定制臨床研究云平臺崖郎,加強研究者項目管理水平巍樟,通過各方合作提高科研效率,實現數據的實時化侵念、標準化和格式化帚棚。
相關閱讀:真實世界證據 PK 傳統(tǒng)研究
簡單而言,真實世界證據(RWE)是從傳統(tǒng)臨床科研以外的多個數據集中挖掘出的信息捎虚,涉及的數據集有電子病歷兆性,醫(yī)保理賠,疾病登記庫泳柴,可穿戴設備和移動健康app赋荆。
RWE可以補充從傳統(tǒng)臨床研究方法得到的知識。用傳統(tǒng)方法得到的知識往往很難適用于更廣泛的患者人群懊昨,而且跟實際的臨床環(huán)境也很不相同窄潭;也可以用于藥品研發(fā)、治療有效性研究酵颁、患者管理嫉你、醫(yī)療系統(tǒng)研究和治療安全性分析等。更重要的躏惋,RWE可以研究不同的治療場景幽污,醫(yī)院和醫(yī)療系統(tǒng)對治療效果和結局的影響嚷辅。
以往,傳統(tǒng)臨床試驗是基于特定的患者群和特定的研究環(huán)境(不同于真實的臨床或居家環(huán)境)距误。比如簸搞,臨床試驗會定義很長的入組條件來選擇病人,使用嚴格的CRF (Case-Report Forms)表來記錄信息准潭,并配備專門的人員來監(jiān)督患者的依從性等趁俊。這些嚴格的條件限制了臨床試驗結果在真實世界的適用性。
而RWE的數據跟臨床試驗就很不同完骑,表現在:
1)數據特別雜剩跛,包括電子病歷,醫(yī)保遣备,可穿戴設備拘栅,軟件app,登記庫和社交媒體等休贴;
2)不是為了某個特定研究收集和優(yōu)化的角涯;
3)數據的可靠性不如臨床試驗
RWE可以用于廣泛的臨床研究,比如觀察性研究或者針對特定干預的研究钥陪。在觀察性研究中腻区,RWE可以用來生成前瞻性實驗(Prospective Trials)的假設,評估干預性實驗(Interventional Trials)結果的通用性(generalizability)等螟扮。
目前RWE最被看好的應用領域是得出不同治療方案有效性對比份良,進行因果推理。因為RWE所依賴數據自身的不確定性骏挎,混雜因子的去除是必須的汗忠,甚至需要醫(yī)學統(tǒng)計方法的創(chuàng)新來處理這些不確定性。

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 86
86

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 87
87

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 85
85